서 론
고등생명체에서 지방산과 지방의 생합성은 에너지 항상성 유지를 위한 필수적 수단이다. 대부분 동물에서 체내 지방산의 주요 생합성 장소는 간과 지방조직이다. 그러나 이러한 지방산의 생합성 장소는 동물의 종에 따라 차이가 있다(Table 1). 소, 돼지, 개, 고양이 등은 지방조직(adipose tissues, adipocytes)이 주요 지방합성 장소이다(Stangassinger et al., 1986; Richard et al., 1989; Travers et al., 1997). 닭을 포함한 조류는 간이 주요 합성(약 90% 이상) 장소이며(Li et al., 2017), 합성된 80∼85%의 지방산은 지방조직에 저장된다(Richards et al., 2003). 특히 산란계는 산란기간 동안 간에서 지방합성이 매우 높아, 연간 지방 합성량은 그 개체의 체중과 같은 수준이다(Butler et al., 1975). 사람은 간에서 지방산 생합성이 가장 많이 일어나지만, 지방조직에서도 지방산 합성이 일어난다(Hellerstein et al., 1996). 설치류(쥐)와 토기 등은 간과 지방조직 모두에서 지방산 합성이 이루어진다(Pullen et al., 1990). 현대 양계산업에서 성장위주로 개량된 육계는 지방조직에서 과도한 지방축적이 일어나고, 축적된 대부분의 지방부위는 도체가공 중에 제거되고, 이는 곧 도체율의 감소로 이어진다. 산란계의 출혈성 지방간(liver hemorrhagic syndrome)은 난생산의 급격한 감소도 일어나지만, 심한 경우 폐사에 이르기도 한다. 이와 같이 닭의 지방대사 이상은 생산자의 경제적 손실과 육질의 품질저하로 이어지므로, 닭의 지방대사에 대한 이해와 비정상적 지방대사를 억제하거나 예방하는 것은 학문적으로나 산업적으로 매우 중요하다고 할 수 있다. 따라서 본 논문은 조류인 닭에서 최근까지 연구된 지방대사에 대한 내용들을 기술하고, 지방대사의 이상에 의해 유발되는 지방간(fatty liver) 및 출혈성 지방간에 대한 예방 혹은 지방조직에서 과도한 지방 축적을 억제하기 위한 연구들을 살펴보고자 한다.
본 론
포유류에서 사료로부터 유래된 중성지방은 소장상피세포에서 부분적 분해가 이루어진 후 중성지방으로 재합성이 일어나고 chyromicron을 형성하여 림프계로 흡수된 후 간문맥(흉관)을 통해 순환계와 간으로 들어간다(Butler et al., 1975; Wang et al., 2013). 조류에서도 사료로 공급된 식이성 지방의 흡수는 포유류와 같이 주로 소장에서 일어난다. 소장 상피세포에서 lipase에 의해 부분적 분해가 이루어진 후 재합성이 이루어져 중성지방을 형성한다. 이후의 흡수과정은 포유류와 조류 간에 차이가 있다. 포유류는 chyromicron을 형성하여 림프계로 유입되어 운반되지만, 조류는 protomicron을 형성하여 직접 혈관계로 진입한다(Bensadoun and Rothfeld, 1972)(Table 1). 조류의 경우, 포유류와 같은 림프계가 발달되어 있지 않기 때문에 사료의 지방이 소장에서 흡수되면 lipoprotein 형태로 간문맥(hepatic portal vein; 위 장관에서 나온 혈액이 간으로 들어가는 혈관)으로 바로 유입되는데, 이를 “protomicron”이라 한다(Bensadoun and Rothheld, 1972). Protomicron의 크기(평균 지름 약 150 nm)는 포유류인 사람의 chylomicron(평균지름 약 350 nm; Ruf and Gould, 1999)보다 작고, 조성(약 80∼90%의 중성지방)은 사람과 유사하다(Griffin et al., 1982). Griffin 등(1992)에 의하면 protomicron과 VLDL 중성지방의 6∼7%만이 육계의 복부지방 조직에서 흡수된다고 한다. 대부분의 protomicron과 VLDL의 중성지방은 lipoprotein lipase에 의해 가수분해되어 lipoprotein receptor-mediated endocytosis(lipoprotein 수용체 매개 세포내 유입)에 의해 간에서 흡수된 후 새로운 중성지방으로 재합성되어진다(Sato et al., 1997)(Fig. 1).
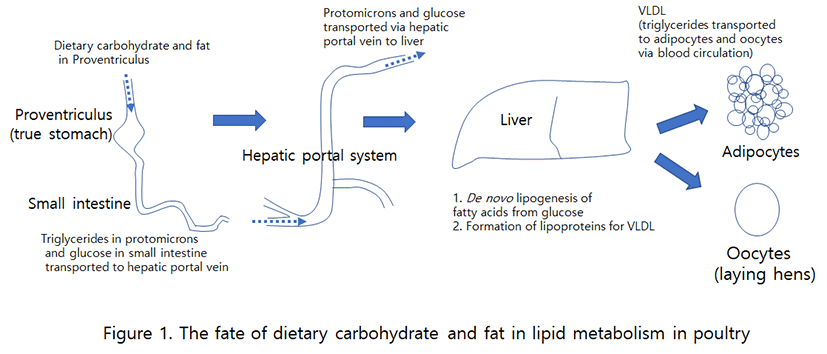
조류의 지방산 생합성(de nove fatty acid synthesis, lipogenesis)은 간에서 대부분 일어나며, 지방조직에서는 제한적으로 그리고 난소에서는 일어나지 않는다(Saadoun and Leclercq, 1987). 개량된 상업용 육계의 경우 10% 이하의 지방이 함유된 사료를 섭취하기 때문에 체내에 필요한 지방은 간에서 탄수화물을 원료로 하여 지방산 생합성을 하여야 한다. 사료로 섭취된 지방은 lipoprotein lipase(LPL)에 의해 가수분해된 다음, 소장 상피세포에서 protomicron을 형성하여 간으로 유입된 다음 지방합성에 이용된다(Fig. 1). 소장에서 식이성 사료 지방으로부터 흡수된 protomicron은 매우 낮은 수준의 함량이기 때문에 간에서 합성, 방출된 VLDL에 의한 중성지방의 공급과 이용성은 지방조직에서 지방의 축적에 크게 영향을 미친다. 시장출하연령에 도달한 육계의 경우 지방조직에 축적된 약 80∼85%의 지방산은 혈중 VLDL로부터 공급받은 것이다(Griffin et al., 1992). 간에서 VLDL의 형태로 중성지방의 방출 또한 동물의 종에 따라 차이가 있다. 소와 양 등은 간에서 지방산의 합성을 거의 하지 않기 때문에 중성지방의 방출은 매우 낮은 반면, 조류의 경우는 간에서 지방산의 합성이 매우 활발하게 일어나서 중성지방이 VLDL로의 방출도 높게 일어난다(Pullen et al., 1990). 탄수화물을 이용한 간에서의 지방산 합성은 포유동물과 유사한 과정을 거친다. 조류의 지방산 생합성은 acetyl-CoA 공급을 위한 식이성 탄수화물의 공급량에 좌우된다. 탄수화물이 섭취되면 인슐린의 자극에 의하여 지방합성효소(fatty acid synthase; FAS)와 malate dehydrigenase(MD)의 활성이 높아진다(Hillgartner et al., 1995). 가금의 체내에 존재하는 지방의 대부분은 탄수화물로부터 유래된 것으로 당의 분해(glycolysis)와 NADPH의 생성은 세포질에서 지방산의 합성에 필수적이기 때문에 지방산 합성은 사료로부터 탄수화물의 공급과 glycolytic system의 활성 정도에 크게 좌우된다. 거위에게 옥수수 기초사료의 고탄수화물을 2주간 과다급여하게 되면 지방산 생합성에 의해 간의 무게가 약 10배로 증가하게 되며, 이는 체중의 약 10%에 달하게 된다고 한다(Hermier et al., 1994). 가금의 경우 간에서 지방산 합성을 위한 NADPH의 공급은 glucose-6—phosphate dehydrogenase (G6PDH)가 아닌 MD의 활성에 의해 제공된다(Mourot et al., 2000). 산란계의 난소는 중성지방의 주요 저장장소가 되는데, 난황형성(vitellogenesis) 요구량에 부합하기 위하여 estrogen의 작용에 의하여 간의 지방산 합성이 급격하게 증가한다(Hermier, 1997). 간에서 지방산 생합성에 의한 주요 산물은 중성지방이지만, 콜레스테롤과 인지질도 주요 합성산물이다. 간에서 합성된 지방들은 간에서 합성된 lipoprotein 구성입자(apolipoprotein)들과 VLDL을 형성하고, 소포체와 골지체를 지나면서 소포(vesicles)에 포장되어 세포 밖으로 분비된다. 분비된 VLDL은 혈관을 타고 지방조직으로 운송되고, 지방조직의 표면에 있는 LPL에 의해 단백질 부분은 분리된다(Fig. 1). 중성지방은 지방산과 글리세롤로 가수분해 되어 주변장기로 운송되어 이용되거나, 지방세포의 막(adipocyte membrane)을 통과한 다음 지방세포 안에서 다시 에스테르화(reesterification/ resynthesis)가 일어나 중성지방으로 지방조직에 저장된다(Nguyen et al., 2008). 따라서 LPL은 지방세포에서 지방산을 흡수하기 위한 필수적인 효소가 된다. 조류에서 지방조직은 지방산과 glyceride의 결합과 glycerol의 생성 측면에서 그리고 지방의 주요 저장소로서 그 중요한 의미를 가진다. LPL은 지방세포와 근육세포를 포함한 다른 세포에서도 합성이 되지만 효소가 분비되어 혈관 세포벽에 부착되어 있는 경우에만 효소의 활성을 갖는다(Hermier, 1997). 즉, 간에서 합성된 지방은 lipoprotein의 형태로 운반되어 지방조직의 표면에 있는 지방분해효소에 의해 단백질 부분은 분리되고, 지방산은 지방세포 내에서 다시 생합성되어 영양적 필요시 혹은 스트레스에 반응하여 이용될 때까지 저장된다. Glucagon과 ACTH에 의해 cAMP가 증가하게 되면 지방분해효소에 의해 빠르게 지방조직에 저장된 지방의 분해가 일어난다. 분해된 지방산은 위급시 에너지 공급원으로서 중요하며, plasma albumin에 의해 각 조직으로 운반되어 미토콘드리아에서 β-산화과정을 거치게 된다(Pugh and Sidbury, 1971). 산란계의 경우, 타 조직에서의 이용을 억제하기 위하여 혈관 내에서 VLDL의 가수분해는 매우 제한적으로 이루어지며(Griffin et al., 1982), 결국 VLDL에 의해 운반된 중성지방은 대부분 난자(oocytes)로 유입되게 하여 난황형성이 효과적으로 일어나게 한다(Fig. 1). 산란계의 VLDL에는 많은 양의 apoVLDL-II가 함유되어 있으며, 이 apolipoprotein은 estrogen의 영향 아래에서 합성되어지고 또한 LPL의 억제자로서 기능도 한다(Schneider et al., 1990). 포유동물에서는 절식과 급식 즉 영양적 조절에 의하여 LPL의 활성이 조절되지만, 조류에서 지방세포의 LPL은 영양적 상태에 적게 영향을 받는다(Hermier et al., 1984). 조류에서 LPL의 호르몬적 조절에 대한 보고는 많지 않지만, 지방조직에서 인슐린은 LPL의 활성을 촉진하고(Borron et al., 1979), dibutyryl cAMP는 이효소의 활성을 억제한다고 한다(Bensadoun and Rothfield, 1972).
유리지방산은 plasma에 순환하는 전체 지방의 약 5% 수준이지만, 이들의 전환율(turnover rate)은 매우 높아 대사적으로 매우 중요하다. 이들 지방산은 호르몬의 자극에 의해 중성지방에서 분리된 다음 plasma albumin에 의해 각 조직으로 운송되고, 그곳의 미토콘드리아에 의해 β-산화과정을 거치게 된다. 조류에서 지방조직으로부터 지방산의 유리는 cyclic AMP에 의한 지방분해효소에 의해 일어나지만, 포유류는 catecholamine이 이와 같은 기능을 대신한다. 그러나 조류에서는 glucagon이 강력한 지방분해 호르몬으로 작용하며(Freeman and Manning, 1974), 체장에서의 glucagon의 농도 또한 포유류와 비교하여 약 10배 이상 높으며, Insulin은 상대적으로 매우 낮아 조류의 대사에서는 비교적 낮은 역할을 하는 것으로 보인다(Hazelwood et al., 1973).
간에서 지방산의 합성은 고탄수화물 섭취에 다른 해당작용(glycolysis)과 연동되기 때문에 과다한 탄수화물의 섭취는 간에서 지방함량의 증가를 유발하는 원인이 된다(Ivy and Nesheim, 1973). 간으로부터 지방의 제거는 lipoprotein의 이용성이 중요한데, 만약 lipoprotein을 합성하는데 필요한 충분한 양의 아미노산 공급이 되지 않으면 간에서 지방의 축적이 일어나게 된다(Flores et al., 1970). Aflatoxin도 지방의 수송을 방해하며(Tung et al., 1972), 콜린, 이노시톨 등의 부족에 따른 phospholipids의 생성 부족, 영양소중 콜린 합성에 필요한 메티오닌, 엽산, 비타민 B12 등의 부족에 의해서도 지방간이 발생할 수 있다(Butler, 1975). 또, 다른 지방간 원인의 기작은 지방 분해율의 감소인데, 비타민(예, 리보플라빈)이나 미량광물질(예, 철)의 결핍은 β-산화에 관여하는 효소들의 보조인자들에 영향을 미쳐 지방간의 유발 원인이 될 수 있다(Scott and Krook, 1972; Amine and Hegsted, 1971). 가장 일반적인 지방간은 육계의 어린 닭에서 볼 수 있으며, 출혈성 지방간은 산란계에서 나타난다. 육계에서 지방간에 노출될 나이는 보통 10∼30일 령이지만 더 어린 경우도 발생할 수 있다. 지방간의 치사율은 약 20% 정도이며, 고온 혹은 저온, 점등관리 실패, 백신 등에 의한 스트레스가 주요 원인이다(Butler et al., 1975). 과잉의 지방은 간, 신장 등에 주로 저장되고, 심근의 지방조직은 작은 혈관들에 의한 충혈로 핑크색을 나타낸다. 병변은 신장의 세뇨관 상피조직과 간에서 작은 출혈 등이 관찰되기도 한다(Butler et al., 1975). 산란계의 출혈성 지방간은 더운 계절에 고체중 품종의 케이지 사육시 특히 잘 발병한다(Wolford and Polin, 1972). 지방증(steatosis)은 간에서 출혈을 동반하기도 하는데, 심한 경우 폐사에 이르기도 하며, 복부에 지방이 과도하게 축적되기도 한다. 산란계의 계란 생산도 감소되기도 하지만 폐사가 일어나기 전까지 병적인 증상을 보이지 않을 때도 있다. 많은 양의 지방(>100 mg/g fresh weight)이 간세포에 축적되면 간의 내부구조의 변형이 일어나는데 주요 성분은 중성지방인 triglyceride, oleic acids와 palmitic acids 등이 많다(Ivy and Nesheim, 1973).
닭의 간에 있는 지방의 주요 기원은 식이성 지방, 지방조직에 저장된 지방, 탄수화물로부터 간에서 생합성된 지방으로 구분된다. 지방의 기원과 관계없이 간에 있는 지방의 배출보다 생성 혹은 유입된 지방의 총량이 더 많게 되면 지방간으로 발전될 수 있다. 육계의 지방간과 산란계의 출혈성 지방간의 생리적 이상은 사료원의 독성물질, 사료성분의 불균형(저단백, 고탄수화물), 사료성분의 결핍성 영양원, 환경적 스트레스 등 많은 요인들에 의하여 지방합성의 증가, 간으로부터 조직이나 기관으로의 지방운송 감소, 지방의 산화 감소 등에 의해 유발된다. 이러한 지방간 유발 원인들을 해소하기 위한 대부분의 연구들은 간에서 지방합성 억제와 지방조직에서 지방축적억제 또는 지방산 산화의 촉진을 위한 연구들로서 그 내용들을 유형별로 소개하면 다음과 같다.
미국에서 열스트레스에 의한 축산업의 손실은 연간 약 169억∼236억 달러로 추산되며, 가금 산업에서만 연간 약 1.3억∼1.7억 달러의 손실이 있는 것으로 추정하고 있다(St-Pierre et al., 2003). 우리나라에서 열스트레스에 의한 축산업의 손실에 대한 보고는 없지만 미국의 예를 보면 그 손실이 작지 않을 것으로 예상된다. 가금류는 온도관련 환경변화에 민감한데, 특히 열 스트레스에 민감하며, 현재 사육되고 있는 개량된 품종들은 예전보다 더 대사적 활성이 높아 체열 생성 또한 많다(Deeb and Cahaner, 2002). 육계에서 만성 열스트레스는 간에서 지방 생합성의 촉진에 의한 지방 축적을 증가시키고, 지방분해 억제와 아미노산 분해는 증가시킨다(Geraert et al., 1996). 이러한 스트레스는 ACTH와 glucagon에 의해 cAMP의 생성을 가속화하면 지방조직 세포로 지방을 운반하는데 관여하는 lipoprotein lipase의 활성을 억제하고, 지방조직 세포에서의 lipase의 작용 시스템은 오히려 강화됨으로써 지방조직에서의 지방의 가수분해와 방출이 증가하게 된다. 그러나 경우에 따라 육계에서 열스트레스를 받으면 사료섭취량이 감소하고, 이는 지방대사에도 영향을 미쳐 간과 혈중 중성지방의 감소와 콜레스테롤의 증가를 일으키지만(Moraes et al., 2003), 타우린의 첨가 급여로 간의 지방합성을 증가시키는 방법도 있다(Shim et al. 2006).
닭에서 섬유질이 풍부한 사료를 급여할 경우, 충분한 에너지를 공급하기 위해서 지방을 첨가해 주거나 아니면 동물 스스로 탄수화물로부터 지방을 합성하여야 한다. 사료에 포함된 지방은 직접 체조직으로 이송되어 저장되고 사료의 탄수화물은 간에서 지방산으로 합성되어 주변 조직으로 운반된다. 사료의 영양적 요소 중 사료 단백질의 함량과 복부지방의 축적량은 서로 반비례하는데, 낮은 사료 단백질함량은 복부지방의 축적을 증가시킨다(Collin et al., 2003). 이는 낮은 사료 단백질이 간의 malic enzyme mRNA의 발현 촉진과 malic enzyme의 활성 증가에 의한 결과라고 한다(Rosebrough et al., 2002). 육계에서 사료 단백질 함량이 높을수록 지방합성 유전자들(malic enzyme, FAS, acetyl coenzyme carboxylase)의 발현이 감소한다(Choi et al., 2006; Rosebrough et al., 2011). 그러나 위와 같은 단백질 수준에 의한 복부지방의 감소효과는 높은 수준(30% 단백질)의 단백질함량에 의한 것임을 감안해야 한다. 특정 아미노산을 사료에 첨가하여 닭의 복부지방 축적을 억제한 사례들을 살펴보면, methionine을 육계사료에 첨가한 경우 지방합성효소의 활성 감소와 hormone sensitive lipase(HSL)의 활성 증가에 의한 지방분해 촉진으로 복부지방을 감소시킬 수 있다(Takahashi and Akiba, 1995). 육계사료에 0.25% 수준의 arginine을 첨가하여 3주간 급여하였을 때 혈중 중성지방과 콜레스테롤의 함량을 감소시켰을 뿐만 아니라, 간에서 지방합성효소의 유전자발현의 억제와 지방산의 β-산화의 증가에 의해 복부지방의 축적을 감소시켰다(Fouad and El-Senousey, 2014). 육용형 오리에 NRC(1994) 사양표준보다 1% 높은 수준의 arginine을 급여하였을 때 malate dehydrogenase와 FAS이 활성 감소로 복부지방함량이 감소하였다고 한다(Wu et al., 2011). Lysine도 3주령부터 4주간 육계사료에 0.7%부터 1.4%까지 첨가하였을 때 lysine 농도가 높아질수록 더 효과적으로 복부지방의 축적을 감소시켰다고 한다(Grisoni et al., 1991). 사료단백질의 적정 수준유지와 methionine, arginine, lysine 등의 특정 아미노산의 추가적인 공급은 닭의 간에서 지방합성을 억제하고, 최종적으로 복부에 축적되는 지방까지 감소함으로서 지방간을 예방할 수 있음을 보여준다.
Betaine은 아미노산인 glycine의 유도체로 3개의 메틸기(—CH3)를 공급할 수 있는데, 육계의 사료첨가제로 0.1% betaine을 22주령부터 약 6주간 공급하게 되면 HSL의 활성 증가, 복부지방에서 FAS 및 LPL의 활성억제에 의한 복부지방 감소 효과를 볼 수 있다고 한다(Xing et al., 2011). Betaine을 250 mg/kg부터 1,000 mg/kg까지 농도를 달리하여 42일령까지 육계에 급여한 결과, 성장에 영향 없이 농도가 증가함에 따라 복부지방이 비례적으로 감소하였으며, 혈중 콜레스테롤, 중성지방도 감소하였다고 한다(Leng et al., 2016). 이러한 결과는 betaine의 첨가 농도에 따라 비례적으로 지방산의 β-산화관련 지표유전자들(PPARα, CPT-1, HADH)의 mRNA 발현증가, 지방합성효소 유전자(FAS, HMGR)들의 발현감소에 기인한다고 하였다.
조류의 지방축적은 혈중 지방의 가용성에 달려 있는데, 이는 결국 사료 또는 간에서의 지방산 합성에 영향을 받는다. 따라서 육계 가금사료의 지방종류가 체지방 축적에 영향을 미칠 수 있으며, 사료의 불포화지방산(해바라기씨유, 대두유)은 간에서 지방합성효소의 활성을 억제함으로써 포화지방산(탤로우)에 비하여 체지방의 축적을 낮게 한다(Sanz et al., 2000; Wongsuthavs et al., 2008). 이러한 결과는 간에서의 지방합성효소의 활성 억제 및 심장에서 지방산의 β-산화와 관련된 효소들(CPT1, HADH))의 활성증가에 기인한다. 포화지방산보다 불포화지방산은 닭의 복부에 적게 축적되는데 이는 불포화지방산이 상대적으로 더 β-산화가 잘 되기 때문이다(Beynen and Katan, 1985; Newman et al., 2002). 불포화지방산의 종류(ⲱ-3 vs ⲱ-6)에 따라 β-산화의 촉진 혹은 지방합성효소의 활성 억제에 의한 작용기전의 차이도 발견할 수 있다. 즉, 아마씨유(flaxseed oil)의 경우, 다가불포화지방산이 높은 linolenic acid를 함유한 ⲱ-3 지방산 구조로서 지방산의 생합성을 억제하는 것보다 지방산의 β-산화를 촉진함으로써 복부지방의 축적을 억제한다(Crespo and Esteve- Garcia, 2002). 육계에서 식이성 ⲱ-3 지방산은 복부지방의 축적량과 지방구의 크기를 감소시키고, 지방산의 산화는 증가시켰다고 한다(Gonzalez-Ortiz et al., 2013).
지방의 종류(포화/불포화)뿐만 아니라 지방산의 구조(fatty acid isomers)도 육계의 지방축적에 영향을 미칠 수 있다. 육계사료의 CLA 첨가는 무첨가에 비하여 복부지방의 축적을 감소시켰으며(Szymczyk et al., 2001), 이러한 감소는 plasma의 LPL 활성감소 및 복부지방 조직에서의 PPARγ mRNA의 발현 억제(Zhou, 2008) 등에 의한 것으로 알려졌다. 치료적 효과를 보기 위하여 약 55주령의 출혈성지방간이 유도된 산란계를 대상으로 통아마씨를 24주간 급여한 결과, 풍부한 ⲱ-3 지방산과 flavonoids 등에 의하여 지방간 증상이 완화되었다고 한다(Davis et al., 2016). 그러나 출혈성 지방간을 유도한 산란계를 대상으로 아마씨를 산란 시작부터 39주령까지 장기간 급여한 결과, 출혈성 지방간 조절에 영향을 미치지 못하였으며(Schumann et al., 2003), 또한 30주령의 산란계를 대상으로 장기간 CLA를 급여하였을 때 오히려 간에 중성지방의 증가에 의한 출혈성 지방간을 유발할 수 있다는 보고도 있다(Cherian and Goeger, 2004). 따라서 이미 출혈성 지방간이 유발된 경우, 노령의 산란계에서는 긍정적인 효과가 나타나지만, 산란초기 혹은 중기에 유발된 출혈성 지방간에 대한 불포화지방산을 이용한 영양적 처리에 대한 효과는 없는 것으로 보인다.
Butyric acid는 사료첨가제로 sodium buyrate 혹은 butyrate glycerides로 공급되며, 소화 장기에서 butyric acid로 유리된다(Vanhoutvin et al., 2009). 육계사료에 3,000 ppm을 첨가하여 21일 또는 41일령까지 급여한 결과, 어린시기뿐만 아니라 시장출하 연령까지 성장률에는 영향을 미치지 않았지만, 두 시기 모두에서 복부지방의 감소, 혈중 콜레스테롤과 중성지방 등이 감소하였다고 한다. 이러한 효과는 지방대사에 관여하는 간과 지방조직에 있는 주요 효소(FAS, LPL 등)의 활성 감소와 PPAR-α signaling pathway상의 유전자 (MMP-1, FABP-2, LPL, APOA5 등)들의 발현 변화에 의한 지방산의 β-산화 향상에 기인된 것이라고 한다(Yin et al., 2016). Butylic acid와 달리 butyrate glycerides는 냄새에 문제가 없고 다루기 쉽기 때문에 사료첨가제로서 이용가능하다고 한다(Namkung et al., 2011).
식물의 저장형 탄수화물의 한 형태인 inulin-type fructan을 육계사료에 10 g/kg 수준 첨가시 혈중 콜레스테롤과 복부지방이 감소하였으며(Yusrizal and Chen, 2003), inulin을 육계사료(10 g/kg)에 첨가하였을 때 체지방 축적 및 혈중 중성지방, VLDL 등의 감소와, 해바라기씨유와 같이 공급하였을 때는 복부와 근내지방에서 다가불포화지방산의 비율을 효과적으로 증가시켰다고 한다(Velasco et al., 2010). Inulin에 의한 이러한 효과는 지방합성관련 유전자발현 감소와 효소들의 활성 억제에 따른 간에서의 지방대사 변화와 지방산의 생합성 및 중성지방의 합성의 감소에 기인한다고 하였다(Beylot, 2005).
아연 이온은 진핵생물에서 필수미량광물질이면서 다양한 생체활성물질로서 기능을 하는데, 닭의 간에서 추출한 지방합성효소를 아연이온에 처리하게 되면 효과적으로 지방합성효소의 활성을 불활성화 시킬 수 있다고 한다(Wang et al., 2003). 그러나 육계를 대상으로 무기태 아연을 사료에 첨가(60∼180 mg Zn sulfate/kg)하여 42일간 시험한 결과, 지방조직 및 간에서 지방합성효소 및 LPL, MD 등의 활성이 오히려 증가한 경우도 있다(Liu et al., 2015). 또한 Zn-nano- sulfate 80 mg/kg을 수준을 42일령까지 육계에 급여한 결과, 도체율 감소와 복부지방의 증가를 보였다고 한다(Mahammadi et al., 2015). 그러나 유기태 Zn 형태인 Zn-Methionine을 40 mg/kg으로 육계사료에 첨가하여 42일령까지 급여한 결과, 성장률 향상뿐만 아니라 혈중 중성지방과 복부지방의 감소, 도체율 향상을 보였다고 한다(Jahanian and Rasouli, 2015). 따라서 육계에서 지방대사에 영향을 미처 복부지방의 축적을 억제하기 위한 아연의 공급형태는 유기태 아연(Zn-methionine, Zn-lysine)이 바람직한 것으로 보인다.
광물질중에서 망간은 육계에서 효과적으로 체지방을 줄일 수 있는데, 망간 100 mg/kg 사료를 42일령까지 급여한 결과, 복부지방에서 LPL과 malate dehydrogense 활성 억제, HSL의 활성 증가에 의하여 복부지방에 축적되는 지방함량이 감소하였다고 한다(Lu et al., 2007). 이 경우도 무기태형(MnSO4․H2O)의 망간보다는 유기태형의 망간(organic Mn)이 복부지방의 축적을 억제하는데 더 효과적임을 보여주었다.
산란계에서 출혈성 지방간의 원인은 영양, 유전, 환경, 호르몬 등 여러 요인이 관여하는 것으로 보인다. 미국 캘리포니아의 경우, 산란기간 약 5%의 폐사가 출혈성 지방간에 의한 것으로 보고된 바 있으며, 급격한 산란율 저하의 원인중 하나로 간주하고 있다(Julian, 2005). 출혈성 지방간의 예방으로는 고항산화제를 급이하면 발병율을 줄일 수 있는 경우도 있지만(Spurlock and Savage, 1993), 효과를 볼 수 없다는 보고도 있다(Schumann et al., 2003).








