Article
정제 봉독의 급여가 육계의 혈청성상, 항산화능 그리고 간 내 지방산 조성에 미치는 효과
김다혜1
,
한상미2
,
최윤상3
,
강환구4
,
이홍구5
,
이경우5,†
Effects of Dietary Bee Venom on Serum Characteristic, Antioxidant Activity and Liver Fatty Acid Composition in Broiler Chickens
Da-hye Kim1
,
Sang-mi Han2
,
Yun-Sang Choi3
,
Hwan-Ku Kang4
,
Hong-Gu Lee5
,
Kyung-woo Lee5,†
Author Information & Copyright ▼
1건국대학교 동물자원과학과 가금학 실험실 학생
2농촌진흥청 국립농원과학원 농업생물부 농업연구관
1Student, Department of Animal Science and Technology, Konkuk University, Seoul 05029, Republic of Korea
2Senior Researcher, National Institute of Agricultural Science and Technology, Rural Development Administration, Wanju 55365, Republic of Korea
3Research Scientist, Korea Food Research Institute, Wanju 55365, Republic of Korea
4Researcher, National Institute of Animal Science, Rural Development Administration, Wanju 55365, Republic of Korea
5Professor, Department of Animal Science and Technology, Konkuk University, Seoul 05029, Republic of Korea
© Copyright 2019, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Mar 05, 2019 ; Revised: Mar 20, 2019 ; Accepted: Mar 20, 2019
Published Online: Mar 31, 2019
ABSTRACT
This study was conducted to investigate the effect of dietary bee venom on serum characteristics, antioxidant activity, and hepatic fatty acid composition in broiler chickens. A group of 875 one-day-old feather-sexed male broiler chicks were randomly allocated to five treatments with seven replicates (25 birds/replicate) for three weeks. A corn-soybean meal-based diet was used as the basal diet. Five dietary treatments were compared: 1) basal diet, 2) basal diet containing 10 μg/kg of bee venom powder, 3) basal diet containing 50 μg/kg of bee venom powder, 4) basal diet containing 100 μg/kg of bee venom powder, and 5) basal diet containing 500 μg/kg of bee venom powder. At 21 days, one bird per pen was slaughtered by asphyxiation in CO2 gas, and blood was collected to measure serum characteristics and antioxidant activity. In addition, the liver was excised to measure the concentration of malondialdehyde and determine fatty acid composition. Increasing dietary bee venom in the diet failed to affect most serum parameters except for triglyceride and non-esterified fatty acids. Dietary bee venom inclusion quadratically increased the concentration of stearic acid (P<0.05), but decreased palmitoleic acid, oleic acid, linoleic acid, mono-unsaturated fatty acids, and poly-unsaturated fatty acids. Finally, dietary bee venom tended to lower hepatic malondialdehyde contents quadratically (P=0.054). In conclusion, our study revealed that dietary bee venom improved antioxidant capacity and affected fatty acid metabolism in broiler chickens.
Keywords: bee venom; broiler chicken; antioxidant activity; fatty acid composition)
서 론
가금산업에서 항생제와 항균제는 육계와 산란계의 생산 성과 강건성을 향상시키는데 뛰어난 효과를 나타내어 오랫동안 사용되었다. 그러나 항생제 사용에 따른 항생제 잔류 축산물 및 소비자의 무항생제 친환경 축산물 선호 등으로 (Hernandez et al., 2004), 성장촉진용 항생제의 사용이 2011년 7월 전면 금지되었다(Berghman et al., 2005). 따라서 항생제를 대체할 친환경 대체 물질 탐색과 효능 평가에 대한 연구가 활발하게 진행되고 있다(Berghman et al., 2005). 항생제의 작용 기전은 항균작용과 면역기능을 개선시켜 가축의 성장과 건강을 높이는 것으로 알려져 있다(Lillehoj and Lee, 2012). 따라서 항균 및 면역조절 능력을 가진 천연물질을 성장 촉진용 항생제 대체가능한 후보 물질로 활용할 수 있다. 이러한 물질 중 항생제를 대체할 수 있는 유망한 후보물질은 동식물 및 곤충 등에서 유래한 항균성 펩타이드가 있다(Bulet et al., 1999; Lehrer and Ganz, 1999; Wang et al., 2016). 특히 봉독은 항염증(Habermann and Riez, 1965; Vick and Shipman, 1972; Dunn and Killion, 1988; Rudenko and Nipot, 1996; Kwon et al., 2001), 통증 억제(Kwon et al., 2002), 항균작용(Han et al., 2009; Han et al., 2010) 및 면역조절(Hoffman, 1977; Banks and Shipolini, 1986) 등의 다양한 생리적 활성이 있다고 보고되고 있다. 봉독은 오래전부터 다양한 질환에 사용되어 왔으며, 강력한 항균, 항염증 효과를 갖는 순수한 천연 물질이기에 부작용과 잔류에 대한 위험성이 낮다(Han et al., 2009). 봉독에서 유래된 항균 펩타이드인 멜리틴(melittin)은 봉독의 주요 펩타이드 성분이며, 항염증 및 항균 작용을 하는 것으로 보고되었다(Son et al., 2007). 정제 봉독에는 멜리틴 외에 phospholipids의 대사에 중요한 효소인 phospholipase A2를 포함하고 있으며(Gattaz et al., 1987) 숙주 면역을 증가시키는 것으로 알려져 있다(Palm et al., 2013). 정제 봉독은 멜리틴과 phospholipase A2의 생물학적 효능으로 인해 병원균을 치료하고, 질병에서 유래된 염증성 질환 치료를 위해 사용되어 왔다(Jo et al, 2012). 또한 멜리틴은 흉선세포 자극을 통해서 실험동물의 생존율을 높이고(Shaposhnikova et al., 1997), 돼지의 호흡기 질환 치료에도 효과적으로 작용하였으며(Choi et al, 2003), 주사나 음수를 통해 어린 자돈과 육계에게 투여 및 급여하였을 때 생산성을 증가시키는 것으로 보고하였다(Han et al., 2009; 2010; Kim et al., 2018). 이러한 봉독의 가축 생산성 증대 효과를 바탕으로 최근 농업과학원에서는 정제 봉독을 활용하여 산업 동물에 이용하고 있으며, 더 나아가 봉독을 보조사료 또는 사료첨가제로 등록하고자 하는 절차를 추진하고 있다. 본 연구에서는 국내에서 사양되는 서양종 꿀벌(Apis mellifera)에서 채취하고, 분리 정제한 봉독이 육계의 지방산 대사, 항산화능 및 혈청 성분에 미치는 영향을 알아보고자 실시하였다. 봉독이 육계의 생산성에 미치는 효과는 이미 보고되었다(Kim et al., 2018).
재료 및 방법
1. 봉독과 실험용 사료
실험에 사용된 봉독은 서양종 꿀벌(Apis mellifera)에서 얻어졌으며, 봉독 채집장치(청진테크, 한국)를 벌집 입구에 설치하여 채취하였다. 채취된 봉독은 차가운 증류수에 녹인 뒤 원심분리(10,000 × g, 4℃, 15 min) 하였다. 원심분리 후 상층액을 건조하여 정제한 뒤 실험에 사용되기 전까지 4℃에서 보관하였다. 실험에 필요한 봉독 premix는 1 g의 정제된 봉독을 부형제와 첨가하여 100 mg/kg, 10 mg/kg 되도록 제조하였다. 두 종류의 premix를 이용하여 각각 10 μg/kg, 50 μg/kg, 100 μg/kg, 500 μg/kg 농도가 되도록 실험 사료를 제조하여 실험에 이용하였다.
2. 공시동물 및 사료
총 875수의 Ross 308 수평아리를 공시하여 35개의 펜(pen)을 설치한 평사에서 5개의 실험구, 7반복으로 펜당 25수씩 임의 배치하여 3주 동안 사육하였다. 옥수수와 대두박 위주의 기초사료(Table 1)는 대조구 사료로 사용하였으며, 정제 봉독은 두 가지 premix를 기초사료에 각각 0.1%와 0.5%씩 섞어 실험 사료를 제조하여 10 ppb, 50 ppb, 100 ppb 및 500 ppb가 되도록 혼합하였다. 실험기간 동안 물과 사료에 자유롭게 접근하여 섭취할 수 있도록 하였으며, 계사 내 온도는 첫 주에는 32℃를 유지하였으며, 점차적으로 감소시켜 23℃로 유지하였다. 동물의 관리 및 취급은 건국대학교 동물실험윤리 위원회의 규정을 준수하고 승인을 받았다(KU16107).
Table 1.
Composition and specifications for the experimental diets (%, as-fed basis)
| Ingredients (%) |
|
| Ground corn |
51.31 |
| Soybean meal (44% CP) |
29.34 |
| Wheat (12% CP) |
7.00 |
| Corn gluten meal (60% CP) |
4.00 |
| L-Lysine-HCl (78%) |
0.13 |
| DL-Methionine (98%) |
0.24 |
| Dicalcium phosphate |
2.05 |
| L-Threonine |
0.07 |
| Choline (50%) |
0.10 |
| Salt |
0.30 |
| Limestone |
1.14 |
| NaHCO3 |
0.05 |
| Tallow |
4.00 |
| Vitamin premix1 |
0.12 |
| Mineral premix2 |
0.15 |
| Total |
100.00 |
| Nutrient composition (%) |
|
| AMEn3 (kcal/kg) |
3,170 |
| Crude protein4 |
20.56 |
| Crude fat4 |
6.27 |
| Ca4 |
1.04 |
| Available phosphorus3 |
0.46 |
| Total phosphorus4 |
0.87 |
| Lysine3 |
1.15 |
| Methionine3 |
0.59 |
| Methionine+cystein3 |
0.95 |
Download Excel Table
3. 간의 지방산 분석
육계의 간내 지방산 함량을 측정하기 위해 각 펜에서 평균 체중을 가지고 있는 1수를 선발하여 이산화탄소를 통하여 안락사시킨 뒤 즉시 간을 채취하였다. 분석 전까지 간을 냉동 보관하였다. 약 15 g의 간을 클로로포름:메탄올(2:1, vol/vol) 용액에 넣어 균질기를 이용하여 균질화 한 뒤 지질을 추출하였다(Folch et al., 1957). 분리된 지질은 methylation을 시킨 후, hexane에 녹여 gas chromatography(HP 7890 Series)를 이용하여 분석하였다. 또한, 실험사료의 지방산 조성은 동일한 방법으로 분석하여 Table 2에 제시하였다.
Table 2.
Fatty acid composition of the basal diet
| Fatty acid |
% of total fatty acids |
| Myristic acid (C14:0) |
1.617 |
| Palmitic acid (C16:0) |
25.67 |
| Palmitoleic acid (C16:1) |
3.52 |
| Stearic acid (18:0) |
10.20 |
| Oleic acid (18:1) |
44.03 |
| Linoleic acid (18:2) |
13.20 |
| Linolenic acid (18:3) |
1.570 |
| Arachidonic acid (20:4) |
0.103 |
| ∑SFA1 |
37.49 |
| ∑MUFA1 |
47.55 |
| ∑PUFA1 |
14.87 |
Download Excel Table
4. 혈청성분 분석
혈청의 성분을 분석하기 위해 각 펜에서 평균 체중을 가지고 있는 1수를 선발하여 이산화탄소를 통하여 안락사시킨 뒤 심장에서 혈액을 채취하였다. 혈청 샘플은 자동 혈액 화학 분석기(COBAS MIRA plus, ROCHE diagnostics, Basel, Switzerland)를 사용하여 total cholesterol, triglycerides, glucose, glutamic oxalacetic transaminase(GOT), glutamic pyruvate transaminase(GPT), phosphorus, creatinine, non-esterified fatty acid(NEFA), blood urea nitrogen(BUN)의 함량을 측정하였다.
5. 항산화능 측정
혈청과 간에서 항산화능을 측정하기 위해 각 펜에서 평균 체중을 가지고 있는 1수를 선발하여 이산화탄소를 통하여 안락사시킨 뒤 심장에서 혈액을 채취하였다. 혈청 샘플은 QuantiChrom antioxidant assay kit(BioAssay Systems, Hayward, CA, USA)를 사용하여 혈청 내 총 항산화능을 측정하였으며, 혈청 내 superoxide dismutase(SOD) 농도는 SOD kit(Sigma, St. Louis, MO, USA)를 사용하여 측정하였다. 모든 분석은 제조사의 권장 방법으로 진행하였다.
간에서의 thiobarbituric acid(TBA) 함량은 Tarladgis et al.(1960)의 방법을 수정해서 분석하였다. 채취한 간 샘플 5 g을 으깬 후에 0.3%의 butylated hydroxy toluene(BHT) 0.1 mL가 들어있는 증류수 25 mL에 넣어 균질화 하였다. 가열하기 전 증류수 23.75 mL와 4N HCI 1.25 mL를 첨가하여 증류하여 약 30 mL 정도의 증류액을 수집하였다. 5 mL의 증류액과 0.02M의 TBA 5 mL를 혼합한 뒤 100℃의 항온수조에서 35분 반응시켰다. 10분 동안 냉각 후 반응액은 538 nm에서 흡광도(optical density)를 측정하여 다음의 공식을 이용하여 계산하였다.
6. 통계분석
실험을 통해 얻은 모든 자료들은 SAS 9.4(SAS Institute Inc., Cary, NC, USA)의 General Linear Model(GLM) 방법으로 분석하였으며, 봉독의 첨가 수준의 linear, quadratic contrast coefficient를 계산하기 위해 interaction matrix language (IML) 방법을 사용하였다. 실험단위는 펜으로 설정하였으며, 통계적 유의성은 P-value가 0.05보다 적을 때 유의하다고 하였다.
결과 및 고찰
본 연구에 이용한 봉독은 정제과정을 통하여 독성 성분을 제거하고, 건조된 봉독으로 40% 이상의 멜리틴을 포함한 펩타이드 물질과 효소, 생리적 활성 아민 등 다양한 물질들을 포함하고 있다(Kim et al., 2007). 과거에는 살아있는 벌을 이용한 봉침요법으로 직접 피부에 주사하는 방식으로 사용하였는데, 숙련된 기술자가 아니면 시술이 어려운 단점이 있으며, 벌 종류와 일령에 따른 봉독 성분 함량 차이로 일정한 양의 주사가 어려워 그 효능에 차이가 발생하였다. 최근에는 봉독 채집기의 개발과 정제 기술의 발달로 안전한 봉독을 가축의 치료와 사료첨가제로 사용할 수 있게 되었다. 본 연구에서는 독성이 제거된 정제 봉독을 육계 사료에 첨가하여 육계의 지방산과 혈청 성분에 미치는 효과를 조사하였다.
사료에 첨가한 봉독은 육계 혈액 내 total cholesterol, glucose, GOT, GPT, total protein, albumin, globulin, Ca, P, LDL, creatinine, NEFA, LDL 콜레스테롤, HDL 콜레스테롤, BUN 농도에는 아무런 영향을 미치지 않았다(Table 3). 그러나 혈청 내 triglyceride와 NEFA의 농도는 사료 내 봉독의 함량이 증가할수록 21일령 육계에서 혈청 내 농도가 감소(quadratic, P<0.05) 또는 증가하였다(quadratic, P<0.05).
Table 3.
Effect of graded levels of dietary bee venom on serum profiles in broiler chickens1
| Items2 |
Bee venom concentration (ppb) |
SEM4 |
P-value |
| 0 |
10 |
50 |
100 |
500 |
L3 |
Q3 |
| d 21 |
|
|
|
|
|
|
|
|
| TCHO (mg/dL) |
111.0 |
119.3 |
113.9 |
111.0 |
104.6 |
5.773 |
0.146 |
0.858 |
| TG (mg/dL) |
124.9 |
89.00 |
83.14 |
51.14 |
89.71 |
17.119 |
0.701 |
0.009 |
| GLU (mg/dL) |
193.9 |
160.1 |
92.43 |
129.0 |
146.1 |
31.126 |
0.817 |
0.103 |
| GPT (U/L) |
4.429 |
5.429 |
5.286 |
5.143 |
5.143 |
0.417 |
0.787 |
0.507 |
| GOT (U/L) |
198.3 |
209.6 |
211.4 |
208.6 |
206.4 |
13.426 |
0.970 |
0.680 |
| ALB (g/dL) |
1.314 |
1.386 |
1.357 |
1.300 |
1.243 |
0.049 |
0.076 |
0.789 |
| P (μM/L) |
13.90 |
12.16 |
11.37 |
11.84 |
12.53 |
1.329 |
0.973 |
0.332 |
| Ca (μM/L) |
9.386 |
7.757 |
8.557 |
7.886 |
8.629 |
0.626 |
0.892 |
0.300 |
| Creatinine (mg/dL) |
0.151 |
0.121 |
0.117 |
0.117 |
0.160 |
0.020 |
0.913 |
0.192 |
| NEFA (mmol/L) |
265.3 |
495.6 |
499.3 |
605.5 |
453.5 |
105.725 |
0.774 |
0.035 |
| HDL cholesterol |
70.86 |
84.86 |
77.71 |
79.57 |
69.57 |
5.737 |
0.189 |
0.493 |
| LDL cholesterol |
20.29 |
16.57 |
21.71 |
17.57 |
16.86 |
3.528 |
0.575 |
0.992 |
| BUN (mmol/L) |
3.286 |
3.000 |
2.857 |
2.571 |
2.857 |
0.383 |
0.689 |
0.228 |
Download Excel Table
혈청의 생화학 성분은 건강 또는 병리적 대사 상태를 평가하는 지표로써(Lumeij and De Bruijne, 1985), triglyceride는 혈청 내 지질 수준으로 가축 체내에서 이용가능한 지방 함량을 나타내는 지표 성분이다(Chou et al., 2012). 혈청 내 triglyceride는 봉독의 첨가량이 증가할수록 유의하게 감소하였으며, 이는 봉독이 지방의 소화 또는 대사 과정에 영향을 미쳤음을 시사하는 결과로 추측되었다. 혈액 지표 중 하나인 NEFA는 사료섭취량이 줄어들거나 인슐린이 부족한 개체에서 특히 증가하며(Kurima et al., 1994; Proszkowiec-Weglarz, et al., 2017), glycerol에 결합되지 않는 지방산으로 동물 체내에서 발생하는 지방 분해 수준을 나타내는 지표로 활용된다. 본 연구에서는 봉독의 첨가 수준이 증가할수록 21일령 육계에서 혈청 내 NEFA의 농도가 증가하였는데, 이는 봉독이 지방의 lipolysis에 효과적으로 작용하여 혈청 내 triglyceride 감소와 더불어 NEFA 농도는 증가하였다. 따라서 봉독은 가축의 지방 대사에서 합성보다는 산화를 촉진하는데 효과적으로 작용하는 것으로 추측되었다.
혈청 내 GOT 및 GPT 함량은 봉독 처리에 따른 차이가 발견되지 않았다(Table 3). 혈청 내 GOT와 GPT 수준은 간의 기능을 나타내는 지표로서, 외부 스트레스 등 간에 자극이 있는 때 증가하는 것으로 알려져 있다. 본 연구에서는 봉독에 따른 차이가 발견되지 않았는데, 이는 봉독의 첨가 수준이 육계의 간의 대사생리 작용에 부정적인 영향을 미치지 않았다는 것으로 해석될 수 있어 기능성 첨가제로서 사용될 수 있음을 시사하는 결과라 할 수 있다.
Phospholipase A2등 봉독 구성 성분이 실험동물에서 지방대사에 영향을 미쳤다는 연구 결과(Fain et al., 1981; Uscian and Stanley-Samuelson, 1993; Labonté et al., 2010)를 바탕으로, 본 연구에서는 조직 내 지방산 조성을 분석하였다. 사료 내 봉독 급여에 따른 육계의 간 내 지방산 조성을 Table 4에 제시하였다. 간 내 지방산 총 함량 중 palmitic acid(16:0), stearic acid(18:0), oleic acid(18:1) 및 linoleic acid(18:2)가 90% 이상을 차지하였다. 사료 내 봉독 첨가 수준이 증가할수록 불포화 지방산인 palmitoleic acid(16:1)의 농도가 감소하였다(quadratic, P<0.05). 하지만, palmitic acid의 함량은 차이가 없었으나, stearic acid(18:0)의 함량은 봉독 첨가 수준이 증가할수록 증가하였다(quadratic, P<0.05). 결과적으로 봉독 첨가 수준이 증가할수록 간 내 총 포화지방산 함량은 증가하고, 단가 불포화 지방산과 다가 불포화 지방산은 유의적으로 감소하였다(quadratic, P<0.05). 이러한 결과는 봉독이 de novo fatty acid synthesis 단계에는 영향을 미치지 못하였으나, elongation 과정은 촉진하고 desaturation 과정은 억제하여 palmitoleic acid의 함량은 낮추었으나 stearic acid의 함량은 높인 것으로 추측되었다. 향후 지방산 합성과 대사에 관여하는 효소 활력을 평가한다면 봉독이 지방 대사에 미치는 효과를 구명할 수 있을 것으로 판단되었다.
Table 4.
Effect of graded levels of dietary bee venom on hepatic fatty acid composition (% of total fatty acids) in broiler chickens1
| Items2 |
Bee venom concentration (ppb) |
SEM4 |
P-value |
| 0 |
10 |
50 |
100 |
500 |
L3 |
Q3 |
| d 21 |
|
|
|
|
|
|
|
|
| Myristic acid (C14:0) |
0.878 |
0.500 |
0.510 |
0.644 |
0.490 |
0.094 |
0.203 |
0.508 |
| Palmitic acid (C16:0) |
30.96 |
32.14 |
32.35 |
30.99 |
29.41 |
1.060 |
0.118 |
0.867 |
| Palmitoleic acid (C16:1) |
3.585 |
2.417 |
1.892 |
1.862 |
2.245 |
0.245 |
0.195 |
0.001 |
| Stearic acid (18:0) |
8.740 |
14.71 |
17.83 |
17.15 |
16.52 |
1.533 |
0.142 |
0.007 |
| Oleic acid (18:1) |
35.42 |
34.75 |
32.35 |
33.02 |
34.52 |
1.402 |
0.906 |
0.175 |
| Linoleic acid (18:2) |
17.67 |
12.08 |
11.58 |
14.62 |
14.27 |
1.254 |
0.963 |
0.372 |
| Linolenic acid (18:3) |
0.540 |
0.967 |
1.262 |
1.108 |
1.410 |
0.206 |
0.069 |
0.188 |
| Arachidonic acid (20:4) |
0.223 |
0.223 |
0.288 |
0.228 |
0.303 |
0.025 |
0.065 |
0.867 |
| ∑SFA |
40.58 |
47.33 |
50.68 |
48.79 |
46.42 |
2.164 |
0.822 |
0.037 |
| ∑MUFA |
39.01 |
37.13 |
34.24 |
34.88 |
36.77 |
1.531 |
0.920 |
0.069 |
| ∑PUFA |
18.44 |
13.25 |
13.13 |
15.96 |
15.99 |
1.304 |
0.696 |
0.520 |
Download Excel Table
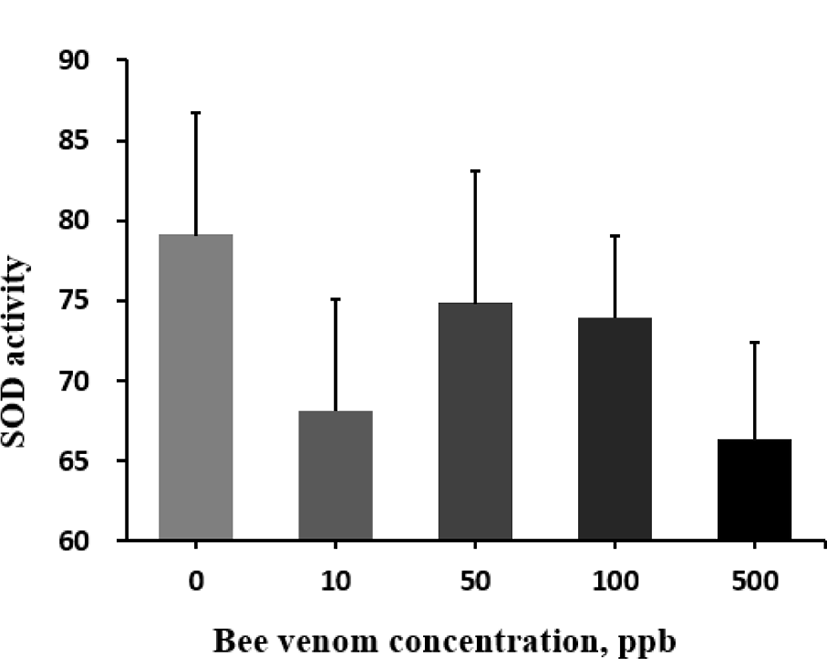
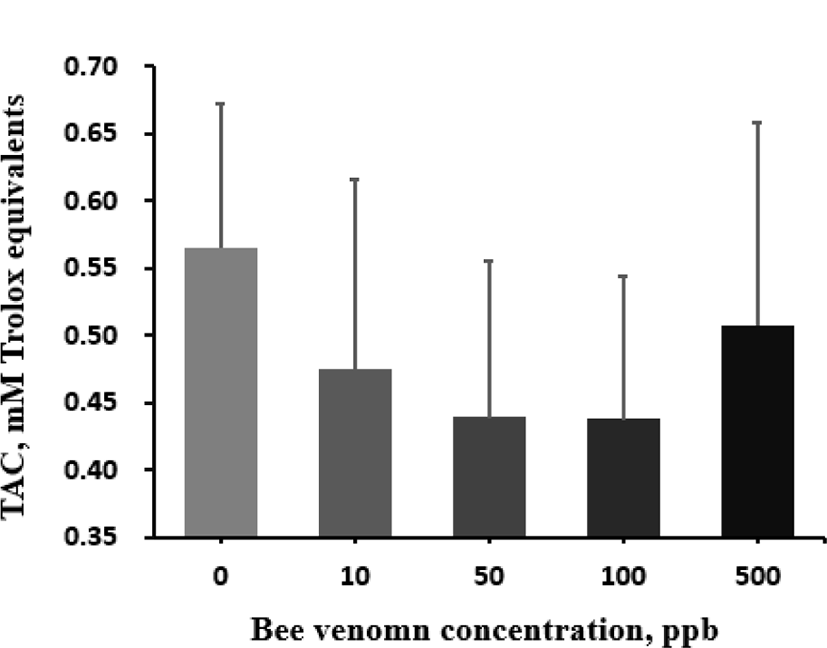
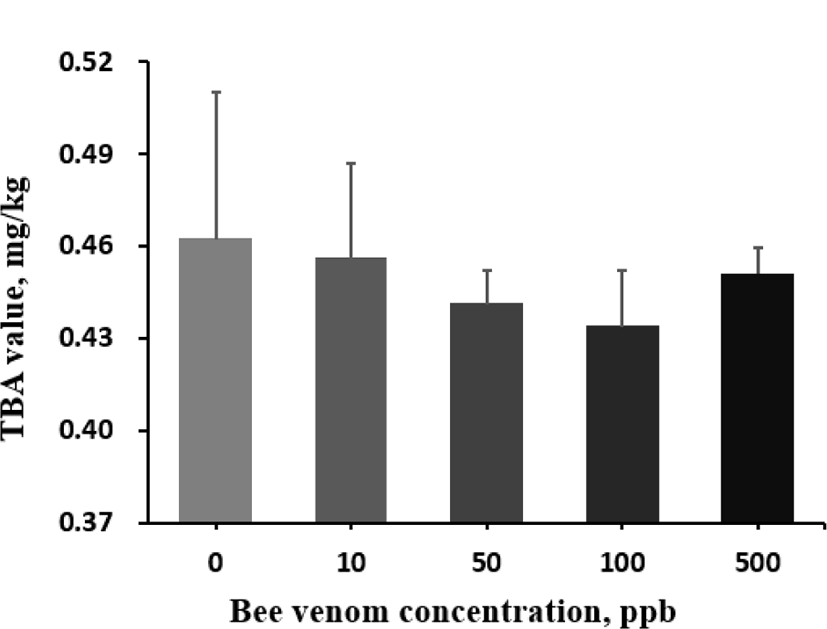
봉독이 육계의 항산화능을 높인다는 결과(Han et al., 2010)를 바탕으로 본 연구에서는 다양한 항산화 지표를 조사하였다. 혈액 내 SOD 활성도(Fig. 1)와 TAC(Fig. 2)는 대조구와 봉독 처리 간에 어떠한 유의적인 차이도 발견되지 않았다. 하지만, 간의 MDA 농도는 봉독의 첨가 수준이 증가할수록 낮아졌으나, 고 수준의 봉독에서는 반대로 증가하여 봉독이 MDA에 미치는 효과는 quadratic 반응을 보여주었다(quadratic effect, P=0.054; Fig. 3). MDA는 산화 스트레 스 또는 지방 산화의 지표로 종종 조직 또는 혈청 내에서 함량을 측정하여 평가한다. 위 논문에서는 따라서 사료 내 봉독 첨가는 육계에서 각종 스트레스를 저감할 수 있는 기능성 첨가제로 활용될 수 있는 가능성을 나타냈다. 향후 항산화에 관여하는 효소 또는 비효소적 지표의 분석을 통하여 봉독의 항산화 기전을 밝히는데 추가적인 연구가 필요할 것으로 보인다.
Fig. 1.
Effect of graded levels of bee venom on antioxidant activity in serum of broiler chickens.
Each mean represents 7 replicates with 25 birds/replicate. SOD activity, superoxide dismutase activity.
Download Original Figure
Fig. 2.
Effect of graded levels of bee venom on total antioxidant capacity in serum of broiler chickens.
Each mean represents 7 replicates with 25 birds/replicate. TAC, total antioxidant activity.
Download Original Figure
Fig. 3.
Effect of graded levels of bee venom on hepatic malondialdehyde contents in broiler chickens.
Each mean represents 7 replicates with 25 birds/replicate. TBA value (mg of malonaldehyde [MDA]/kg of sample) = thiobarbituric acid.
Download Original Figure
적 요
본 연구는 사료 내 첨가된 봉독이 육계의 혈청 성분, 항산화능 및 간 내 지방산 조성에 미치는 영향을 조사하기 위해 수행하였다. Ross 308 1일령 육용종 수평아리를 공시하여, 5개의 처리에 7 반복으로 반복 당 25수씩, 총 875수를 완전임의배치하여 실험을 진행하였다. 기초사료는 옥수수 및 대두박 위주의 사료를 사용하였으며, 정제 봉독을 기초사료에 10 μ/kg, 50 μ/kg, 100 μ/kg, 500 μ/kg 수준으로 첨가하여 5주간 급여하였다. 실험 21일차에 펜당 1수의 육계를 CO2가스로 안락사시킨 뒤 혈액 샘플을 채취하여 혈액지표와 항산화능을 측정하였다. 또한, 간 샘플을 채취하여 간 내 malonaldehyde 함량과 지방산 조성을 분석하였다. 사료 내 봉독 첨가는 triglyceride와 NEFA를 제외한 나머지 혈청 성분에는 영향을 미치지 않았다. 봉독 첨가 수준이 증가할수록 간 내 지방산의 불포화 지방산(palmitoleic acid, oleic acid, 그리고 linoleic acid)은 감소하였으나(quadratic, P<0.05), 간 내 stearic acid 함량은 반대로 증가하였다. 마지막으로 간 내 MDA 함량은 봉독 첨가 수준이 증가할수록 감소하였다. 본 연구에서 육계 사료 내 봉독 첨가는 항산화능을 높이고, 지방산 대사에 영향을 미치는 것으로 조사되었다.
(색인어: 육계, 정제 봉독, 항산화능, 지방대사)
사 사
본 연구는 농촌진흥청 차세대바이오그린21사업(과제번호: PJ01188202)에 의하여 수행되었습니다.
REFERENCES
Banks BEC, Shipolini RA 1986 Chemistry and pharmacology of honey-bee venom. Pages 329-416 In: Venoms of the Hymenoptera. Piek, T. ed. Academic Press, London.


Bulet P, Hetru C, Dimarcq JL, Hoffmann D 1999 Antimicrobial peptides in insects; structure and function. Dev Comp Immunol 23(4-5):329-344.


Chou CH, Chang YY, Tzang BB, Hsu CL, Lin YL, Chen YC 2012 Effects of taurine on hepatic lipid metabolism and anti-inflammation in chronic alcohol-fed rats. Food Chem 135(1):24-30.


>Dunn JD, Killion JJ 1988 Effect of melittin on pituitaryadrenal responsiveness to stress. Eur J Endocrinol 119(3): 339-344.


Fain JN, Kabnick KS, Li SY 1981 Effects of melittin on adipocyte metabolism unrelated to lysophospholipid accumulation. Biochim Biophys Acta Biomembr 677(2):274279.


Folch J, Lees M, Sloan-Stanlet GHS 1957 A simple method for the isolation and purification of total lipids from animal tissues. J Biol Chem 226(1):497-509.


Gattaz WF, Köllisch M, Thuren T, Virtanen JV, Kinnunen PK 1987 Increased plasma phospholipase-A
2 activity in schizophrenic patients: Reduction after neuroleptic therapy. Biol Psychiatry 22(4):421-426.


Habermann E, Reiz KG 1965 On the biochemistry of bee venom peptides, melittin and apamin. Biochem Z 343(2): 192-203


Hoffman DR 1977 Allergens in bee venom: III. Identification of allergen B of bee venom as an acid phosphatase. J Allergy Clin Immunol 59(5):364-366.


Kim MK, Lee SH, Shin JY, Kim KS, Cho NG, Rhim TJ, Kwon KR 2007 The effects of bee venom and sweet bee venom to the preadipocyte proliferation and lipolysis of adipocyte, localized fat accumulation. J Pharmacopunture 10(3)5-19.


Kwon YB, Lee HJ, Han HJ, Mar WC, Kang SK, Yoon OB, Beitz AJ, Lee JH 2002 The water-soluble fraction of bee venom produces antinociceptive and anti-inflammatory effects on rheumatoid arthritis in rats. Life Sci 71(2): 191-204.


Kwon YB, Lee JD, Lee HJ, Han HJ, Mar WC, Kang SK, Beitz AJ, Lee JH 2001 Bee venom injection into an acupuncture point reduces arthritis associated edema and nociceptive responses. Pain 90(3):271-280.


Labonté ED, Pfluger PT, Cash, JG, Kuhel DG, Roja JC, Magness DP, Jandacek RJ, Taschöp MH, Hui, DY 2010. Postprandial lysophospholipid suppresses hepatic fatty acid oxidation: The molecular link between group 1B phospholipase A2 and diet-induced obesity. FASEB J, 24(7): 2516-2524.




Lehrer RI, Ganz T 1999 Antimicrobial peptides in mammalian and insect host defence. Curr Opin Immunol 11(1): 23-27.


Rudenko SV, Nipot EE 1996 Modulation of melittin-induced hemolysis of erythrocytes. Biokhimiia 61(12):2116-2124.


Shaposhnikova VV, Egorova MV, Kudryavtsev AA, Levitman MK, Korystov YN 1997 The effect of melittin on proliferation and death of thymocytes. FEBS Lett 410(2-3):285288.


Tarladgis BG, Watts BM, Younathan MT, Dugan L 1960 A distillation method for the quantitative determination of malonaldehyde in rancid foods. American Oil Chemists Society 37(1):44-48.


Uscian JM, Stanley-Samuelson DW 1993 Phopholipase A
2 activity in the fat body of the tobacco hornworm
Manduca sexa. Arch Insect Biochen Physiol 24(4):187-201.



Vick JA, Shipman WH 1972 Effects of whole bee venom and its fractions (apamin and melittin) on plasma cortisol levels in the dog. Toxicon 10(4):377-380.