서 론
아연(Zn)은 동물체에서 요구되는 필수 미량원소로서 수많은 생물학적 기능이 있다고 알려지고 있다. 체 조직에서 특히 아연은 300 여종이 넘는 다양한 효소의 합성 및 활성도에 직간접적으로 관여하는 광물질로서 단백질 합성 등 대사기능 조절작용에 중요한 영향을 미치는 것으로 보고되었다(Prasad and Kucuk, 2002). 따라서 닭에서 아연이 결핍되면 성장, 사료이용성, 번식 및 질병 발생과 등과 같은 다양한 문제가 유발된다(Stahl et al., 1986; Sahin et al., 2009; Bun et al., 2011). 최근에는 아연이 면역작용, 항산화 작용 및 열 스트레스 저감 등과 같은 중요한 역할이 보고되면서 다양한 아연 제제의 개발, 이용 및 허용 수준 등에 대한 많은 연구가 이루어지고 있다(Sahin et al., 2009; Liu et al., 2015; Kim et al., 2018).
지금까지 연구결과에 따르면 아연을 섭취할 경우, 소장, 간 등 다양한 장기에 존재하는 아연 운반체가 아연의 흡수, 대사 및 분비에 중요한 생리적 역할을 한다(Hara et al., 2017). 아연은 소장점막 상피세포에서 흡수되어 소장의 metallothionein 단백질과 함께 결합되어 축적되거나 또는 혈장에서 알부민과 결합되어 간으로 이동되며(Prasad, 1995), 이들 metallothionein 계열의 단백질은 소장, 췌장, 간, 신장 등 다양한 장기에 존재한다고 밝혀졌다(Kimura and Kambe, 2016).
닭의 영양대사에 중요한 기능을 담당하는 아연의 영양소 요구량은 40 ppm(NRC, 1994)에서 50 ppm(Korea Feeding Standard for Poultry, 2007) 수준이다. 그러나 현재 다양한 실증연구를 근거로 상업용 배합사료에 혼합하는 아연 수준은 요구량보다 훨씬 높은 60∼100 ppm 정도이다. 아연이 결핍되면 식욕감퇴, 성장 및 사료효율 감소, 뼈 약화 등 닭의 생산성에 직접적인 영향을 미쳐 경제적 손실을 초래한다고 알려져 있다(Underwood and Suttle, 1990; Sahin et al., 2009). 이와 더불어 다양한 동물에서 아연의 결핍은 점막세포 형태와 소화효소 활성도 변화를 유발하고, 소화기능 감소로 궁극적으로 동물의 생산성 저하를 초래한다는 연구결과들이 보고되었다(Park et al., 1985; Ying et al., 2011; Martin et al., 2013). 또한, 닭에서 아연의 급여량을 증가시킬 경우 소장흡수세포의 구조와 소화효소의 활성도를 변화시켜 성장률을 증가시킬 수 있고(Hu et al., 2013; Tang et al., 2014), 아연이 결핍될 경우 탄수화물과 단백질의 대사기능에 직접적인 영향을 초래한다(Liu et al., 2015).
Huang et al.(2007)의 연구에 따르면 아연 운반단백질 및 아연 metalloenzyme 효소 발현 등을 근거로 21일령 육계에서 84 ppm 수준의 아연급여(ZnSO4·7H2O)가 최적의 수준이라고 발표하였다. 그러나 살모넬라 감염 닭에서 120 ppm 수준의 아연을 급여 시 소장의 점막세포 손상을 억제하고(Zhang et al., 2012), 육계에서 150 ppm의 Zn-methionine을 급여했을 경우, 발바닥 피부병 발생을 감소시킨다(Abd El-Wahab et al., 2013). 이와 같이 아연의 급여수준과 더불어 유기태 킬레이트 화합물의 개발 등으로 아연의 화학적 형태가 닭에서 아연의 생체 이용률에 직접적으로 영향을 미친다. 단백질 결합된 아연과 나노입자 아연제제가 무기태 아연보다 체내 이용률을 증가시켜 아연이 가진 생리적 기능을 활성화 시키는 것으로 보고되고 있다(Yu et al., 2017; Abedini et al., 2018).
따라서 본 연구의 목적은 적정수준으로 알려진 아연 함량에 무기태 및 유기태 아연을 50 ppm 보충급여하여 급여수준과 급여 형태가 닭의 생산성 및 소화 작용에 미치는 영향을 조사하는 것이다. 본 시험에서는 한국 재래계를 이용하여 기초사료에 50 ppm의 산화아연(ZnO)과 Zn-methionine을 각각 첨가하여 생산성 및 사료이용성, 장기무게, 혈액생화학적 성상 및 소화효소 활성도에 미치는 영향을 조사하였다.
재료 및 방법
시험동물은 3주령 수컷 한국 재래계 144수를 사용하였으며, 시험설계는 완전 임의배치방법에 따라 대조군(CON), 무기태 아연(산화아연, ZnO) 급여군(50 ppm) 및 유기태 아연 급여군(Zn-methionine, 50 ppm) 등 3군(n=6, 8수/케이지)으로 설정하고, 1주간 적응기간을 거처 본 시험기간(4주)동안 시험사료를 급여하였다. 아연제제로서 무기태아연은 산화아연(ZnO)를 유기태아연은 Zn-methionine(®Zn-120, Avalia, Zinpro Corp, USA)을 각각 사용하여 50 ppm씩 보충 배합하였다.
기초사료는 상업용 산란계 어린 병아리 사료로서 옥수수, 대두박 위주로 배합한 것으로 원료 및 영양소 함량은 Table 1에 제시하였다. 시험사료의 아연 함량 분석결과는 91 ppm 수준으로 나타났다. 시험 사료는 닭이 충분히 먹을 수 있는 양을 자유 급여하고, 음수는 자동 급수기로 공급하였다. 점등 관리는 부화 후 종야점등을 실시하고, 시험개시 후 4주령 동안 자연일조에 따라 실시되었다. 각 케이지에는 8수를 수용하여 농림축산식품부의 지침을 준수하였다. 계사의 환경온도는 23∼25℃에서 정도를 유지하였고, 기타 사양관리는 경남과학기술대학교 종합농장 동물사육장의 사육관리방법에 준하여 실시하였다. 동물실험은 본 대학의 동물실험윤리위원회(IACUC)의 허가를 받아 실시하였다.
1 Contained per kg of diet: vit A, 10,0000 IU; vit D3, 2,000 IU; vit E, 421 IU; vit K, 5 mg; riboflavin, 2,400 mg; vit B2, 9.6 mg; vit B6, 2.45 mg; vit B12, 40 μg; niacin, 49 mg; pantothenic acid, 27 mg, biotin, 0.05 mg.
사양시험기간 동안 체중 및 사료섭취량은 시험개시(4주령) 및 시험 종료(8주령)에 측정하고, 증체량과 사료요구율 을 계산하였다. 사양시험 종료 후 즉시 각 처리군 당 평균체중에 가까운 8수(n=8)를 선발하여 체중을 측정하고, 경정맥을 절개하여 sodium heparin이 함유된 진공 시험관에 채혈을 하였다. 혈액 생화학적 성분 분석을 위해 3,000 rpm에서 20분간 원심 분리한 혈장을 —70℃에 냉동 보관하였다.
혈중 생화학성분 중 glucose, total protein, triglyceride, total cholesterol, aspartate aminotransferase(AST), alanine aminotransferase(ALT) 등을 자동혈액생화학분석기(Mindray, BS-120, Mindry Bio Medical Electronics co., Shnzhen, China)를 이용하여 분석하였다.
복강을 절개하여 간, 소장, 비장 및 췌장을 채취하고 이들 장기무게는 체중 100 g 당으로 환산하여 표시하였다. 소화효소분석에 사용할 췌장은 생리식염수로 세척하여 액체질소로 동결하였다. 소장은 위 유문부 아래부터 결장 앞부분까지의 소장 전체 부위를 채취하였다. 전체 소장에서 십이지장 및 공장에 해당되는 맹낭 부위까지 약 60%를 전반부(proximal), 나머지 45%를 후반부(distal)로 구분하였다. 소장 전반부에 해당하는 부위의 장간막 지방을 제거하고, 생리식염수로 3회 연속으로 세척한 후 내용물을 제거하였다. 십이지장 및 공장부위에 해당하는 전반부를 절개한 후 grass slide을 이용하여 점막세포를 분리하고, 화학저울을 이용하여 점막무게를 측정하였다. 일정량의 생리식염수를 혼합하여 5,000 rpm에서 원심분리(Vision, VS-15,000 CF) 후 점막세포를 세척하고 효소활성도 분석에 사용하고자 분석 시까지 —70℃에 냉동 보관하였다.
췌장의 효소 활성도 측정하기 위해 전체 췌장을 Tris buffer 용액(pH; 7.4)에서 tissue grinder로서 균질화한 후 5,000 rpm에서 10분간 분리하여 상등액을 취하였다. 췌장 α-amylase는 1% 전분기질을 분해할 수 있는 효소량을 dinitrosalicyclic 용액으로 발색시켜 분광광도계(540 nm)로 측정하였다. 표준용액으로는 maltose를 이용하여 표준곡선을 조사하였다(Bernfeld, 1955). 췌장 trypsin은 균질액에 0.1 U enterokinase를 넣어 trypsinogen을 활성화시켜 benzoyl-L-arginine ethyl ester를 기질로 사용하여 분광광도계로서(253 nm) 5분 동안 매 1분 간격으로 kinetics 조사하여 활성도를 측정하였다(Geiger and Fritz, 1986). Carboxy peptidase A 활성도는 췌장 균질액이 hippuryl-L-phenylalanine를 분해하는 속도를 분광광도계(254 nm)를 사용하여 4분 동안 변화되는 값으로 측정하였다(Folk and Schirmer, 1963).
소장 점막세포는 균질기로서 mannitol buffer(150 mM mannitol, 10 mM tris base, 30 mM succinate, 5 mM K2HPO4; pH 7.4)를 적정비율로 혼합하여 균질화하였다. 소장점막세포에서 효소를 분리하기 위해 2% triton X-100을 혼합한 샘플을 실온에서 30분 정도 방치하였다. 이어서 4℃, 5,000 rpm에서 원심분리하여 얻은 상청액으로 아래의 효소활성도를 측정하였다. 이당류분해 효소인 maltase와 sucrase는 Dahlgvist(1968)의 방법을 ELISA reader에 적합하게 변형한 방법으로 분석하고, 최종 분해산물인 glucose는 Sigma glucose assay kit로서 450 nm에서 측정하였다. Leucine aminopeptidase(LAP) 활성도는 Gal-Garber and Uni(2000)의 방법을 변형한 것으로 leucine p-nitroaniline를 기질로 사용하여 ELISA reader를 사용하여 405 nm에서 측정하였다. 각 조직의 단백질 분석은 BCA 방법(Pierce BCA protein, Assay Kit 23225)으로 570 nm에서 ELISA reader로서 측정하였다. 효소의 특이적 활성도(specific activity)는 전체 활성도에서 단백질 mg당 농도로 나누어 표시하였다.
아연급여원에 따른 닭의 생산성, 장기무게, 혈액생화학 성분 및 소화효소 활성도에 미치는 영향은 SAS package program(SAS, 1996)을 이용하여 General Linear Model(GLM) 절차에 따라 유의성을 검정하였다. 유의차가 인정될 때 Tukey 방법에 의한 처리 간 유의성 검정(95%)을 실시하였다.
결과 및 고찰
한국 재래계에서 산화아연(ZNO군) 또는 유기태(Zn-methionine, ZMT군) 아연을 4주 동안 급여 후 체중, 증체량, 사료섭취량 및 사료요구율에 미치는 결과는 Table 2에 나타낸 바와 같다. 닭의 사양성적 결과를 살펴보면 체중은 ZNO 및 ZMT군에서 대조군(CON)과 비교 시 각각 1.2% 및 2.4% 증가하는 경향을 보였지만 유의적 차이는 없었다. 사료섭취량 역시 아연첨가군들이 대조군에 비해 증가되었으나 통계적 차이는 없었고, 사료요구율 또한 처리군간 차이를 발견할 수 없었다. 이러한 결과로 보아 기초사료에 무기태 또는 유기태 형태로 50 ppm을 추가로 아연을 급여할 경우 한국 재래계의 생산성에는 영향을 미치지 않았다.
아연 급여 후 채취한 장기의 상대적 무게(g/100 g 체중)를 조사한 결과는 Table 3에 제시한 바와 같다. 간, 비장 및 소장점막 무게는 아연의 급여 및 아연의 화학적 형태에 따른 차이를 보이지 않았다. 그러나 췌장의 상대적 무게는 산화아연 급여군(ZNO)에서 대조군 및 유기태 아연급여군(ZMT)에 비해 유의하게 감소되었다(P<0.05).
본 시험에서 나타난 결과를 고찰하면 기초사료(100 ppm)에 무기태 또는 유기태 아연을 각각 50 ppm 추가로 급여한 경우 체중과 사료이용성은 차이는 없었다. 이러한 결과는 Liu et al.(2015)의 연구에서 ZnSO4와 Zn-amino acid 킬레이트를 급여하였을 때 체중, 증체, 사료섭취량 및 사료요구율에서 처리 간 차이가 없었다고 한 보고와 일치한다. Huang et al.(2007)의 아연급여량과 육계 생산성에 관한 연구결과, 기초사료(28.4 ppm)에 아연을 농도별(0 ppm, 20 ppm, 40 ppm, 60 ppm, 80 ppm, 100 ppm, 120 ppm 및 140 ppm)로 보충 급여한 결과, 20∼140 ppm의 아연처리군에서 체중, 사료섭취량 및 사료요구율 등은 차이가 없었다고 보고하였다. 그러나 장기의 아연의 축적률을 조사한 결과 췌장과 뼈에서 아연 급여수준에 비례적으로 증가한다는 사실을 보고하였다(Huang et al., 2007). Bun et al.(2011)도 육계의 기초사료(29.6 ppm)에 유기태 Zn을 농도별(0 ppm, 20 ppm, 40 ppm 및 60 ppm)로 보충 급여한 결과, 체중 등과 같은 생산성 지표에는 영향을 미치지 않았다고 하였다. 그러나 산란계에서 산화아연(50 ppm 및 100 ppm) 또는 Zn-methionine(50 ppm 및 100 ppm)을 보충 급여한 결과, Zn-methionine 100 ppm 급여군에서 사료섭취량이 증가(Abd El-Hack et al., 2018)하고 생산성이 증가된다는 연구결과도 보고되고 있다(Hu et al., 2013; Wen et al., 2018).
지금까지 연구결과를 종합하면, 닭의 사료내 급여하는 총 아연의 수준은 NRC 사양표준의 최소 요구량인 40 ppm을 만족할 경우 생산성 및 사료이용성에 미치는 영향은 크지 않으며, 최대 168.4 ppm을 급여하여도 생산성에는 영향을 없는 것으로 보인다. 본 시험에서도 성장 중인 한국 재래계에게 아연을 150 ppm 수준으로 급여 시에도 생산성 및 사료이용성에는 영향을 미치지 않는 것으로 생각된다.
한국 재래계에서 산화아연 또는 Zn-methionine을 급여에 따른 혈액생화학적 성상에 대한 결과는 Table 4에 나타낸 바와 같다. 혈액생화학 성분 중 glucose, total protein, triglyceride, total cholesterol 함량은 처리군 간 차이가 없었다. 또한, 간 손상지표로 알려진 AST 및 ALT 역시 4주 동안 아연 급여 후 조사한 결과에서 모든 처리군에서 비슷한 정상적인 수준을 보였다.
혈액의 생화학적 성상에서 본 연구결과를 유사하게 Salim et al.(2012)은 육계의 기초사료에 유기태 아연을 29 ppm 첨가급여 시 혈중 glucose, cholesterol 등과 같은 성분은 차이가 없었음을 보고하였다. 또한, Kaya et al.(2001)도 산란계에게 아연을 수준별(0 ppm, 25 ppm, 50 ppm, 100 ppm 및 200 ppm) 급여 시 혈액의 glucose, total cholesterol 및 HDLcholesterol 등에 아무런 영향을 미치지 않았다고 보고했다. 그러나 Abedini et al.(2018)은 산란계에서 산화아연(50 ppm 및 100 ppm) 또는 Zn-methionine (50 ppm 및 100 ppm)을 보충 급여한 결과, Zn의 급여는 triglyceride, total cholesterol 수준의 현저히 변화를 유발하는 것으로 보고하였다. 또한 Abedini et al.(2018)은 산란계에서 80 ppm의 산화아연 기초사료에 첨가한 결과 혈액의 total protein, albumin, glucose의 수준을 증가시킨다고 보고하였다. 혈액중 간 조직 손상 지표인 AST와 ALT 등은 간 또는 근육 조직에서 아미노산과 탄수화물의 대사 작용에 관여하는 효소로서 이들 조직의 손상이 발생되면 혈액으로 유입되어 급격하게 증가되므로 간 독성을 판단하는 지표이다(Giannini et al., 1999). 본 시험에서 산화아연 또는 Zn-methionine을 급여한 결과, AST 및 ALT 농도는 모든 처리군에서 차이 없이 정상수준을 보여 간 독성을 초래하지 않는 것으로 판단된다. 따라서 혈액 생화학적 성분을 조사한 결과를 종합하면 100∼150 ppm 수준의 아연의 급여는 재래계에서 간 손상을 초래하지 않고 영양소 대사작용에 유의한 영향을 미치지 않는 것으로 생각된다.
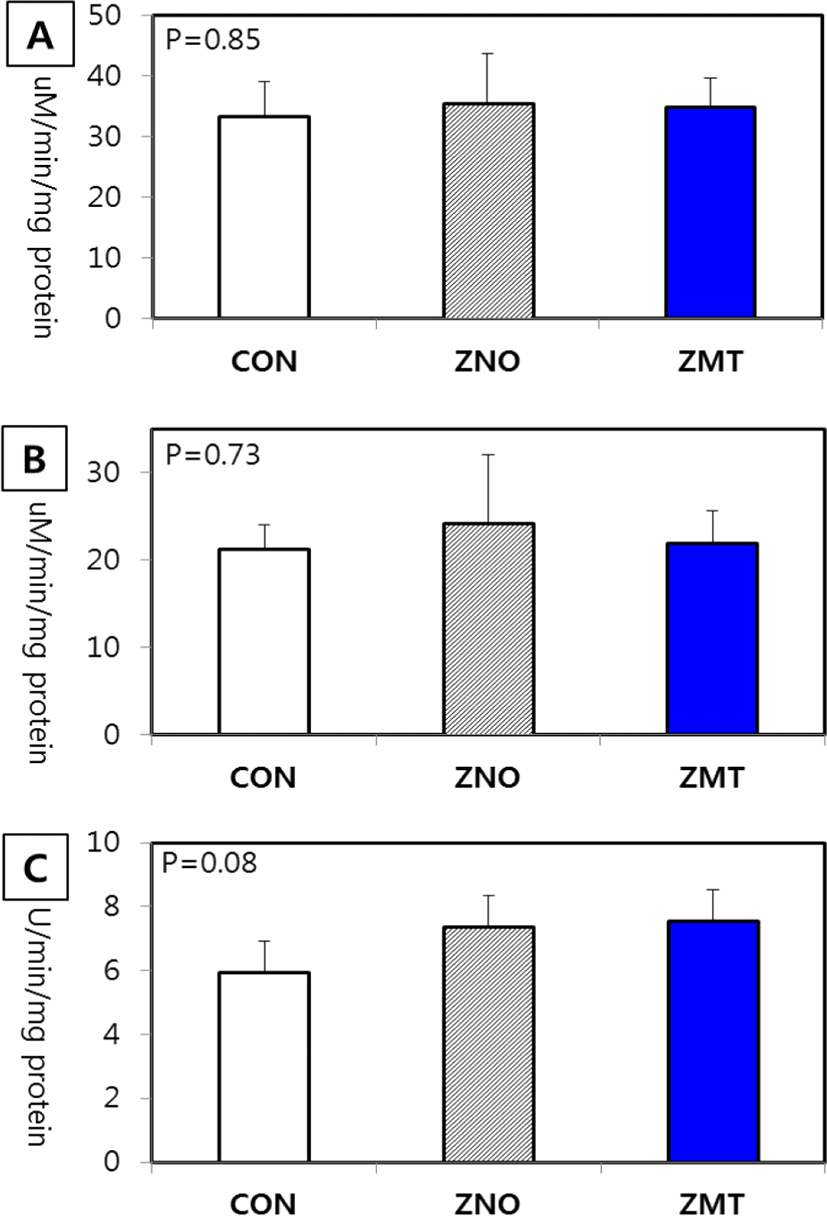
한국 재래계에서 산화아연 또는 Zn-methionine을 급여 후 췌장 및 소장점막 효소의 활성도를 조사한 결과는 Fig. 1 및 2에 각각 나타내었다. 전분 분해효소인 α-amylase와 단백질 분해 효소인 carboxypeptidase A 활성도는 아연의 보충급여 및 급여원에 따른 차이는 없었다. 췌장의 주요한 단백질 분해효소인 trypsin은 ZnO 또는 Zn-methionine 50 ppm 보충급여에 따라 활성도가 유의하게 증가되었다(Fig. 1B). 그러나 산화아연 급여군에서 췌장의 무게가 대조군(CON) 및 ZMT군에 비해 현저하게 감소되므로 췌장 조직 전체 trypsin으로 보면 ZMT군에서 trypsin 활성도가 가장 높을 것으로 생각된다. 한편, 소장의 흡수상피세포에 존재하는 이당류 분해효소(maltase 및 sucrase)를 분석한 결과, 모두 Zn 급여원에 따라 차이를 보이지 않았다(Fig. 2). 펩타이드 분해효소인 leucine aminopeptidase의 활성도는 ZnO 급여 또는 Zn-methionine 급여에 따라 증가하는 경향(P=0.08)을 보였으나 유의적 차 이는 인정되지 않았다(Fig. 2C).
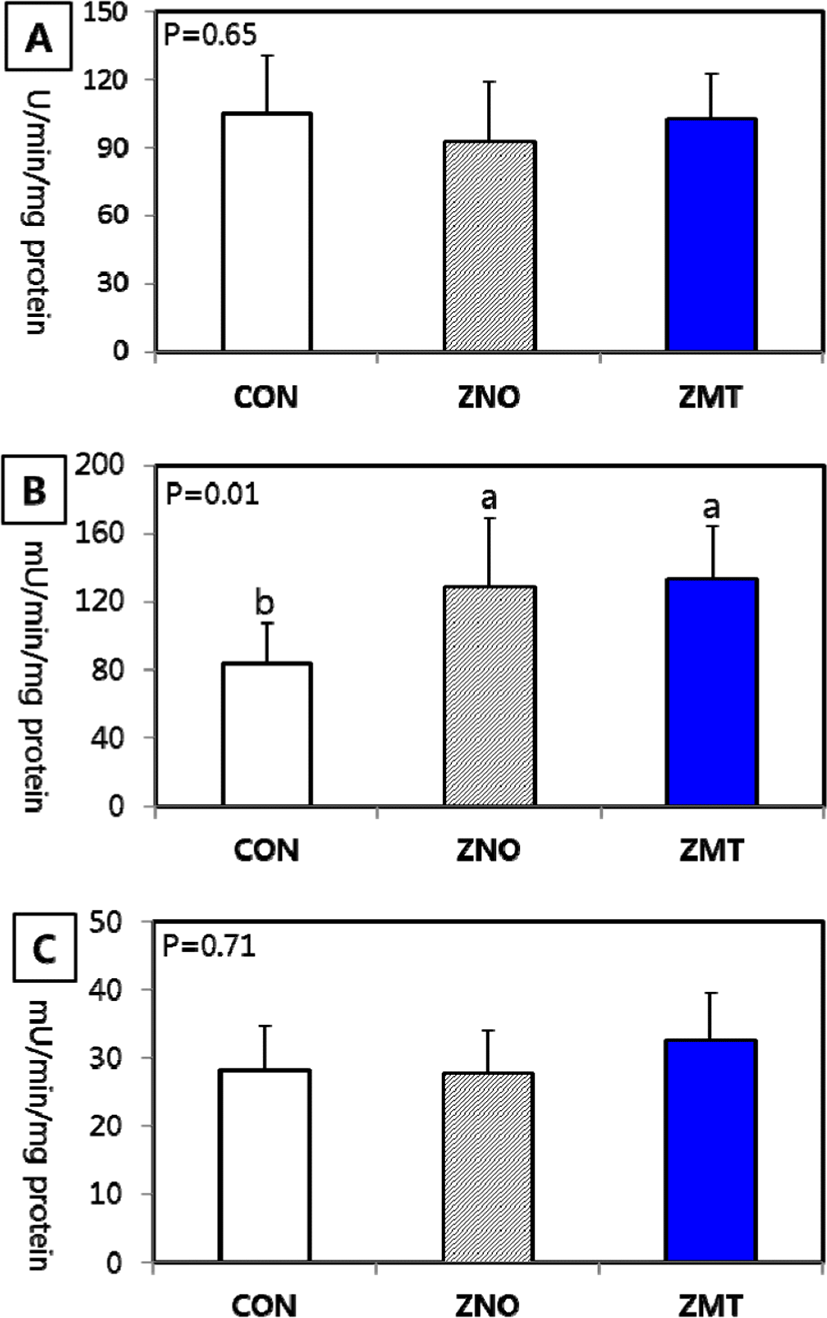
지금까지 Zn 급여가 췌장 및 소장의 소화 효소발현에 영향을 미칠 수 있다는 여러 연구들이 발표되었다. 먼저 닭에서 100 ppm의 산화아연을 급여한 결과 췌장에서 Zn 농도가 현저히 증가되었다(Lu et al., 1988). 또한 Huang et al.(2007)이 기초사료(28.37 ppm)에 아연을 농도별(0 ppm, 20 ppm, 40 ppm, 60 ppm, 80 ppm, 100 ppm, 120 ppm 및 140 ppm)로 보충 급여하여 장기에서 아연의 축적률을 조사한 결과, 특히 췌장에서 아연 급여수준에 비례하여 증가되었음을 보고했다. 따라서 아연급여에 따라 췌장이 가장 민감하게 영향을 받는 장기 중의 하나로 생각되며, 췌장에 존재하는 효소의 분비 또는 활성도에 영향을 미칠 수 있다. Hu et al.(2013)이 60 ppm의 ZnSO4와 Zn-montmrillonite 급여 시 췌장과 소장의 소화액에서 trypsin 활성도가 현저히 증가되었다고 보고하여 본 연구에서 얻은 결과와 유사하였다. 돼지에서도 고수준의 아연을 급여 시 췌장에서 분비되는 trypsin과 amylase 등과 같은 췌장효소의 활성도가 증가하였다고 보고된바 있다(Hedemann et al., 2006).
또한, 랫드에서도 Zn 결핍 사료를 급여한 결과 소장점막의 DNA, sucrase, maltase, lactase 및 leucine aminopeptidase 등의 효소가 현저히 감소되는 사실을 보고하여, Zn이 소장 흡수상피세포의 기능에 영향을 미친다는 사실을 증명한바 있다 (Park et al., 1985; Ying et al., 2011). 최근 오리를 이용한 연구에서 13 ppm, 30 ppm, 60 ppm, 120 ppm, 240 ppm 및 100 ppm 수준의 ZnSO4를 급여한 결과, 아연수준이 증가될수록 소장의 형태학적 변화 및 소장의 구조를 긍정적으로 변화시키는 것으로 나타났다(Wen et al., 2018). 닭에서도 기초사료(80 ppm)에 각각 50 ppm 또는 100 ppm의 산화아연을 급여한 결과, 100 ppm 급여군에서 소장의 leucine aminopeptidase의 활성도가 현저히 증가되었다(Ghiasi ghalehkandi et al., 2011). 또, 랫드에서도 Zn 결핍(3 ppm), 적정 수준(46 ppm) 및 고수준(234 ppm)으로 아연을 급여한 결과, 소장 maltase 활성도는 Zn 결핍군에서 감소되고 고수준의 급여군에서 현저히 증가되었다(Jiang et al., 2009).
이와 같이 Zn 급여가 췌장 및 소장의 소화효소의 활성도를 증가시킨다고 보고한 연구 결과를 살펴보면, 특히 Zn 결핍은 췌장에서 trypsin과 amylase 등과 같은 효소의 활성도를 감소시키고, 결과적으로 영양소의 소화율을 저하시킨다(Brugger and Windisch, 2016). 췌장 효소의 활성도 및 분비량의 감소는 소장에 존재하는 이당류 및 펩타이드 분해 효소의 활성도를 연쇄적으로 저하시킬 수 있다. 또한 고수준의 Zn은 장관에 감염된 병원성 미생물에 대한 항균효과로 소장의 융모세포의 면역성을 높여 점막구조의 손상을 방지하고, 미세 융모막에 존재하는 가수분해효소의 활성도를 유지할 수 있다(Hu et al., 2013; Tang et al., 2014; Troche et al., 2015; He et al., 2019). 따라서 본 연구에서 나타난 바와 같이 한국재래계에서 아연의 보충급여는 췌장 및 소장에 존재하는 단백질 소화효소의 활성도를 증가시키며, 나아가 단백질의 생체 이용성에 긍정적인 효과를 미칠 수 있을 것으로 판단된다.
적 요
본 연구는 Zn 보충급여가 한국재래계의 생산성 및 소화 기능에 미치는 영향을 조사하기 위하여 기초사료(100 ppm)에 ZnO 또는 Zn-methionine 형태로 각각 50 ppm을 첨가하여 체중, 사료이용성, 장기무게, 혈액생화학적 성상 및 소화효소 활성도를 조사하였다. 사양성적을 보면 대조군(CON)에 비해 산화아연(ZNO) 및 유기태(ZMT)군에서 체중은 각각 1.2% 및 2.4% 증가되는 경향을 보였지만 유의적 차이는 없었다. 사료섭취량과 사료요구율 역시 모든 처리군에서 차이가 없는 것으로 나타났다. 간, 비장 및 소장점막 무게는 아연의 급여 및 화학적 형태에 따른 차이가 없었으나, 췌장 무게는 ZNO군에서 대조군과 ZMT군에 비해 유의하게 감소되었다(P<0.05). 혈액 생화학 성분인 glucose, total protein, triglyceride, total cholesterol, aspartate aminotransferase(AST)와 alanine aminotransferase(ALT) 등은 ZnO 또는 Zn-methionine 급여에 따른 차이가 없었다. 췌장 효소활성도를 조사한 결과 α-amylase와 carboxypeptidase A 활성도는 아연의 급여에 따른 차이가 없었으나, trypsin은 ZnO와 Zn-methionine 급여에 따라 활성도가 현저히 증가되었다(P<0.05). 소장의 흡수상피세포에 존재하는 이당류분해효소(maltase 및 sucrase)는 Zn 급여원에 따라 차이를 보이지 않았다. 펩타이드 분해효소인 leucine aminopeptidase의 활성도는 ZnO 급여 또는 Zn-methionine 급여에 따라 증가하는 경향을 보였다(P=0.08). 이상의 결과로 보아 기초사료에 Zn의 보충급여(50 ppm)는 닭에서 단백질 소화작용에 관여하는 효소의 활성도 증진효과를 보이며, 단백질의 생체 이용성 향상에 긍정적인 영향을 미칠 수 있는 것으로 생각된다.








