Article
병아리의 발생시기 및 육성계절이 열 스트레스 반응과 생산능력에 미치는 영향
Effect of Hatching and Brooding Season of Chicks on Their Heat Stress Response and Production Performances
Eun Jung Cho1
,
Eun Sik Choi2
,
Sea Hwan Sohn3,†
Author Information & Copyright ▼
1Researcher, Department of Animal Science and Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
2Student, Department of Animal Science and Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
3Professor, Department of Animal Science and Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
© Copyright 2019, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Mar 08, 2019 ; Revised: Apr 10, 2019 ; Accepted: Apr 15, 2019
Published Online: Jun 30, 2019
ABSTRACT
This study was conducted to compare the heat stress response and production performance of chicks hatched in winter and summer. Among the 2,090 Korean native chickens examined, 1,156 hatched in winter and 934 hatched in summer. The amount of telomeric DNA, the expression of heat shock protein (HSP) genes, survival rate, egg production, and body weight were analyzed to evaluate the stress response and production performance of chickens. The results showed that the expression of HSP-70, HSP-90α, and HSP-90β genes in the winter-hatched chickens were significantly higher than those in the summer-hatched chickens during the growing and laying period (P<0.05). There was no significant difference in the amount of telomeric DNA between summer- and winter-hatched chickens. The survival rate was significantly higher in the summer-hatched chickens than in the winter-hatched chickens at the laying period (P<0.01). The hen-day egg production and egg weight in the summer-hatched chickens were also significantly higher than those in the winter-hatched chickens (P<0.05). In contrast, age of sexual maturity of winter-hatched chickens was significantly earlier than that of summer-hatched chickens (P<0.01). The body weights from birth to 24 weeks were significantly lighter in the summer-hatched chickens than in the winter-hatched chickens, however, it was reversed after 28 weeks (P<0.05). In conclusion, the chicks hatched in the summer are more resistant to heat stress, with better productivity than the chicks hatched in the winter. These results suggest that the chicks grown at high temperatures have greater adaptability to the thermal environment.
Keywords: hatching and brooding season; heat stress response; HSPs; productivity; Korean native chicken
서 론
최근 닭 사육기술의 발달과 육종적 개량에 힘입어 실용계의 생산능력은 지난 과거에 비해 급진적 향상을 보이고 있다. 그러나 이러한 개량의 근간은 오직 생산성 향상만을 목적으로 함에 따라 최근의 동물 복지 및 친환경 동물 사육과는 다소 괴리가 있다. 예를 들어 집약적 사육 형태나 밀집 사육 등이 집단의 생산성 향상에는 크게 기여하였으나, 사육 개체들에게는 스트레스적 환경이라 사료된다(Tactacan et al., 2009; Beloor et al., 2010; Sohn et al., 2011). 또한 지구 온난화 현상으로 인해 날로 높아지는 대기 온도 등을 감안할 때 지금과 같은 사육 형태는 닭들을 심각한 고온 스트레스에 노출되게 한다. 닭들이 바람직하지 못한 사육 형태나 사육 온도에 지속적으로 노출되었을 때 스트레스로 인한 대사 복합체계 균형이 무너지고 항산화 방어 기능이 약화되어 건강과 생산성 저하를 초래하게 된다(Puvadopirod and Thaxton, 2000; Kang et al., 2013).
닭은 포유류와 달리 40°C 이상의 높은 체온을 가지며, 땀샘이 잘 발달되지 않아 생리적으로 체온조절이 쉽지 않은 특성을 지니고 있다. 따라서 닭은 고온에 취약하고 사육온도에 민감하게 반응한다. 닭의 사육에 적합한 임계온도(thermoneutral zone)는 18∼24°C 정도로 이를 벗어나면 생존율, 사료효율, 음수량, 체온, 수정율 및 성장률에 나쁜 영향을 미치는 것으로 보고하고 있고(Yahav et al., 1995; Altan et al., 2000; Vinoth et al, 2016), 산란계의 경우 산란율과 난질의 저하를 초래한다고 하였다(Usayran et al., 2001; Mashaly et al., 2004; Ajakaiye et al., 2010). 또한 부적합한 사육 온도는 닭의 면역성을 저하시키고, 장내 미생물의 빈도를 변화시켜 장의 소화흡수 기능에 나쁜 영향을 미친다고도 하였다(Quinteiro-Filho et al., 2010; Song et al., 2014). 특히 지속적인 고온 사육 환경은 개체의 생산성 및 생리적 측면에서 많은 부정적인 결과를 초래함으로 고온 스트레스를 저감할 수 있는 사육 환경의 조성이나 열 저항성이 높은 개체 육성이 필요하다. 고온 스트레스에 대한 저항성을 높이기 위한 방법으로 육성초기 제한급여(Yahav and Plavnik, 1999; Zulkifli et al., 2000)나 육추 때 고온 노출에 의한 열 적응 사육 방법(Rajkumar et al., 2015; Narinc et al., 2016; Vinoth et al., 2016) 및 사료 내 항산화 물질이나 비타민 첨가(Habibi et al., 2014; Ghazi et al., 2015; Zeferino et al., 2016)와 같은 방안들이 소개되고 있다. 이들 중 열 적응 사육 방법은 배아 형성 시기나 육성 초기 병아리를 고온에 노출시키면 열에 대한 저항성이 증가하여 성장하면서 체내 열 발생율 감소를 유발하여 고온 스트레스에 내성을 가진다고 보고하였다(Vinoth et al., 2015; Al-Zghoul, 2018). 고온에 대한 열 스트레스는 품종, 산란주령, 사육환경뿐만 아니라, 배자나 병아리가 스트레스 원에 노출되는 시간 및 강도에 의해서도 영향을 받는다고 하였다(Loyau et al., 2015; Cho et al., 2016; Morita et al., 2016). 그러므로 병아리의 부화 및 육성시기의 계절적 요인이 발생 후 개체들의 열 스트레스 적응 및 반응 정도에 유의한 영향을 미치리라 사료된다.
따라서 본 연구에서는 국내 토종종계 초생추들을 이용하여 발생시기 및 육성계절에 따른 계군 별 열 스트레스 반응 정도 및 생산성을 비교하고자 한 것으로 12월에 부화하여 겨울철 저온에서 육성된 닭들과 7월에 부화하여 여름철 고온에서 육성된 닭들 간 텔로미어 함량과 Heat Shock Proteins (HSPs) 유전자 발현율을 분석하여 열 스트레스 반응 정도를 비교하고, 생존율, 성장능력 및 산란능력을 조사하여 생산능력을 비교 고찰하였다.
재료 및 방법
1. 공시동물과 조사항목
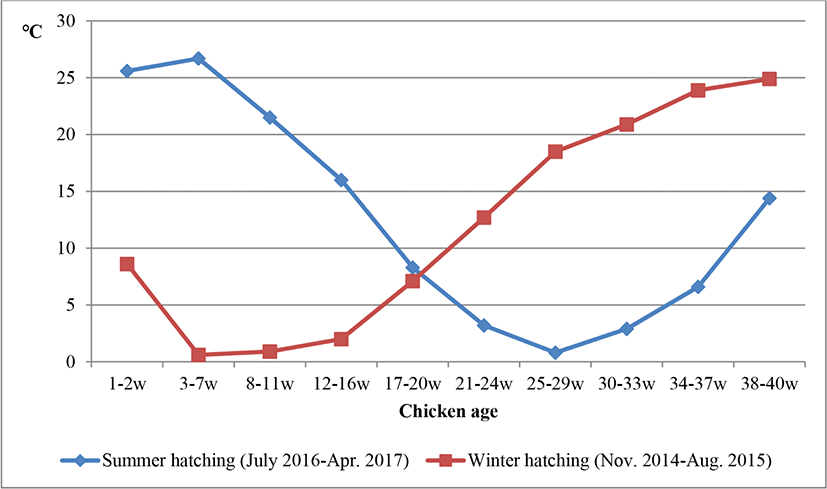
여름철 및 겨울철에 발생하여 육성된 병아리의 열 스트레스 반응 정도 및 생산성을 비교 분석하기 위하여 ㈜한협에서 육성 중인 한국토종종계 5계통(GPS)으로부터 이들 간 교잡으로 생산된 25개 조합의 초생추(PS)를 7월 및 11월에 각각 분양 받아 경남과학기술대학교 종합농장에서 사육하였다. 겨울철 시험개체는 토종종계 초생추 암컷 1,156수로 2014년 11월 19일부터 2015년 8월 27일까지 40주간 사육하였고, 여름철 시험개체는 동일 종의 초생추 암컷 934수로 2016년 7월 13일부터 2017년 4월 25일까지 40주간 사육하였다. 각 공시개체들의 사육 기간 동안 외부 대기 온도의 변화는 Fig. 1과 같다. 여름 및 겨울철 각 시험계들의 사양관리는 동일 조건으로 하였고, 육성기인 0∼15주령의 사양 관리는 강제 환기 및 자동온도조절 시스템이 완비된 무창계사 내 3단 2열 배터리형 케이지에서 수당 약 220 cm2의 밀도로 사육하였다. 사료 급여는 부화계절과는 관계없이 공히 시중 배합사료로 자유급이 후 4주령부터 제한급이 하였으며, 점등관리는 점감점증하여 16주령에 총 16시간으로 고정하였다. 이후 산란기 사양관리는 무창계사 형태의 종계사로 이송 후 2단 4열 케이지에 칸 당 12수씩 수당 580 cm2의 밀도로 사육하였으며, 백신 접종 등 기타 사양관리는 H사의 종계 사양관리지침에 따라 수행하였다. 생산능력의 비교를 위하여 주령 별 개체 체중과 생존율, 산란능력을 조사하였고, 열 스트레스 반응 정도 측정을 위하여 10주, 20주 및 40주령 때 날개 정맥으로부터 혈액을 채취하여 HSPs 유전자 발현율 및 텔로미어 함량을 분석하였다. 이러한 시험에 관련된 닭의 관리 및 취급은 본 대학 동물실험윤리위원회의 승인을 득한 후 본 규정을 준수하여 시행하였다(IACUC, 2018-7).
2. 텔로미어 함량 분석
닭 텔로미어 함량 분석은 혈액 내 백혈구 세포를 대상으로 Sohn et al. (2012)과 Cho et al. (2016)이 제시한 방법을 일부 변형하여 형광접합보인법(Fluorescence in situ Hybridization)으로 분석하였다. 텔로미어 함량 분석에 이용할 telomeric DNA probe는 CCCTAA가 7번 반복된 단일 oligomers를 primer로 하여 PCR로 증폭 후 Dig-PCR probe synthesis kit(Roche, Mannheim, Germany)로 labeling하였다. 백혈구 세포의 표본 제작은 Ficoll을 이용하여 혈액 내 백혈구만을 분리하고, 이들 세포를 0.06M KCl(Sigma Chem, St Louis, MO, USA) 저장액에 15분간 저장 처리 후 Carnoy’s 액(methanol 3 : acetic acid 1)으로 3회 고정처리 하였다. 제작된 슬라이드 표본은 RNase(Boehringer Mannheim, Indianapolis, IN, USA)로 37°C 항온수조에서 30분간 처리하여 RNA를 제거하고, 80%, 90%, 100% 에탄올로 탈수 건조시켰다. 건조된 슬라이드에 hybridization 용액(13 μL formamide, 5 μL hybridization buffer, 200 ng telomeric DNA probe)을 떨어뜨린 후 85°C에서 5분간 변성시키고, 38°C에서 12시간 이상 접합하였다. 접합 처리가 끝나면 72°C의 2× SSC 용액에서 5분, 실온의 PN buffer(0.1% sodium phosphate, 0.1% Nonidet P-40)에서 2분간 세척하고, anti-digoxigenin-fluorescein (Boehringer Mannheim)으로 형광접합 후 PN buffer로 3회 세척하고 건조시켰다. 과정을 마친 표본은 propidium iodide solution(Sigma Chem)으로 염색하고 적녹 파장대의 필터가 부착된 형광현미경(Model AX-70, Olympus, Tokyo, Japan)으로 관찰 후 개체 별 100개 이상의 핵을 디지털 카메라(Model DP-70, Olympus, Tokyo, Japan)로 촬영하였다. 촬영된 표본은 이미지 분석프로그램(MetaMorph®, UIC, Pennsylvania, USA)을 이용하여 텔로미어 함량을 측정하고 분석하였다.
Fig. 1.
External ambient temperature(°C) during rearing period of chickens hatched in summer and winter (Korea Meteorological Administration).
Download Original Figure
3. HSPs 유전자 발현율 분석
열 충격 단백질인 HSP 유전자의 발현율을 분석하기 위하여 각 개체의 혈액으로부터 RNA를 분리하였다. 채취한 전혈을 QIAamp® RNA Blood Mini Kit(Qiagen GmbH, Hilden, Germany)를 이용하여 RNA를 추출하고 cDNA를 합성하였다. Real-time PCR을 위한 HSP-70, HSP-90α, HSP-90β 및 reference gene의 primers는 Table 1과 같다. Quantitative-PCR을 위한 반응물은 cDNA 2 μL(50 ng/μL), SYBR Green(Roche, GmbH, Mannheim, Germany) 10 μL, primer(5 pmol/μL) 각각 0.5 μL 및 ddH2O 7 μL를 넣어 최종 volume이 20 μL이 되도록 혼합하고 real-time PCR machine(Model LC480, Roche, Mannheim, Germany)을 이용하여 95°C에서 5분 최초 변성시킨 후 95°C 10초 변성, 60°C 30초 접합, 72°C 10초간 신장 반응을 40회 반복하면서 실시간 형광 모니터링하였다. Ct값의 측정은 LightCycler® 480 software v1.5(Roche Diagnostics, GmbH, Mannheim, Germany)를 이용하여 분석하였다. Reference gene을 이용한 각 분석 대상 유전자의 상대적 정량값은 Livak and Schmittgen(2001)이 제시한 2—△△Ct 방법으로 측정하였다.
Table 1.
The primers of HSPs for the quantitative real-time PCR
| Gene |
Primer |
Sequence(5'-3') |
Size (bp) |
Tm (°C) |
| RPL27 |
Forward |
GCGCATTGGAGCGGCTGTGT |
81 |
60 |
| Reverse |
CCTTCCGTGGGTAGCGGTCG |
| HSP-90α |
Forward |
GGAGAAGTTACCAAGCGATT |
133 |
60 |
| Reverse |
CAGAAGATGAAGAAGAGAAGAAGA |
| HSP-90β |
Forward |
GCAGGACAGTAGGTGAGT |
113 |
60 |
| Reverse |
GAGGCAGAGCAAGATGAAG |
| HSP-70 |
Forward |
TCCTCTGCTTTGTATTTCTCTG |
145 |
60 |
| Reverse |
ATGCTAATGGTATCCTGAACG |
Download Excel Table
4. 통계분석
발생 및 육성 계절에 따른 사육 개체들의 생산능력과 텔로미어 함량 및 HSPs 유전자 발현율의 평균값 비교는 SAS 통계패키지(SAS Institute Inc., Cary, NC, USA)의 t-test procedure를 이용하여 유의성을 검정하였다. 또한 주령에 따른 텔로미어 함량 비교를 위해서는 동일 통계패키지의 GLM procedure를 이용하여 유의성 검정을 하고, 주령 별 평균값들 간의 다중검정은 Tukey’s HSD procedure로 검정하였다.
결과 및 고찰
1. 병아리 발생 및 육성 계절에 따른 생산능력 비교
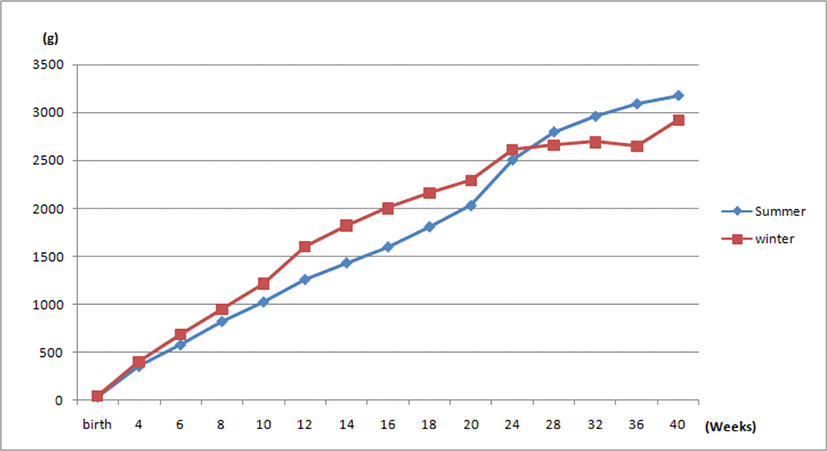
국내 토종종계를 대상으로 여름철과 겨울철에 각각 발생하여 육성된 개체들 간의 생산능력을 비교 분석하고자 7월에 발생된 934수와 11월에 발생된 1,156수에 대해 각각 생존율, 체중, 초산일령, 난중 및 일계산란율을 발생 후부터 40주령까지 조사하였다. 각 개체별 체중은 부화 직후부터 20주까지는 2주 간격으로 측정하고, 이후 산란기에는 4주 간격으로 측정하였다. 여름 및 겨울철에 발생하여 육성된 계군 간 평균 체중의 변화는 Fig. 2와 같다. 분석 결과, 겨울철에 발생하여 육성된 개체들의 체중이 여름철에 육성된 개체들에 비하여 24주령까지는 유의하게 높게 나타났으나, 28주령 이후부터는 오히려 역전 양상을 나타내었다. 이러한 결과는 육성초기에 고온에 노출된 개체들이 열 스트레스로 인해 낮은 체중을 보이다가 육성 후기부터 서서히 열 적응으로 인한 보상성장에 기인된 양상으로 사료된다. 브로일러에서도 초기 고온 사육이 후기 열 적응에 따른 보상성장을 보인다고 보고하였고(De Basillio et al., 2001; Zaboli et al., 2017), 열 스트레스가 높을 때 닭의 체중은 저하된다고 하였다(Sandercock et al., 2006; Soleimani et al., 2011). 그러나 고온에 노출된 병아리들의 생시 체중이 대조구에 비해 오히려 높다라는 보고(Piestun et al., 2011)와 고온 노출과 체중 간에는 별다른 관계가 없다는 보고(Yahav and Plavnik, 1999)도 있어 실제 육성 초기 고온 스트레스와 체중 간의 연관성에 대해서는 보다 많은 연구가 필요하다고 사료된다. Table 2는 여름 및 겨울철에 발생하여 육성된 계군 간의 생존율을 제시한 것으로 0∼15주까지 육성기와 16∼40주까지 산란기로 나누어 분석하였다. 제시된 바와 같이 육성기 생존율에 있어 여름철 발생 계군은 89.3%, 겨울철 발생 계군은 89.0%로 계군 간 생존율의 차이는 나타나지 않았으나, 16주령 이후 산란기 동안의 생존율은 여름철 발생 계군은 97.1%, 겨울철 발생 계군은 75.1%로 겨울철에 발생하여 육성된 계군이 여름철에 발생한 계군에 비해 현저히 낮게 나타났다. 이는 겨울철에 부화하여 저온 상태에서 초기 육성된 개체들이 산란중기 이후 여름철 고온에 노출되면서 열에 대한 내성이 약하여 집단 폐사가 일어난 결과라 생각된다. 반면, 여름철 발생한 닭들은 열 적응뿐만 아니라, 산란시점이 겨울인 관계로 상대적 생존율이 높게 나타난 것으로 보여진다. 브로일러에서도 초기 성장기 동안 인위적으로 높은 환경 온도에 노출시켰을 때 열 저항성이 높아져 후기 생존율이 향상되었다고 보고하고 있다(Arjona et al., 1988; Morsy, 2013). 그러나 열 저항성에 관하여 개체 간 차이가 크며, 특히 품종이나 계통에 따라 반응과 적응 정도가 달라 열 스트레스로 인한 폐사율의 차이가 매우 크다고 하였다(Sohn et al., 2015; Cho et al., 2016; Duangjinda et al., 2017). Table 3은 여름 및 겨울철에 발생하여 육성된 계군 간의 산란 능력에 대한 분석 결과이다. 계군 별 집단의 산란율이 5%에 도달한 첫 일령을 초산일령으로 하였을 때, 동일 점등 관리하에서 여름철 발생 계군은 157.8일, 겨울철 발생 계군은 136.8일로 겨울철 발생 계군이 여름철 발생 계군에 비하여 3주 정도 빨랐다. 반면, 20주령부터 40주령까지 일계산란율은 여름철 발생 계군이 69.0%이고, 겨울철 발생 계군이 66.1%로 여름철 발생 계군이 겨울철 발생 계군에 비해 유의하게 높았으며, 32주령 난중에서도 여름철 발생 계군이 겨울철 발생 계군에 비해 6 g 정도 높게 나타났다. 이는 병아리의 발생 및 육성계절이 성숙 후 산란능력에 유의하게 영향을 미친다는 결과로서 육성 초기 때 열에 노출된 닭이 정상 온도 하에서 육성된 닭에 비하여 후기 성장 및 생산능력이 우수하다고 보여진다. 일반적으로 사육 중인 닭이 고온 스트레스를 받게 되면 생존율, 사료효율, 음수량, 성장률, 난질 및 산란율이 저하된다고 한다(Usayran et al., 2001; Mashaly et al., 2004; Sahin et al., 2018). 그러나 닭의 열 스트레스 저항성을 높이기 위하여 병아리들을 육성 초기에 인위적으로 고온에 노출시키면 열 적응으로 인해 후기 생산능력이 향상된다고 보고하고 있다(Rajkumar et al., 2015; Vinoth et al., 2015; Al-Zghoul, 2018). 본 연구에서도 여름철 고온에서 사육된 병아리들이 겨울철에 사육된 병아리들에 비해 후기 생산능력이 양호한 결과를 보이는데, 이는 육성 초기에 고온에 노출된 병아리들이 열 적응으로 인해 후기 생산성이 좋아진 영향도 있겠으나, 여름철 발생 계군은 성숙 후 산란기가 겨울에서 봄 기간이고, 겨울철 발생 계군은 산란기가 여름철에 해당하여 산란시점에 고온 스트레스의 영향으로 생산성 저하가 유발되었다고 사료된다.
Fig. 2.
Comparison of body weight between hatched chickens in summer and winter from hatch to 40 wks.
Download Original Figure
Table 2.
Comparison of survival rate (%) of hatched chickens in summer and winter from birth to 40 wks
| Hatched |
Growing period (0~15 wks) |
Laying period (16~40 wks) |
Total (0~40 wks) |
| Summer |
89.26±5.78 |
97.13±2.72** |
86.77±5.75** |
| Winter |
89.01±6.79 |
75.07±18.17 |
82.23±10.19 |
Download Excel Table
Table 3.
Comparison of egg productivity of hatched chickens in summer and winter
| Hatched |
Days at first laying (days) |
Egg weight at 32 wks (g) |
Hen-day egg production from 20 to 40 wks (%) |
| Summer |
157.81±9.20** |
60.34±1.56** |
68.98±7.60* |
| Winter |
136.76±5.47 |
54.16±1.93 |
66.07±11.95 |
Download Excel Table
2. 병아리 발생 및 육성 계절에 따른 텔로미어 함량 비교
국내 토종종계를 대상으로 발생 및 육성 계절에 따른 텔로미어 길이를 비교하고자 여름철 및 겨울철 발생한 병아리들의 백혈구 세포 내 텔로미어 함량과 이의 감축 정도를 분석하였다. Table 4는 여름 및 겨울철에 발생하여 육성된 개체들 간의 10주령, 20주령 및 40주령 때 텔로미어의 함량 분석 결과이다. 분석 결과, 육성 계절에 따른 계군 별 텔로미어 함량은 모든 분석 주령에서 유의한 차이가 없는 것으로 나타났으며, 감축율 또한 여름철 발생 집단은 1.0%, 겨울철 발생 집단은 1.1%로 집단 간 유의한 차이를 보이지 않았다. 그러나 발생 및 육성 계절과 상관없이 모든 공시계의 연령이 증가할수록 텔로미어의 함량은 유의하게 감소하였는데, 이는 사육 환경과 관계없이 개체의 텔로미어 길이는 연령이 증가함에 따라 짧아진다는 기본적 이론과 일치되는 결과이다. 텔로미어는 염색체 말단부의 단순 반복 염기서열로 이의 길이는 세포의 노화와 산화적 스트레스에 의해 영향을 받는데, 개체가 스트레스에 노출되면 텔로미어 길이의 감축이 더욱 촉진된다고 알려져 있다(Richter and Proctor, 2007; Beloor et al., 2010; Sanders and Newman, 2013; Sohn and Subramani, 2014). Sohn et al.(2012)은 닭의 사육밀도 및 급여 제한과 같은 스트레스 요인이 텔로미어 길이 감축과 밀접한 연관성이 있음을 밝힌 바 있고, Simide et al.(2016)은 시베리아 철갑상어를 한 달간 30°C의 고온에 노출시킨 후 텔로미어 길이를 측정한 결과, 대조구에 비하여 15% 정도 감축되었다고 보고하였다. 이러한 내용들은 사육개체들이 직간접적으로 열 스트레스에 노출될 경우, 텔로미어 길이 감축율에 영향이 있음을 시사하는 결과이다. 그러나 본 연구 결과, 닭에 있어 육성기간 동안 지속적인 외부 환경 온도의 차이가 개체의 텔로미어 감축율에는 큰 영향을 미치지 않는 것으로 보여진다.
Table 4.
Comparison of the amount of telomeric DNA of hatched chickens in summer and winter
| Hatched |
10 wks |
20 wks |
40 wks |
Telomere shortening ratio (10 wks~40 wks) |
| Summer |
2.61±0.12a |
2.40±0.13b |
1.69±0.16c |
1.01±0.06 |
| Winter |
2.60±0.13a |
2.41±0.16b |
1.68±0.20c |
1.12±0.05 |
| P-value |
0.4514 |
0.1365 |
0.4875 |
0.2184 |
Download Excel Table
3. 병아리 발생 및 육성 계절에 따른 HSPs 유전자 발현율 비교 분석
열 충격 단백질로 알려진 HSPs는 열 스트레스뿐만 아니라, 다양한 내․외부 스트레스에 반응하여 합성되는 단백질이며, 스트레스 조건 하에서 발현율이 증가한다고 알려져 있다(Zulkifli et al., 2000; Gornati et al., 2004; Beloor et al., 2010; Sohn et al., 2012). HSPs 중 특히 HSP-70은 닭에 있어 스트레스에 민감하게 반응하는 열 스트레스 단백질로 알려져 있는데, 고온 스트레스뿐만 아니라, 제한급여, 수송, 격리와 같은 스트레스 원에 노출되어도 이의 유전자 발현율은 현저하게 상승한다고 보고되고 있다(Wang and Edens, 1998; Zulkifli et al., 2009; Kamboh et al., 2013). 따라서 본 연구에서는 국내 토종 종계를 대상으로 여름철에 발생하여 육성된 계군과 겨울철에 발생하여 육성된 계군 간에 열 스트레스 반응 정도를 비교 분석하기 위하여 HSP-70, HSP-90α 및 HSP-90β 유전자의 mRNA 발현량을 각 10주령, 20주령 및 40주령 때 Real-time PCR을 이용하여 ΔCt값으로 분석하고, 이의 결과를 Table 5와 6, 7에 제시하였다. 본 Table에 제시된 ΔCt값은 target gene의 Ct값과 control gene의 Ct값의 차이로서 발현량이 높을수록 값이 낮아지는데, 처리 간 상대적 발현량을 나타내기 위하여 2—ΔΔCt값으로 환산함으로 특정 처리구를 기준으로 몇 배의 발현율이 나타나는가를 보여준다. 분석 결과, HSP-70, HSP-90α 및 HSP-90β 유전자 발현율은 발생 계절별 시험 계군 간 모든 주령에서 유의한 차이를 보였다. 발생 후 10주, 20주 및 40주 때 겨울철에 발생하여 육성된 집단의 개체들이 여름철에 발생하여 육성된 집단에 비해 HSP-70의 경우 1.94∼2.63배 높은 발현율을 보였고, HSP-90α는 2.19∼3.87배, HSP-90β는 2.19∼5.30배 높은 발현율을 나타내어 분석된 모든 HSPs의 발현값은 겨울철 부화 육성군이 여름철 부화 육성군에 비해 공히 높게 나타났다. 이러한 결과는 겨울철에 발생하여 저온상태로 육성 초기를 보내고 점진적으로 외부 온도가 상승하는 시기에 성숙된 개체들이 여름철에 발생하여 고온상태에서 유추기를 보내고 점진적으로 외부 온도가 하강하는 시기에 성숙된 개체들에 비해 열 스트레스 반응 정도가 훨씬 높다라는 것을 의미한다. 이는 발생 및 육성 초기 때 외부로부터 열에 노출된 병아리들이 열에 대한 적응 능력을 습득하여 상대적으로 열 저항성이 높다라는 것을 시사한다. 이러한 양상은 산란계와 브로일러에서 부화 및 육성 초기 때 외부 열에 노출된 닭들이 정상 온도에서 사육된 닭들에 비해 HSPs 발현율이 낮고, 열 적응 능력이 높았다라는 보고와 잘 일치되는 결과이다(De Basilio et al., 2001; Star et al., 2009; Zulkifli et al., 2009). 한편으로 고온 스트레스를 받은 닭이 HSPs 발현율이 높아지면서 고온 저항성이 생기고, 이에 따른 생산성이나 면역반응이 증진된다고도 보고하고 있다. Vinoth et al.(2016)은 육계를 이용하여 5∼7일령까지 43°C의 고온에 매일 6시간씩 노출시킨 후 25°C의 적온에서 사육한 병아리들의 HSP-90α, HSP-70 및 HSP-60의 발현율을 분석한 결과 시험 시점에서는 처리구가 대조구에 비해 높았으나, 42일령 이후 급성 고온환경에 노출시킨 후의 발현율은 이들이 오히려 낮게 나타났다고 보고하였다. 또한, 부화 기간 중 순간적 고열 처리나 적정 부화온도보다 높은 온도에서 부화된 배아세포나 발생 개체의 HSPs 발현율이 적온에서 부화된 개체에 비해 상대적으로 높았다고 보고하였다(Edington and Hightower, 1990; Gabriel et al., 2002; Vinoth et al., 2015). 이는 배아 형성시기나 육성 초기에 병아리를 고온에 노출시키면 열에 대한 저항성이 증가하여 성장하면서 체내 열 발생율 감소를 유발하여 고온 스트레스를 극복할 수 있다라는 결과들이다(Rajkumar et al., 2015; Vinoth et al., 2015; Al-Zghoul, 2018). 따라서 닭의 열 적응성을 높이기 위하여 부란 7∼16일경에 하루 12시간 정도 부화온도를 39.5°C로 높여주거나, 육성 초기 때 12시간 이상 고온에 노출시키면 성장 후 상대적으로 높은 열 저항성을 가진다고 하였다(Yahav and Hurwitz, 1996; Loyau et al., 2015; Morita et al., 2016).
Table 5.
Comparison of the expression level of HSP-70 gene of hatched chickens in summer and winter
| Hatched |
10 wks |
20 wks |
40 wks |
| ΔCt |
2−ΔΔCt |
ΔCt |
2−ΔΔCt |
ΔCt |
2−ΔΔCt |
| Summer |
0.82±0.45* |
1 |
−0.06±1.46* |
1 |
−0.76±0.76** |
1 |
| Winter |
−0.57±1.23 |
2.63 |
−0.98±1.11 |
1.94 |
−2.01±0.93 |
2.45 |
Download Excel Table
Table 6.
Comparison of the expression level of HSP-90α gene of hatched chickens in summer and winter
| Hatched |
10 wks |
20 wks |
40 wks |
| ΔCt |
2-ΔΔCt |
ΔCt |
2-ΔΔCt |
ΔCt |
2-ΔΔCt |
| Summer |
18.08±3.02** |
1 |
19.74±4.18** |
1 |
22.33±3.67** |
1 |
| Winter |
16.95±3.48 |
2.19 |
18.24±3.15 |
2.82 |
20.41±3.09 |
3.87 |
Download Excel Table
Table 7.
Comparison of the expression level of HSP-90β gene of hatched chickens in summer and winter
| Hatched |
10 wks |
20 wks |
40 wks |
| ΔCt |
2−ΔΔCt |
ΔCt |
2−ΔΔCt |
ΔCt |
2−ΔΔCt |
| Summer |
7.89±3.31** |
1 |
11.06±4.40** |
1 |
11.71±1.56** |
1 |
| Winter |
5.92±2.30 |
3.92 |
8.66±2.84 |
5.30 |
9.21±2.98 |
2.82 |
Download Excel Table
이상 본 연구 결과들을 종합할 때 발생 및 육성 초기 때 고온 환경에 노출된 닭들이 적온에서 사육된 닭들에 비해 스트레스 관련 생리적 지표와 생존율 및 생산능력이 우수함으로 육성 초기 열 스트레스가 개체들의 열 적응성을 향상시켜 성숙 후 외부 스트레스에 보다 잘 적응하게하고, 더불어 생산능력에 영향을 미친다고 판단된다.
적 요
본 연구는 겨울철에 발생하여 육성된 닭들과 여름철에 발생하여 육성된 닭들 간의 열 스트레스 반응 정도와 생산능력을 비교 분석하고자 하였다. 공시계로는 겨울철에 발생된 한국토종종계 초생추 1,156수와 여름철에 발생된 초생추 934수로 총 2,090수를 분석 대상으로 하였다. 스트레스 반응 정도와 생산능력을 비교하기 위하여 텔로미어의 함량과 heat shock proteins(HSPs)의 유전자 발현율을 분석하고, 생존율, 산란율 및 체중을 조사하였다. 분석 결과, HSP-70, HSP-90α 및 HSP-90β 유전자 발현율은 겨울철에 발생하여 육성된 닭들이 여름철에 발생하여 육성된 닭들에 비하여 모두 유의하게 높은 발현값을 나타내었다. 텔로미어 함량은 겨울철과 여름철에 발생한 닭들 간에 유의한 차이가 없었다. 생존율에서는 여름철 발생하여 육성된 닭들이 겨울철에 발생하여 육성된 닭들에 비해 유의하게 높았고, 산란율 및 난중 또한 여름철 발생 계군이 높게 나타났다. 반면, 초산일령은 겨울철 발생 계군이 여름철 발생 계군에 비해 빨랐다. 체중에 있어서 24주까지는 겨울철 발생 계군이 여름철 발생 계군에 비해 높았으나, 28주 이후부터 발생 계군 간 역전된 결과를 보였다. 결론적으로 여름철에 발생하여 육성된 닭들이 겨울철에 발생하여 육성된 닭들에 비해 열 스트레스에 대한 저항성이 높고 생산성이 우수함을 보였다. 이는 발생 및 육성 초기에 고온에 노출된 닭들이 상대적으로 높은 열 적응성을 습득한 결과로 사료된다.
(색인어: 발생 및 육성 계절, 열 스트레스 반응, 열 스트레스 단백질, 생산능력, 한국토종닭)
사 사
이 논문은 2018년도 경남과학기술대학교 대학회계 연구비 지원에 의하여 연구되었음.
REFERENCES
Ajakaiye JJ, Ayo JO, Ojo SA 2010 Effects of heat stress on some blood parameters and egg production of Shika Brown layer chickens transported by road. Biol Res 43:183-189.

Al-Zghoul MB 2018 Thermal manipulation during broiler chicken embryogenesis increases basal mRNA levels and alters production dynamics of heat shock proteins 70 and 60 and heat shock factors 3 and 4 during thermal stress. Poult Sci 97(10):3661-3670.

Altan O, Altan A, Oğuz I, Pabuçcuolu A, Konyalioğlu S 2000 Effect of heat stress on growth, some blood variables and lipid oxidation in broilers exposed to high temperature at an early age. Br Poult Sci 41(4):489-493.

Arjona AA, Denbow DM, Weaver WD 1988 Effect of heat stress early in life environmental temperatures just prior to marketing. Poult Sci 67(2):226-231.

Beloor J, Kang HK, Kim YJ, Subramani VK, Jang IS, Sohn SH, Moon YS 2010 The effect of stocking density on stress related genes and telomeric length in broiler chickens. Asian-Aust J Anim Sci 23(4):437-443.

Cho EJ, Park JA, Choi ES, Sohn SH 2016 Comparison of stress response in diallel crossed Korean domestic chicken breeds. Korean J Poult Sci 43(2):77-88.

Duangjinda M, Tunim S, Duangdaen C, Boonkum W 2017 Hsp70 Genotypes and heat tolerance of commercial and native chickens reared in hot and humid conditions. Brazilian J Poult Sci 19:7-18.


Gabriel JE, da Mota AF, Boleli IC, Macari M, Cotinho LL 2002 Effect of moderate and severe heat stress on avian embryonic hsp70 gene expression. Growth Dev Aging 66(1):27-33.

Ghazi S, Amjadian T, Norouzi S 2015 Single and combined effects of vitamin C and oregano essential oil diet, on growth performance, and blood parameters of broiler chicks reared under heat stress condition. Int J Biometeorol 59(8):1019-1024.

Gornati R, Papis E, Simona R, Genciana T, Marco S, Giovanni B 2004 Rearing density influences the expression of stress-related genes in sea bass (
Dicentrarchus labrax, L.). Gene 341:111-118.

Habibi R, Sadeghi G, Karimi A 2014 Effect of different concentrations of ginger root powder and its essential oil on growth performance, serum metabolites and antioxidant status in broiler chicks under heat stress. Br Poult Sci 55(2):228-237.

Kamboh AA, Hang SQ, Bakhetgul M, Zhu WY 2013 Effects of genistein and hesperidin on biomarkers of heat stress in broilers under persistent summer stress. Poult Sci 92(9):2411-2418.

Kang SY, Ko YH, Moon YS, Sohn SH, Jang IS 2013 Effect of housing systems on physiological and immunological parameters in laying hens. J Anim Sci Tech 55(2):131-139.

Livak KJ, Schmittgen TD 2001 Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods 25(4):402-408.

Loyau T, Bedrani L, Berri C, Métayer-Coustard S, Praud C, Coustham V, Mignon-Grasteau S, Duclos MJ, Tesseraud S, Rideau N, Henneguet-Antier C, Everaert N, Yahav S, Collin A 2015 Cyclic variations in incubation conditions induce adaptive responses to later heat exposure in chicken: a review. Animal 9(1):46-85.



Mashaly MM, Hendricks GL 3rd, Kalama MA, Gehad AE, Abbas AO, Patterson PH 2004 Effect of heat stress on production parameters and immune responses of commercial laying hens. Poult Sci 83(6):889-894.

Morita VS, de Almeida VR, Matos JB Junior, Vicentini TI, van den Brand H, Boleli IC 2016 Incubation temperature during fetal development influences morphophysiological characteristics and preferred ambient temperature of chicken hatchlings. PLoS One 11(5):e0154928.

Morsy AS 2013 Effect of heat shock exposure on the physiological responses and semen quality of male chickens under heat stress conditions. Egypt Poult Sci 33:143-161.

Narinc D, Erdogan S, Tahtabicen E, Aksoy T 2016 Effect of thermal manipulations during embryogenesis of broiler chickens on developmental stability, hatchability and chick quality. Animal 10(8):1328-1335.

Piestun Y, Halevy O, Shinder D, Ruzal M, Druyan S, Yahav S 2011 Thermal manipulations during broiler embryogenesis improves post-hatch performance under hot conditions. J Thermal Biol 36:469-474.

Puvadolpirod S, Thaxton JP 2000 Model of physiological stress in chickens 1. Response parameters. Poult Sci 79(3): 363-369.

Quinteiro-Filho WM, Ribeiro A, Ferraz-de-Paula V, Pinheiro ML, Sakai M, Sá LR, Ferreira AJ, Palermo-Neto J 2010 Heat stress impairs performance parameters, induces intestinal injury, and decreases macrophage activity in broiler chickens. Poult Sci 89(9):1905-1914.

Rajkumar U, Vinoth A, Shanmug M, Rajaravindra KS, Rama Rao SV 2015 Effect of embryonic thermal exposure on Heat Shock Proteins (HSPs) gene expression and serum T3 concentration in two broiler populations. Anim Biotechnol 26(4):260-267.

Richter T, Proctor C 2007 The role of intracellular peroxide levels on the development and maintenance of telomeredependent senescence. Exp Gerontol 42(11):1043-1052.

Sahin N, Hayirli A, Orhan C, Tuzcu M, Komorowski JR, Sahin K 2018 Effects of the supplemental chromium form on performance and metabolic profile in laying hens exposed to heat stress. Poult Sci 97(4):1298-1305.

Sandercock DA, Hunter RR, Mitchell MA, Hocking PM 2006 Thermoregulatory capacity and muscle membrane integrity are compromised in broilers compared with layers at the same age or body weight. Br Poult Sci 47(3):322-329.

Sanders JL, Newman AB 2013 Telomere length in epidemiology: a biomarker of aging, age-related disease, both, or neither? Epidemiol Rev 35:112-131.

Simide R, Angelier F, Gaillard S, Stier A 2016 Age and heat stress as determinants of telomere length in a long-lived fish, the siberian sturgeon. Physiol Biochem Zool 89(5): 441-447.

Sohn SH, Cho EJ, Park JA, Hong YH, Kim CD 2015 Analysis of stress response of domestic chicken breeds for the development of a new synthetic parent stock. Korean J Poult Sci 42(2):157-167.


Sohn SH, Jang IS, Son BR 2011 Effect of housing systems of cage and floor on the production performance and stress response in layer. Korean J Poult Sci 38(4):305-313.


Sohn SH, Subramani VK 2014 Dynamics of telomere length in the chicken. World's Poultry Science Journal 70(4):721-736.


Sohn SH, Subramani VK, Moon YS, Jang IS 2012 Telomeric DNA quantity, DNA damage, and heat shock protein gene expression as physiological stress markers in chickens. Poult Sci. 91(4):829-836.

Soleimani AF, Zulkifli I, Omar AR, Raha AR 2011 Physiological responses of 3 chicken breeds to acute heat stress. Poult Sci 90(7):1435-1440.

Song Y, Salbu B, Teien HC, Heier LS, Rosseland BO, Høgsåen T, Tollefsen KE 2014 Global transcriptional analysis of short-term hepatic stress responses in Atlantic salmon (
Salmo salar) exposed to depleted uranium. Genome Data 7(2):340-341.

Star L, Juul-Madsen HR, Decuypere E, Nieuwland MG, de Vries Reilingh G, van den Brand H, Kemp B, Parmentier HK 2009 Effect of early life thermal conditioning and immune challenge on thermotolerance and humoral immune competence in adult laying hens. Poult Sci 88(1):2253-2261.

Tactacan GB, Guenter W, Lewis NJ, Rodriguez-Lecompte JC, House JD 2009 Performance and welfare of laying hens in conventional and enriched cages. Poult Sci 88(4): 698-707.

Usayran N, Farran MT, Awadallah HH, Al-Hawi IR, Asmar RJ, Ashkarian VM 2001 Effect of added dietary fat and phosphorus on the performance and egg quality of laying hens subjected to a constant high environmental temperature. Poult Sci 80(12):1695-1701.

Vinoth A, Thirumalasumdari T, Shanmugam M, Rajkumar U 2016 Effect of early age thermal conditioning on expression of heat shock proteins in liver tissue and biochemical stress indicators in colored broiler chicken. Eur J Exp Biol 6(2):56-63.

Vinoth A, Thirumalasumdari T, Tharian JA, Shanmugam M, Rajkumar U 2015 Effect of thermal manipulation during embryogenesis on liver heat shock protein expression in chronic heat stressed colored broiler chickens. J Therm Biol 53:162-171.

Wang S, Edens FW 1998 Heat conditioning induces heat shock proteins in broiler chickens and turkey poults. Poult Sci 77(11):1636-1645.

Yahav S, Goldfeld S, Plavnik I, Hurwitz S 1995 Physiological responses of chickens and turkeys to relative humidity during exposure to high ambient temperature. J Thermal Biology 20(3):245-253.


Zaboli GR, Rahimi S, Shariatmadari F, Torshizi MA, Baghbanzadeh A, Mehri M 2017 Thermal manipulation during pre and post-hatch on thermotolerance of male broiler chickens exposed to chronic heat stress. Poult Sci 93(2):478-485.

Zeferino CP, Komiyama CM, Pelícia VC, Fascina VB, Aoyaqi MM, Coutinho LL, Sartori JR, Moura AS 2016 Carcass and meat quality traits of chickens fed diets concurrently supplemented with vitamins C and E under constant heat stress. Animal 10(1):163-171.

Zulkifli I, Al-Aqil A, Omar AR, Sazili AQ, Rajion MA 2009 Crating and heat stress influence blood parameters and heat shock protein 70 expression in broiler chickens showing short or long tonic immobility reactions. Poult Sci 88(3):471-476.

Zulkifli I, Norma MTC, Israf DA, Omar AR 2000 The effect of early age feed restriction on subsequent response to high environmental temperatures in female broiler chickens. Poultry Sci 79(10):1401-1407.