Article
메추리 Chibby Family Member 2 (CBY2) 유전자의 클로닝과 메추리 근육세포에서의 특성 분석
이인표1,2
,
신상수3,†
Cloning and Characterizing of the Quail Chibby Family Member 2 (CBY2) Gene in Quail Muscle Cells
Inpyo Lee1,2
,
Sangsu Shin3,†
Author Information & Copyright ▼
1Graduate Student, Department of Animal Science and Biotechnology, Kyungpook National University, Sangju 37224, Republic of Korea
2Researcher, Drug Discovery Platform Research Center, Therapeutics & Biotechnology Division, Korea Research Institute of Chemical Technology (KRICT), Deajeon 34114, Republic of Korea
3Professor, Department of Animal Science and Biotechnology, Kyungpook National University, Sangju 37224, Republic of Korea
© Copyright 2019, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jul 21, 2020; Revised: Jul 23, 2020; Accepted: Jul 23, 2020
Published Online: Sep 30, 2020
요약
Chibby family member 2(CBY2)은 Chibby-like super family domain을 가지고 있으며, SPERT 또는 NURIT 등으로도 알려져 있지만, 그 기능이 많이 알려져 있지는 않다. 본 연구에서는 메추리 CBY2 유전자를 클로닝하여 그 서열을 분석하고, QM7 메추리 근육 세포의 근육발생에서의 역할을 분석하였다. 메추리 CBY2의 코딩 서열은 978개의 염기로 이루어져 있으며, 이는 325개의 아미노산으로 번역되어진다. 메추리 CBY2는 닭의 CBY2와 가장 유사했으며, 이들 조류의 CBY2는 진화 역사상 일찍이 포유류의 CBY2와 나뉘어진 것으로 분석되었다. 단백질 도메인 예측 분석 결과, 메추리 CBY2는 N-말단 쪽에, 포유류와 비교 시 상이한 아미노산을 많이 갖고는 있지만, 83개의 아미노산으로 이루어진 Chibby-like superfamily domain을 가진 것으로 확인되었다. 메추리의 다양한 조직 중 CBY2는 지방조직에서 가장 많이 발현했으며, 간, 심장, 신장에서는 중간 또는 낮은 정도로 발현했고, 대흉근에서는 극히 낮은 발현을 보였다. CBY2의 근육발생에서의 역할을 분석하기 위해 CBY2를 QM7 세포에 과발현시킨 결과, CBY2가 근육발생을 억제하는 것을 확인할 수 있었으며, 근관의 넓이를 수치화해 비교해본 결과, 그 면적이 대조구의 약 25%밖에 되지 않았다. 결론적으로 메추리 CBY2는 Chibby-like superfamily domain을 가지고 있으며, 근육발생을 억제하는 특성이 있다. 추후 연구는 CBY2가 근육발생을 억제하는 기작을 밝혀내는데 중점을 두어야 할 것이다.
Abstract
Chibby family member 2(CBY2), also known as SPERT or NURIT, is a gene with Chibby-like super family domain, whose function is not well known. In this study, the quail CBY2 gene was cloned, its sequences were analyzed, and its role in the myogenesis of QM7 quail muscle cells was characterized. Quail CBY2 has 978 nucleotides, which are translated into 325 amino acids, and the amino acid sequences are highly similar to those of chicken CBY2. Avian CBY2 diverted from mammalian CBY2 during early evolutionary history. According to the protein domain prediction analysis, quail CBY2 has a Chibby-like superfamily domain consisting of 83 amino acids at the N-terminal of the protein, although compared to mammalian CBY2, many of the amino acids were different. CBY2 was highly expressed in the adipose tissue and moderately expressed in the liver, heart, and kidney, whereas rarely expressed in the muscle tissue in quail. To characterize the role of CBY2 in myogenesis, CBY2 was overexpressed in QM7 cells. The overexpression of CBY2 inhibited myotube formation as shown that the myotube area was approximately only 25% that of the control. Taken together, quail CBY2 has a Chibby-like superfamily domain and inhibits myogenesis. Further studies should focus on the identification of the inhibitory mechanism of CBY2 on myogenesis.
Keywords: Chibby family member 2; CBY2; 근육발생; QM7 세포; 근육
Keywords: Chibby family member 2; CBY2; myogenesis; QM7 cell; muscle
서 론
근육은 몸을 이루는 가장 중요한 조직 중의 하나로 근육발생(myogenesis) 과정을 통해 만들어지며, 수축과 이완을 통한 운동의 힘을 제공한다. 뿐만 아니라, 축산에서는 가축의 생산성과 관련된 중요한 경제형질에 속한다. 이러한 이유로 좀더 효율적으로 근육을 발달시키는 여러 가지 방법들과 근육발생 기작들이 연구되어 왔다. 근육발생은 배아형성과 골격근의 재생과정에서 근원세포(myoblast)나 위성세포(satellite cell)로부터 근관(myotube)과 근섬유(myofiber)가 형성되는 과정으로, 여기에는 여러 단계에 걸친 다양한 유전자의 발현 변화가 포함되어 있다(Chal and Pourquie, 2017). 근육발생이 시작되는 초기에는 paired box(PAX) 유전자들이 근원세포나 위성세포의 분열과 분화를 조절하는데 중요한 역할을 한다(Buckingham and Relaix, 2007; Collins et al., 2009). 근육발생은 근원성 조절 인자들(myogenic regulatory factors; MRFs)에 의해 주로 조절되는데, 이들은 전사인자로서 myogenic differentiation 1(MYOD1), myogenin(MYOG), myogenic factor 5(MYF5), MRF4(MYF6) 등이 있으며, 세포가 근육으로 분화되도록 유도할 수 있다(Sabourin and Rudnicki, 2000).
Chibby family member 2(CBY2)는 성숙된 정소에서 높게 발현되며, 신장 중인 정세포에서 발견되어 spermatid-associated protein(SPERT) 또는 NURIT으로 알려져 있다(Feige et al., 2002). CBY2는 Chibby-like superfamily domain을 가지고 있지만, 실제로 그 기능은 아직 잘 알려져 있지 않다. Chibby는 β-catenin에 직접적으로 결합해 β-catenin이 세포질에서 핵으로 들어가는 것을 방해함으로써 전형적인 WNT 신호를 억제하는 것으로 알려져 있다(Takemaru et al., 2003). 지방세포에서는 WNT/β-catenin 신호를 억제함으로써 지방세포의 분화를 촉진하는 것으로 알려져 있으며, 배아줄기세포에서 높은 수준으로 발현하면 심근세포로의 분화가 억제되는 것으로 알려져 있다(Li et al., 2007; Singh et al., 2007). 이러한 발견들은 Chibby-like superfamily domain을 가지고 있는 CBY2가 세포의 분화에 있어서 특정 역할을 할 것이라고 유추할 수 있으며, 이에 대한 연구는 전무한 상태이다.
따라서, 본 연구에서는 메추리로부터 CBY2 유전자를 클로닝하여 유전자의 서열 및 특성을 분석하고, 메추리의 근육세포에 유전자를 과발현시켜 근육세포의 분화와 관련하여 어떤 역할을 하는지를 밝혀냈다.
재료 및 방법
1. 전체 RNA 추출 및 cDNA 합성
RNAiso plus(Takara Bio Inc., Shiga, Japan)를 이용하여 메추리(Coturnix japonica; quail)의 대흉근(pectoralis major muscle; PM), 심장, 간, 신장, 복부지방과 QM7 세포(American Type Culture Collection, Manassas, VA, USA)로부터 전체 RNA를 추출하였다. 메추리 시료 채취는 경북대학교 동물실험윤리위원회가 심의하고 승인한 방법에 따라 진행하였다(KNU 2019-154). 전기영동과 NanoDrop ND-1000 Spectrophotometer(Thermo Scientific Inc., Wilmington, DE, USA)를 이용하여 RNA의 상태와 양을 확인한 후, 1 μg의 전체 RNA를 취하여 cDNA 합성에 이용하였다. cDNA 합성은 제조사 설명서에 따라 PrimeScript™ 1st cDNA Synthesis Kit(Takara Bio Inc.)를 이용해 역전사를 시켜 합성하였다.
2. 메추리 CBY2 유전자의 클로닝과 발현 벡터 제작
우선 CBY2-F와 CBY2-R 프라이머 쌍(Table 1)을 이용한 PCR을 통해 CBY2의 코딩 서열을 증폭하고, 이를 pGEM-T easy vector(Promega, Madison, WI, USA)에 삽입하여 클로닝 하였다. 염기서열분석을 통해 CBY2의 서열을 확인한 후 다음 실험을 진행하였다. 발현 벡터를 제작하기 위해, 우선 CBY2-F와 CBY2-HA-R 프라이머 쌍(Table 1)을 이용한 PCR을 통해 CBY2에 hemagglutinin(HA) 태그를 추가해 추후 단백질 분석이 용이하도록 하였다. 이 조각을 pcDNA3.1 (Invitrogen, Grand Island, NY, USA) 발현 벡터의 EcoRV 제한효소 자리에 삽입하여 CBY2 발현 벡터를 제작하였다.
Table 1.
The list of PCR primer sets
|
|
Primer |
Forward (F) |
Reverse (R) |
Annealing temperature |
| For cloning |
CBY2 |
5’-AAA AAG CCA AGC GGA GAC CT-3’ |
5’-AGG CAC TTT CCA GGA AAC AGA-3’ |
56.4℃ |
| CBY2-HA |
|
5’-TTA CAA GCT GTA ATC TGG ACC ATC GTA TGG GTA AAT CTC TCC AAG TTG AAA CTC GTT TG-3’ |
- |
| For quantitative RT-PCR |
GAPDH |
5’-GAG GGT AGT GAA GGC TGC TG-3’ |
5’-ACC AGG AAA CAA GCT TGA CG-3’ |
58.0℃ |
| CBY2 |
5’-ACC TGA CAA ACC AGA GCA CA-3’ |
5’-CCA GAT GCT CCA CTC GTT CT-3’ |
60.0℃ |
Download Excel Table
4. 실시간 정량 PCR(Quantitative Real-Time PCR)
실시간 정량 PCR은 StepOnePlus Real-Time PCR system (Applied Biosystems, Foster City, CA, USA) PCR 기기와 PowerUp™ SYBR™ Green Master Mix(Applied Biosystems)를 이용하여 실시하였다. PCR에 사용된 프라이머 쌍은 Table 1에 제시하였다. 표적 유전자의 발현 수준은 2−ΔΔCt 방법을 이용해 계산했으며, 이때 표준화를 위해 GAPDH를 사용하였다.
5. 세포배양 및 유전자 도입
평상시 QM7 세포는 Medium199(Sigma Aldrich, St. Louis, MO, USA) 배양액을 기본으로 하여, 10% FBS(fetal bovine serum; Gibco, Grand Island, NY, USA), 10% TPB(tryptose phosphate broth; Sigma Aldrich), 1% ABAM(antibiotic-antimycotic; Gibco)를 포함한 일반 배양액을 이용해 37°C, 5% CO2 상태의 배양기에서 배양되었다. 세포의 분화를 방지하기 위해 배양접시에 세포가 가득 차기 전에 계대배양을 실시하였다. 세포의 분화는, 우선 세포가 배양접시에 가득 차도록 키운 후, 일반 배양액을 분화 배양액으로 바꾸어 줌으로써 유도하고, 매 2일마다 교체해 주었다. 분화 배양액은 일반 배양액과 비교해 FBS 농도만 다르며, 0.5%를 함유하고 있다. 분화는 보통 4일 동안 진행되었으며, 그 후 시료를 채취하였다. 세포 내로의 유전자 도입은 Lipofectamine 3000 reagent(Invitrogen)를 이용해 제조사 설명서에 따라 세포 분화를 유도하기 하루 전에 진행하였다.
6. 면역형광염색 및 분석
근관의 염색을 위해, 우선 10% neutral formalin을 이용해 15분간 세포를 고정하고, 0.3% NP40으로 투과성 세포막을 만든 후, 5% non-fat dry milk를 포함한 PBST(phosphate buffered saline, 0.1% tween 20)를 이용해 비특이 항원 차단을 실시하였다. 일차 항체로 anti-myosin heavy chain(MF20; Developmental Studies Hybridoma Bank, Iowa City, IA, USA) 항체를, 이차 항체로 CruzFluor™594가 결합된 anti-mouse IgG(Santa Cruz Biotechnology, Dallas, TX, USA)를 사용했으며, DAPI를 이용해 핵을 염색하였다. 세포를 염색한 후, 도립형광현미경(CKX53; Olympus, Shinjuku, Tokyo, Japan)과 카메라를 이용해 형광 사진을 얻었으며, 이 사진을 ImageJ 소프트웨어를 이용해 분석하였다.
7. 통계 분석
수치 데이터는 SAS 소프트웨어(SAS Institute, Cary, NC) 내의 Student’s t-test나 one-way ANOVA를 이용해 유의성을 검정하였으며, P<0.05인 경우 유의성이 있는 것으로 판단하였다. 그래프에서 데이터는 평균과 평균의 표준오차(SEM)를 이용해 나타냈다.
결과 및 고찰
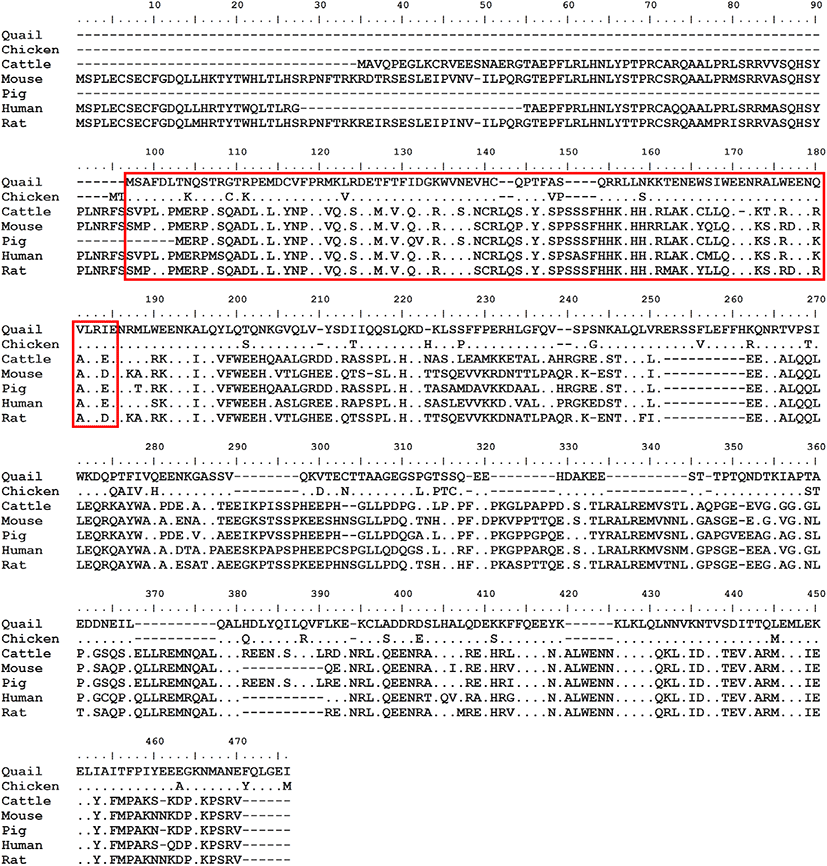
메추리 CBY2 유전자의 코딩 서열(CDS)을 클로닝하여 염기서열분석을 실시한 결과, 총 길이는 978 bp로 이루어져 있었으며, 이는 325개의 아미노산으로 번역될 수 있다. 클로닝한 메추리 CBY2의 염기서열은 GenBank에 등록된 메추리 CBY2 유전자 예측 서열과 일치했다. 메추리 CBY2 아미노산 서열을 닭, 소, 돼지, 쥐, 생쥐, 사람 등의 CBY2 아미노산 서열과 비교한 결과, 닭과 가장 높은 88%의 유사도를 보였으며, 다른 포유류의 CBY2와는 상대적으로 낮은 유사도를 보였다(Fig. 1). 계통수를 통한 분석 결과, 닭과 메추리를 포함하는 조류의 CBY2는 진화적으로 오래전에 포유류로부터 분리되어 나온 것을 알 수 있었다(Fig. 2). 단백질 도메인 예측 프로그램을 통해 얻은 결과 중 흥미로운 점은 닭과 메추리의 CBY2 아미노산 서열이 포유류의 것과 많이 다름에도 불구하고, CBY2 단백질의 특징적인 도메인인 Chibby-like superfamily domain을 가지고 있는 것으로 예측되었다는 것이다. 메추리 CBY2 단백질에서 Chibby-like superfamily domain은 83개의 아미노산으로 구성되어 있으며, 단백질의 N-말단쪽에 위치해 있다. 따라서, 메추리의 CBY2 유전자는 포유류의 CBY2 유전자와 유사한 기능을 할 것으로 생각된다.
Fig. 1.
Alignment of CBY2 amino acid sequences from various animals. The amino acid sequences of CBY2 from various animals are aligned to identify the similarity between them. CBY2 was predicted to have a Chibby-lilke superfamily domain and it was indicated by red box.
Download Original Figure
Fig. 2.
Phylogenetic tree of CBY2 of animals. Quail CBY2 was closely related to chicken CBY2 and they are diverted from the mammalian CBY2 in early evolutionary history.
Download Original Figure
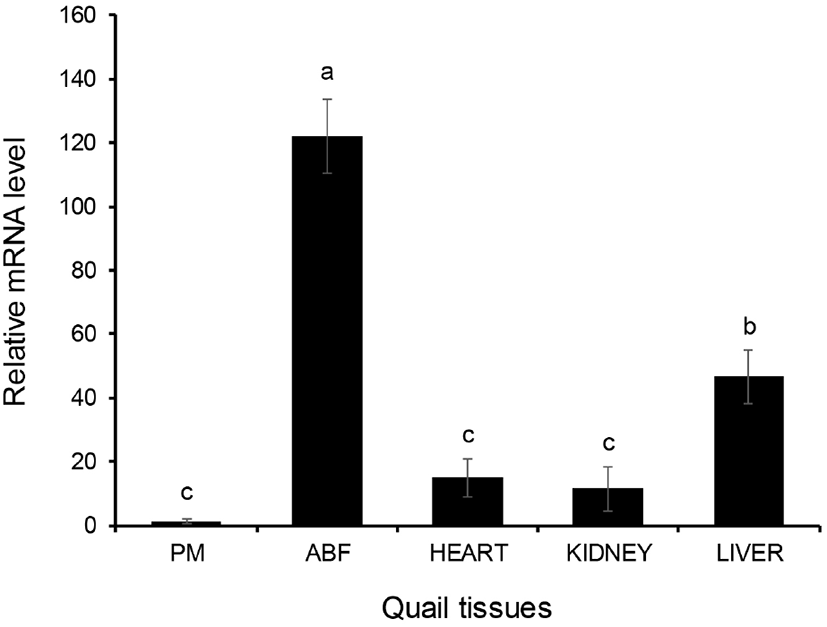
메추리의 조직에서 CBY2 유전자의 발현 양상을 분석한 결과, 대흉근에서 가장 낮게 발현함을 확인할 수 있었다(Fig. 3). CBY2가 가장 많이 발현하는 조직은 복부지방 조직으로 근육에 비해 약 120배 정도 많이 발현했으며, 그 다음으로는 간에서 약 45배, 심장에서 약 15배, 신장에서 약 10배 정도 발현하는 것을 확인할 수 있다(P<0.001). 메추리 조직별로 CBY2 발현 양상의 커다란 차이는 CBY2가 각각의 조직에서 작용하는 기능이 서로 다를 수 있음을 내포한다. 비록 CBY2의 결과는 아니지만, Chibby의 경우 지방조직에서 지방의 분화를 촉진시키는 것으로 보아(Li et al., 2007), CBY2 또한 지방세포에서는 비슷한 기능을 할 수 있을 것으로 사료되며, 다른 조직에서는 또 다른 역할을 할 수도 있을 것이라 추측된다.
Fig. 3.
The expression of CBY2 mRNA in various quail tissues. The expression level of CBY2 mRNA was analyzed by qRT-PCR. CBY2 was most highly expressed in abdominal fat (ABF), while its expression was extremely downregulated in pectoralis major muscle (PM). Data were shown as mean±SEM (n=3), and the significance of P<0.001.
Download Original Figure
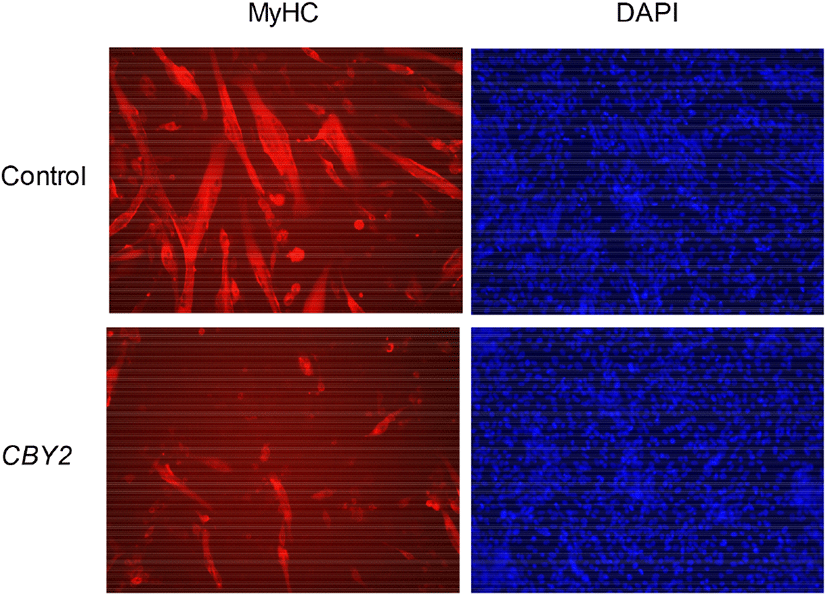
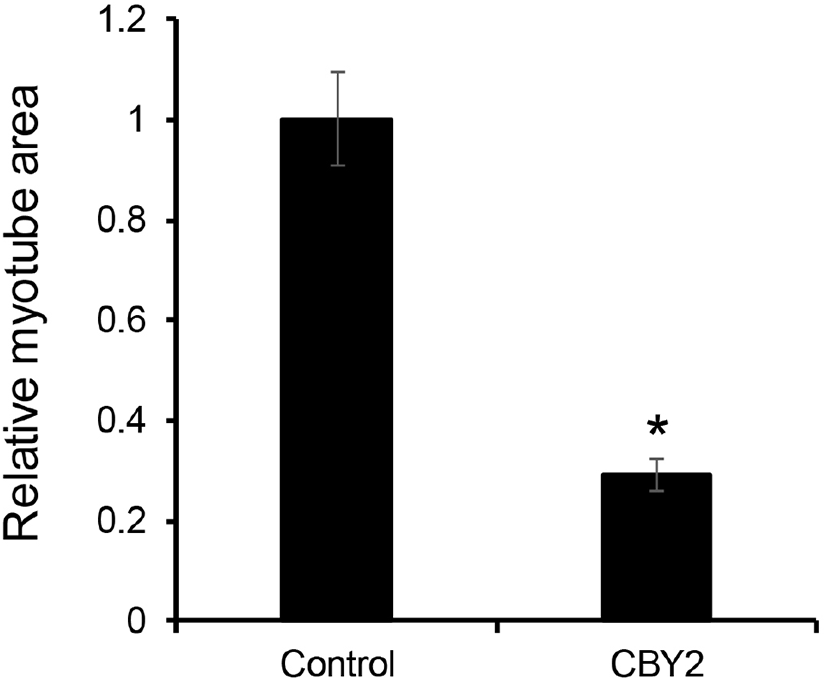
근육발생과 관련해서 CBY2가 어떤 특성을 가지고 있는지를 알아보기 위해 메추리 근육 유래 세포인 QM7 세포에 CBY2 유전자를 과발현시켰다. 그 결과, CBY2를 과발현시킨 세포는 대조구 세포에 비해 근관 형성이 극도로 억제되어 있음을 확인할 수 있었다(Fig. 4). 대조구와 비교해 CBY2를 과발현시킨 세포에서는 근관의 두께와 길이가 훨씬 작았으며, 근관에 포함된 핵의 수도 더 적게 관찰되었다. 수치적인 비교를 위해 면역형광염색으로 빨갛게 염색된 부위의 면적, 즉 근관의 면적을 측정한 결과, 대조구의 근관 면적에 비해 CBY2를 과발현시킨 세포에서의 근관의 면적이 1/3 이하로 줄어든 것을 확인할 수 있었다(Fig. 5; 1 vs. 0.29, P<0.05). 따라서, CBY2는 근육발생에 있어서 억제자의 역할을 하는 것을 알 수 있다. 흥미롭게도 CBY2의 근육 조직에서의 발현량이 다른 조직에 비해 현저히 낮았는데, 이는 근육의 분화를 억제하는 것을 방지하기 위한 것일 수도 있다. 반면, 지방조직에서는 발현이 높았는데, 이는 CBY2 또한 지방세포의 분화를 촉진하는 기능을 가지고 있기 때문일 수도 있지만, 이는 다른 연구를 통해 밝혀져야 할 것이다.
Fig. 4.
Myotube formation in the QM7 cells expressing CBY2. The myotube (red) and nuclei (blue) was stained with myosin heavy chain (MyHC) antibody and DAPI, respectively. The myotube was shorter and thinner in CBY2-overexpressed cells compared to control. (Magnification = ×200)
Download Original Figure
Fig. 5.
Comparison of myotube area. The area of myotube in both groups were measured and compared. The area of myotube was larger in control than CBY2-overexpressed cells about 4 folds. Data were shown as mean±SEM (n=3). * means a significance of P<0.05.
Download Original Figure
앞에서도 언급했지만, CBY2의 기능적 특성은 아직까지 많이 밝혀지지 않았다. 최근 연구 결과에 의하며, 사람의 대장암 RKO 세포에서 이 유전자를 억제시키면, 이 세포의 분열을 방해하고 세포 사멸을 유도하는 것으로 알려져 있다 (Zheng and Chen, 2018). 단백질체와 유전체 연구에서는 이 유전자가 소 정자의 수정능, 닭 내부 기관의 형질, 홀스타인 소의 최신 선발 특징 등과 관련이 있는 것으로 알려져 있다(Qanbari et al., 2010; D’Amours et al., 2019; Moreira et al., 2019). CBY2의 기능적 메커니즘은 이와 유사한 유전자인 Chibby를 통해 유추해볼 수 있을 것이다. Chibby는 β-catenin의 C-말단에 직접적으로 붙어서 β-catenin의 길항물질로 작용하는데, Chibby가 14-3-3과 β-catenin과 함께 결합하여 안정적인 복합체를 형성하면 세포질에 머무르게 되고, 이는 WNT 신호전달의 주요 전사인자인 Lef-1이 β-catenin과 결합하는 것을 방해함으로써 그 신호전달을 억제하는 기능이 있다(Takemaru et al., 2003; Li et al., 2008). 따라서, Chibby-like superfamily domain을 가진 CBY2도 비슷한 기능을 할 가능성이 높다. 많은 연구 결과에 의하면, 정식과 비정식 WNT 신호전달은 근육 섬유의 비대화에 관여하는 것으로 알려져 있다(Armstrong and Esser, 2005; Bernardi et al., 2011; Han et al., 2011). 또한, 최신 연구에서는 Axin2를 통한 WNT/β-catenin 신호전달이 근육발생에 필요하다는 것이 밝혀졌다(Huraskin et al., 2016). 이처럼 근육발생에 WNT 신호전달이 필요한데, Chibby처럼 CBY2도 이 신호전달을 방해함으로써 근육발생을 억제할 가능성이 있다. 하지만 이는 추후 실험을 통해 검증되어야 한다.
본 연구에서는 메추리 CBY2 유전자를 클로닝하여 서열을 분석하고, 다른 동물들과 비교를 통해 Chibby-like superfamily domain을 가지고 있음을 확인하였다. 또한, 이 유전자가 메추리 조직에 따라 다양한 발현 양상을 보이는 것을 확인하였으며, 근육세포에서 과발현시켰을 때 근육발생을 억제함을 확인하였다. 이는 근육발생 연구 및 메추리 모델 활용에 있어 중요한 기초 자료가 될 수 있으며(Shin, 2017), 추후 CBY2의 근육발생 억제 기작 연구를 통해 정확한 작용 원리를 밝혀내야 할 것이다.
사 사
이 성과는 과학기술정보통신부의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(2016R1C1B1013407).
REFERENCES
Armstrong DD, Esser KA 2005 Wnt/beta-catenin signaling activates growth-control genes during overload-induced skeletal muscle hypertrophy. Am J Physiol Cell Physiol 289(4):C853-859.

,


Bernardi H, Gay S, Fedon Y, Vernus B, Bonnieu A, Bacou F 2011 Wnt4 activates the canonical beta-catenin pathway and regulates negatively myostatin: functional implication in myogenesis. Am J Physiol Cell Physiol 300(5):C1122-1138.

,


Buckingham M, Relaix F 2007 The role of Pax genes in the development of tissues and organs: Pax3 and Pax7 regulate muscle progenitor cell functions. Annu Rev Cell Dev Biol 23:645-673.

,


Chal J, Pourquie O 2017 Making muscle: skeletal myogenesis
in vivo and
in vitro. Development 144(12):2104-2122.

,


Collins CA, Gnocchi VF, White RB, Boldrin L, Perez-Ruiz A, Relaix F, Morgan JE, Zammit PS 2009 Integrated functions of Pax3 and Pax7 in the regulation of proliferation, cell size and myogenic differentiation. PLoS One 4(2):e4475.

,

,


D’Amours O, Calvo E, Bourassa S, Vincent P, Blondin P, Sullivan R 2019 Proteomic markers of low and high fertility bovine spermatozoa separated by Percoll gradient. Mol Reprod Dev 86(8):999-1012.

,


Feige E, Chen A, Motro B 2002 Nurit, a novel leucine-zipper protein, expressed uniquely in the spermatid flower-like structure. Mech Dev 117(1-2):369-377.


Han XH, Jin YR, Seto M, Yoon JK 2011 A WNT/beta-catenin signaling activator, R-spondin, plays positive regulatory roles during skeletal myogenesis. J Biol Chem 286(12):10649-10659.

,

,


Huraskin D, Eiber N, Reichel M, Zidek LM, Kravic B, Bernkopf D, von Maltzahn J, Behrens J, Hashemolhosseini S 2016 Wnt/beta-catenin signaling via Axin2 is required for myogenesis and, together with YAP/Taz and Tead1, active in IIa/IIx muscle fibers. Development 143(17): 3128-3142.

,


Li FQ, Mofunanya A, Harris K, Takemaru K 2008 Chibby cooperates with 14-3-3 to regulate beta-catenin subcellular distribution and signaling activity. J Cell Biol 181(7): 1141-1154.

,

,


Li FQ, Singh AM, Mofunanya A, Love D, Terada N, Moon RT, Takemaru K 2007 Chibby promotes adipocyte differentiation through inhibition of beta-catenin signaling. Mol Cell Biol 27(12):4347-4354.

,

,


Moreira GCM, Salvian M, Boschiero C, Cesar ASM, Reecy JM, Godoy TF, Ledur MC, Garrick D, Mourao GB, Coutinho LL 2019 Genome-wide association scan for QTL and their positional candidate genes associated with internal organ traits in chickens. BMC Genomics 20(1): 669.

,

,


Qanbari S, Pimentel EC, Tetens J, Thaller G, Lichtner P, Sharifi AR, Simianer H 2010 A genome-wide scan for signatures of recent selection in Holstein cattle. Anim Genet 41(4):377-389.


Sabourin LA, Rudnicki MA 2000 The molecular regulation of myogenesis. Clin Genet 57(1):16-25.

,


Shin S 2017 Application of quail model for studying the poultry functional genomics. Korean J of Poult Sci 44(2): 103-111.


Singh AM, Li FQ, Hamazaki T, Kasahara H, Takemaru K, Terada N 2007 Chibby, an antagonist of the Wnt/beta-catenin pathway, facilitates cardiomyocyte differentiation of murine embryonic stem cells. Circulation 115(5):617-626.

,

,


Takemaru K, Yamaguchi S, Lee YS, Zhang Y, Carthew RW, Moon RT 2003 Chibby, a nuclear beta-catenin-associated antagonist of the Wnt/Wingless pathway. Nature 422(6934): 905-909.

,


Zheng LZ, Chen SZ 2018 shRNAinduced knockdown of the SPERT gene inhibits proliferation and promotes apoptosis of human colorectal cancer RKO cells. Oncol Rep 40(2): 813-822.