서 론
지금까지 경제 동물산업에 있어 가장 주된 관심사는 생산성 향상이었으나, 최근 동물복지에 관한 관심이 높아지면서 기존 생산성 위주의 가축 관리체계에 대해 많은 논란이 있다. 이러한 관점에서 국내에서는 지난해부터 동물보호법이 개정 발효되면서 강도 높은 동물복지정책을 시행하고 있다(National Law Information Center, 2019). 본 동물보호법은 가축을 포함한 동물의 사육 관리의 기본원칙으로 동물이 본래의 습성과 신체의 원형을 유지하면서 정상적으로 살 수 있도록 할 것, 동물이 갈증 및 굶주림을 겪거나 영양이 결핍되지 아니하도록 할 것, 동물이 정상적인 행동을 표현할 수 있고 불편함을 겪지 아니하도록 할 것, 동물이 고통·상해 및 질병으로부터 자유롭도록 할 것, 동물이 공포와 스트레스를 받지 아니하도록 할 것을 명시하고 있다. 닭의 경우, EU는 기존 배터리 케이지 사육을 제한하는 최소의 복지관리기준을 제시하고, 2012년부터 유럽연합에 가입한 모든 국가는 산란계의 케이지 사육을 전면 금지하는 법안을 통과시켰다(Council Directive 1999/74/EC, 1999). 그럼에도 불구하고 아직 일부 유럽지역 및 전 세계 많은 지역에서 산란계의 사육 형태는 케이지 사육이 보편화되어 있다. 이러한 현상은 케이지 사육이 산란계의 관리적 측면과 아울러 생산적 측면에서 더욱 효율성이 높기 때문이다(Koelkebeck and Cain, 1984; Koelkebeck et al., 1987; Stanley et al., 2013). 그러나 기존의 케이지 사육 형태는 닭의 고유한 생리적 습성을 저해하고, 생존율에 부정적인 영향을 미치는 대표적인 동물복지 위해 요인으로 제시됨에 따라(Mench et al., 1986; Baxter, 1994; Freire et al., 2003; Sohn et al., 2011) 기존 케이지 사육의 대체 사육 방식으로 확장 케이지(enriched cage), 에비어리(aviary system), 겸용 케이지(furnished cage), 평사(floor-pen) 및 방사 등과 같은 사육 형태들을 소개하고 있다(Rodenburg et al., 2005; Pohle and Cheng, 2009; Tactacan et al., 2009; Sherwin et al., 2010; Lay et al., 2011). 이러한 사육 형태들 중 어떠한 사육 방식이 닭의 생산성과 복지에 가장 바람직한 형태인가에 대해서는 아직 뚜렷한 결론을 내리지 못한 상태이다. 그러므로 닭의 사육 형태가 개체의 스트레스 반응 및 이들의 생산능력에 미치는 영향에 대해서는 동물복지와 관련한 닭의 사육 형태 설정을 위해 반드시 구명하여야 할 과제이다.
따라서 본 연구는 단관백색레그혼종(single comb White Leghorn)을 대상으로 기존 케이지 사육과 평사 사육 형태에 따른 개체들의 스트레스 반응 정도와 이들의 생산능력을 비교 분석하고자 한 것으로 산란기의 일정 기간 동안 두 가지 형태로 분리 사육한 후 이들의 생존율, 체중, 증체량, 산란율, 난중 및 난질을 조사하여 생산능력을 비교하고, 텔로미어 함유율, heterophil과 lymphocyte 비율(H/L ratio), 열충격단백질(heat shock protein; HSP) 유전자 발현율 및 DNA 손상률을 분석하여 개체들의 스트레스 반응 정도를 비교하였다.
재료 및 방법
본 시험은 경남과학기술대학교 종합농장에서 사육 중인 단관백색레그혼종 암컷을 대상으로 하여 케이지(conventional cage) 사육군 272수와 평사(floor-pen) 사육군 219수, 총 491수를 공시하고, 케이지의 경우 총 28개의 케이지에, 평사는 2개의 펜에 분산 배치하여 이를 반복수로 하였다. 모든 시험 계들은 발생 후 동일한 사양 방식으로 케이지에서 육추한 다음 평사에서 육성하였다. 시험계들은 34주령 때 무작위로 케이지 사육군과 평사 사육군으로 나누고 그룹 간 체중과 산란율이 비슷하도록 임의 배치하였다. 사육 형태에 따른 비교 시험은 34주령에서 43주령까지 10주간 수행하였고, 이때 사료 급여 등 일반 사양 관리는 동일하게 시행하였다. 케이지 사육군은 강제환기 및 자동온도조절시스템이 완비된 무창계사 내 2단 4열의 군사형 케이지로서 칸당 90 cm(W) × 90 cm(L) × 66 cm(H)의 철망 배터리형 케이지에 10수씩(♀9:♂1) 배치하였고(810 cm2/수), 평사 사육군은 펜(pen) 형태로 사육실과 운동장이 각각 분리된 개방식 계사로 펜당 400 cm(W) × 700 cm(L) × 380 cm(H) 크기의 방에 각 130수씩(♀110:♂20) 사육하였다(2,150 cm2/수). 두 사육군 모두 시험 기간 중 시중 산란 중기 배합사료로 자유 급여하였고, 점등 관리는 케이지 사육군의 경우 시험 기간 동안 16시간으로 고정하여 인공 점등하고, 평사 군은 자연 일조에 사육실 내 인공 점등을 가하여 16시간으로 고정하였다. 시험 기간 동안 각종 생산능력을 조사하였고, 스트레스 반응 정도 분석은 43주 시험 종료 때 사육군별 60수씩 개체의 익정맥에서 혈액을 채취하여 시료로 이용하였다. 예방접종 등 그 밖의 일반 닭 사양 관리는 경남과학기술대학교 닭 사육관리지침에 따랐으며, 시험에 관련된 닭의 관리 및 취급은 본 대학 동물실험윤리위원회의 승인을 득한 후(IACUC Approved No. 2018-7) 본 규정을 준수하여 시행하였다.
산란율(hen-day egg production)은 34주령부터 43주령까지 매 주령별 산란수 대비 연 생존수수로 주령별 산란율을 계산하고, 이들의 평균값을 나타내었다.
난질은 43주령에 산란한 각 군별 100개의 계란을 대상으로 난중, 난각색, 난백높이, 하우유니트(Haugh unit; HU), 난황색, 난각두께 및 난각무게를 조사하였다. 분석에 이용된 계란은 난중을 측정한 후 파각하고 난각색, 난백높이 및 난황색을 QCM+ system(TSS Ltd. York, England)으로 측정하였고, 난각두께는 Micrometer(Series 293-IP65, Mitutoyo Corp. Kanagawa, Japan)로 측정하였다. HU는 난중과 난백높이를 이용하여 HU = 100 log(H+7.57−1.7W0.37)로 계산하였다(Haugh, 1937).
텔로미어 함량 분석은 43주령에 채혈한 혈액으로부터 분리한 백혈구 세포를 대상으로 양적형광접합보인법(quantitative fluorescence in situ hybridization)으로 분석하였고, 분석 방법은 Cho et al.(2019)이 제시한 방법과 동일하게 시행하였다. 처리한 표본은 형광현미경(Model AX-70, Olympus, Tokyo, Japan)으로 간기 상태의 핵을 관찰한 후 개체별 100여 개의 상을 디지털카메라(Model DP-70, Olympus, Tokyo, Japan)로 촬영하고, 이를 이미지 분석 프로그램(MetaMorph®, UIC, Pennsylvania, USA)을 이용하여 telomeric DNA의 함유율을 측정하였다.
Heterophil과 lymphocyte의 비율(H/L ratio) 측정은 43주령 개체들의 혈액 내 백혈구 세포를 대상으로 하였고, 분석은 Jeong et al.(2020)이 제시한 방법과 동일하게 시행하였다. 처리한 표본은 광학현미경(Model BX-50, Olympus, Tokyo, Japan)을 이용하여 단위면적당 heterophil과 lymphocyte 수를 관측하고(obj. ×40), 이들의 비율을 계산하였다.
HSP 유전자 발현율 분석은 HSP-70, HSP-90α 및 HSP-90β 유전자를 대상으로 하여 43주령 혈액으로부터 RNA를 추출한 후 cDNA를 합성하여 분석하였다. 이의 분석은 real time PCR machine(Model LC480, Roche, Mannheim, Germany)을 이용하여 Quantitative-PCR 방법으로 분석하였고, 이때 사용한 primers와 PCR의 방법은 Jeong et al.(2020)이 제시한 방법과 동일하게 시행하였다. Ct 값은 LightCycler® 480 software v1.5(Roche Diagnostics, GmbH, Mannheim, Germany)를 이용하여 측정하였고, 각 유전자의 상대적 정량 값은 Livak and Schmittgen(2001)이 제시한 2−ΔΔCt 값으로 계산하였다.
DNA 손상률 분석은 43주령 개체들의 혈액 내 백혈구 세포를 대상으로 단일 세포 전기영동법으로 알려진 comet assay 방법으로 분석하였다. 본 분석에 이용한 comet assay 방법은 Cho et al. (2016)이 제시한 방법과 동일하게 시행하였다. 처리를 마친 표본은 형광현미경(Model DP-70, Olympus, Tokyo, Japan)으로 관찰하고, 개체별 50여 개의 세포를 Comet Score software1.5(TriTek Corp. Sumerduck, VA, USA)로 분석하였다. Comet 지표로 tail 내 DNA 함유율(% DNA in tail), tail 내 DNA 생성률(tail moment) 및 올리브 모먼트(olive moment)를 분석하여 DNA 손상률로 제시하였다.
결과 및 고찰
백색레그혼종을 대상으로 34주령부터 43주령까지 케이지와 평사로 분리 사육한 후, 계사 사육 형태별 이들의 생존율, 체중, 증체량 및 일계산란율의 평균값을 Table 1에 제시하였다.
Values are mean±standard deviation.
생존율은 케이지 사육군과 평사 사육군 모두 시험 개시 대비 시험 종료까지 각 2수씩 폐사하여 평균 99.2%의 생존율을 보이고, 계사 사육 형태 간에 생존율의 차이는 없는 것으로 나타났다. 본 연구 결과와 달리 많은 연구에서 산란 기간 동안 계사 사육 형태 간에 생존율의 차이가 있다고 하였는데, 레그혼종뿐만 아니라 실용 산란계 모두 평사 사육군이 케이지 사육군과 비교해 높은 생존율을 보고하였다(Mench et al., 1986; Singh et al., 2009; Sohn et al., 2011). 이는 산란기 동안 케이지 사육 형태가 닭에게 생리적으로 매우 큰 스트레스 요인으로 작용하여 생존율에 영향을 미친다는 것을 의미하지만, 또 다른 연구에서는 오히려 케이지 사육이 평사 사육에 비해 높은 생존율을 보이며 개체의 스트레스 반응 정도도 낮았다고 보고하였다(Koelkebeck and Cain, 1984). 본 연구에서는 사육 형태 간에 생존율의 차이가 없는 것으로 나타났는데, 이는 10주간의 짧은 시험 기간 동안 환경적 변화요인들이 생존율에 영향을 미칠만한 요소로 개체에 작용하지 않았기 때문인 것으로 생각된다.
평사와 케이지 사육 개체 간의 체중 비교에 있어, 시험 개시 전 30주령과 시험 개시 이후 40주령의 체중을 측정한 결과, 사육 형태에 따른 체중의 차이는 없는 것으로 나타났다. 평사 사육 개체들과 케이지 사육 개체들 모두가 30주령에 비해 40주령 때 다 같이 180 g 정도의 증체를 나타냄으로 계사 사육 형태에 따른 개체 간에 성장 능력의 차이는 없는 것으로 보인다. 산란계에 있어 사육 형태가 체중에 미치는 영향에 관한 연구로서 평사 사육 개체들의 체중이 케이지 사육 개체들과 비교해 산란 기간 동안 유의하게 높았다고 보고한 반면(Singh et al., 2009; Sohn et al., 2011), 오히려 케이지에서 사육한 개체들의 체중이 평사 사육 개체들에 비해 높았다는 보고도 있고(Koelkebeck and Cain, 1984; Koelkebeck et al., 1987), 또 다른 연구에서는 계사 사육 형태에 따른 체중의 차이는 없었다고 하였다(Mench et al., 1986). 이처럼 계사 사육 형태가 개체의 체중에 미치는 상이한 연구 결과들은 연구자마다 각기 다른 시험환경으로 인하여 외부 환경요인이 개체에 직접적인 스트레스로 작용하여 성장률의 둔화를 유발하였는가 그렇지 않은가의 차이로 해석된다.
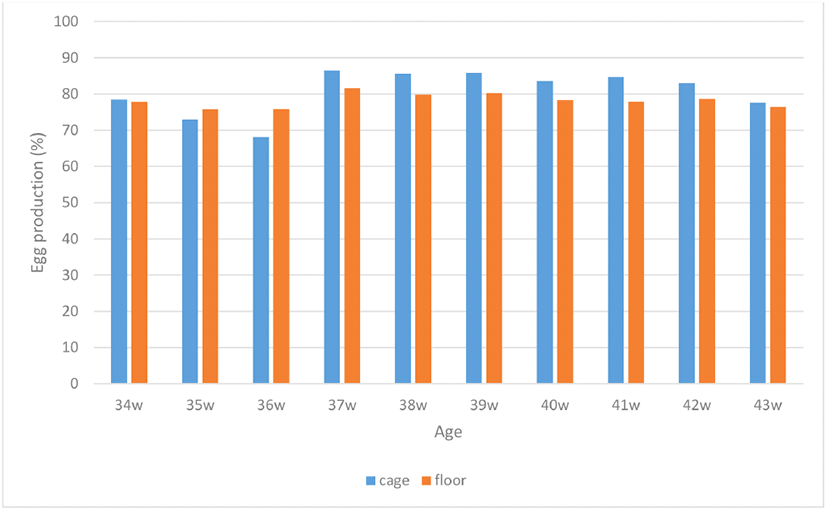
산란능력으로 34주령부터 43주령까지 10주간의 일계산란율을 조사한 결과, 평사 사육군과 케이지 사육군 간에 평균산란율의 차이는 없는 것으로 나타났다. 시험 기간 동안 평사 사육군과 케이지 사육군 간의 주령별 산란율의 비교를 Fig. 1에 제시하였다. 사육 형태 간에 평균산란율의 차이는 없었지만 케이지 사육군의 경우 시험 개시 후 약 3주 정도 산란율의 감소를 보이다가 이후 평사 사육군보다 오히려 높은 산란율을 유지하였는데, 이는 사육환경변화에 따른 일시적인 산란율 저하로 보이고, 적응 기간을 거친 후 이전의 산란 상태를 회복한 것으로 판단된다. 계사 사육 형태에 따른 산란계의 산란능력 비교연구에서 연구자 간에 많은 이견이 있는데, 평사 사육 개체들의 산란율이 케이지 사육 개체들보다 유의하게 높은 산란율을 보인다고 보고한 반면(Mench et al., 1986; Sohn et al., 2011), 반대로 케이지 사육 개체들이 평사 사육 개체들보다 훨씬 높은 산란 성적을 나타내었다고 보고하기도 하고(Koelkebeck and Cain, 1984; Koelkebeck et al., 1987; Stanley et al., 2013), 케이지와 평사 사육 간에 산란율의 차이가 없다고도 보고하였다(Anderson and Adams, 1994; Singh et al., 2009). 본 연구에서는 평사 사육군과 케이지 사육군 간에 산란율의 차이는 없는 것으로 나타나 계사 사육 형태에 따른 산란능력의 차이는 없는 것으로 판단되나, 이는 단기간의 산란검정으로 쉽게 결론을 내리기가 어려운 결과이다. 따라서 계사 사육 형태가 산란능력에 미치는 영향을 판단하기 위해서는, 보다 오랫동안 지속적인 산란율의 조사로 면밀한 분석이 필요한 것으로 사료된다. 또한, 사육 형태에 따른 난질을 비교하기 위하여 43주령에 산란한 계란 각 100개에 대하여 난중, 난각색, 난백높이, HU, 난황색, 난각두께 및 난각무게를 조사하고 이의 결과를 Table 2에 제시하였다. 분석 결과, 난중을 포함한 난각색, 난백높이, 난각무게에 있어 케이지 사육군에서 생산한 계란이 평사 사육군과 비교해 유의하게 높은 값을 보였지만(P<0.05), HU와 난황색, 난각두께에서는 사육 형태 간의 차이가 없는 것으로 나타났다. 이러한 결과는 관리 요인에 의해 주로 영향을 받는 난각질과 사료 이용성과 결부된 난각색 등은 케이지 사육군의 계란이 우수하다는 것을 시사한다. 계사 사육 형태에 따른 난질의 비교연구에서 난중 및 난각무게 등은 케이지 사육군의 계란이 평사 사육군보다 우수하나, 내부 난질은 오히려 평사 사육군이 케이지 사육군보다 양호하거나 또는 거의 차이가 없다고 보고하고 있다(Mench et al., 1986; Koelkebeck et al., 1987; Singh et al., 2009; Stanley et al., 2013). 따라서 계사 사육 형태에 따른 계란의 품질적 측면에서는 명확한 결론을 내리기가 어려우나, 위생적인 측면에서는 케이지 사육으로 생산한 계란이 평사에서 사육하여 생산한 계란에 비해 월등히 우수한 것으로 보고되고 있다(Ellen et al., 2000; De Reu et al., 2005; Stanley et al., 2013).
Values are mean±standard deviation.
The different superscripts within column significantly differ.
케이지 사육 및 평사 사육 형태가 레그혼 종의 스트레스 반응 정도에 미치는 영향을 살펴보고자 텔로미어 함유율, H/L ratio, HSP 유전자 발현율 및 DNA 손상률을 비교 분석하였다. 모든 분석은 43주령에 채혈한 혈액세포를 대상으로 하였다.
계사 사육 형태별 사육 개체들의 텔로미어 함량을 분석하고, 이들의 평균 함유율을 Table 3에 제시하였다. 분석 결과, 43주령 개체들의 혈액 내 백혈구 세포의 텔로미어 함유율은 평균 1.65% 정도이고, 평사 사육 개체들이 케이지 사육 개체들과 비교해 유의하게 높은 함유율을 나타내었다(P<0.05). 세포 내 텔로미어 함량은 연령이 증가함에 따라 자연스럽게 감소하는데(Harley et al., 1992), 사육 환경과 같은 외적 환경요인들이 텔로미어 감축률과 함유율에 매우 큰 영향을 미치는 것으로 알려져 있다(Sohn et al., 2012; Sohn and Subramani, 2014; Cho et al., 2016). 특히, 백혈구 세포는 면역과 밀접한 관련이 있는 것으로 스트레스와 같은 외적 요인에 더욱 민감하게 반응함으로 세포들의 텔로미어 함유율에 직접적인 영향을 미친다. 본 연구 결과, 케이지 사육 개체들의 텔로미어 함유율이 평사 사육 개체들에 비해 낮은 것은 사육환경 형태가 닭에 스트레스 요인으로 작용함을 시사하는 것으로 케이지 사육 형태가 평사 사육과 비교해 상대적으로 높은 스트레스 적 환경임을 의미한다.
| Housing types | Amount of telomeric DNA (%) | H/L ratio |
|---|---|---|
| Cages | 1.63±0.09b | 0.48±0.03a |
| Floor-pens | 1.66±0.08a | 0.40±0.08b |
| P-values | 0.0213 | <0.0001 |
Values are mean±standard deviation.
The different superscripts within column significantly differ.
계사 사육 형태별 사육 개체들의 스트레스 반응 정도를 비교하기 위하여 H/L ratio를 분석하고, 사육 형태별 분석 결과를 Table 3에 제시하였다. 분석 결과, 케이지 사육 개체들의 H/L ratio 값이 평사 사육 개체들보다 유의하게 높게 나타났다(P<0.001). H/L ratio는 혈액 내 heterophil과 lymphocyte의 비율을 나타내는 것으로 일반적으로 개체가 스트레스에 노출될 경우 heterophil의 수는 증가하고, lymphocyte의 수는 감소하기 때문에 이들의 비율로서 개체의 스트레스 반응 정도를 알 수 있다(Gross and Siegel 1983; Gross 1989; McFarlane and Curtis 1989). 닭의 경우, 고온 환경이나 밀집 사육, 암수 혼합 사육과 같은 외적 스트레스 환경하에서 개체들의 H/L ratio 값은 현저하게 증가하였고(Campo et al, 2008; Cotter, 2015; Jeong et al., 2020), 반면 비타민 제제와 같은 항산화제의 급여는 세포 내 활성산소를 감소시켜 H/L ratio 값을 저하시켰다(Zulkifli et al., 2000). 계사 사육 형태에 따른 H/L ratio 값의 비교는 본 연구 결과와 같이 케이지 형태의 사육 개체들이 평사 사육 개체에 비해 높은 값을 보였다는 보고가 있지만(Shini, 2003; Campo et al., 2008), 이들 간의 값 차이가 없다고도 하였다(Mench et al., 1986; Singh et al., 2009). 이상의 결과에 따라 H/L ratio 값을 개체의 스트레스 반응 표지로 간주하였을 때, 본 연구 결과 케이지 사육 형태가 평사 사육 형태에 비해 닭에게 상대적으로 높은 스트레스적 환경이라 사료된다.
계사 사육 형태 간에 개체들의 스트레스 반응 정도를 비교하기 위하여 열충격단백질로 알려진 HSP-70, HSP-90α 및 HSP-90β 유전자 발현율을 분석하고, 이의 결과를 Table 4에 제시하였다. 분석 결과, 모든 HSP의 유전자 발현율은 케이지 사육 개체들이 평사 사육 개체들에 비해 다소 높게 나타났으나, HSP-90β의 유전자 발현율을 제외하고 계사 형태 간에 유의한 차이는 없었다. HSP-90β 유전자 발현율의 경우, 케이지 사육 개체들이 평사 사육 개체들보다 거의 1.8배 정도 상승한 것으로 나타났다. 열충격단백질들은 열 스트레스에 반응하여 합성되는 특이 단백질 군으로서 고온 스트레스뿐만 아니라, 외적 스트레스에 노출될 때도 이의 발현율이 증가한다(Lindquist, 1986; Schlesinger, 1986). 닭도 고온뿐만 아니라 다양한 스트레스 적 사육환경에 노출되었을 경우 HSP 군의 단백질 합성이 현저하게 증가하였다고 하였다(Beloor et al., 2010; Sohn et al., 2012; Cho et al, 2019). 닭에 있어 HSP 군 중에 어떠한 HSP 유전자가 스트레스에 가장 민감하게 반응하는 가는 다소 다른 결과들을 제시하고 있지만, 개체들이 내·외부적 스트레스에 노출되었을 때 HSP 군의 단백질은 증가하는 것으로 판단된다(Meng et al., 1993; Zulkifli et al., 2002; Soleimani et al., 2011; Sohn et al., 2012). 따라서 본 연구 결과, 케이지 사육 개체들의 HSP 유전자 발현율이 평사 개체들에 비해 높음은 케이지 사육이 닭에 있어 상대적으로 큰 스트레스 요인임을 시사한다고 하겠다.
Values are mean±standard deviation.
The different superscripts within column significantly differ.
ΔCt values which are equal to the difference in threshold cycles for target and internal control gene.
2−ΔΔct values which indicate the fold change in gene expression relative to the control.
케이지 사육 개체와 평사 사육 개체 간의 DNA 손상률을 comet assay 법으로 분석하고, 이의 결과를 Table 5에 제시하였다. 분석 결과, % DNA in tail, Tail moment, Olive moment 등 모든 comet 지표가 케이지 사육 개체들이 평사 사육 개체들과 비교해 유의하게 높게 나타났다(P<0.01). 정상적인 세포도 세포분열 상태에서 어느 정도 DNA의 손상이나 변형이 일어나지만, 세포가 스트레스에 노출될 경우 활성산소로 인하여 DNA의 손상이 더욱 촉진된다고 한다(Richter et al., 1988; Chen et al., 2007). 따라서 DNA의 손상 정도로서 스트레스의 반응 정도를 어느 정도 알 수 있는데, comet assay는 세포 내 포괄적 DNA의 파손 정도를 분석하는 방법이다(Singh et al., 1988; Nandhakumar et al., 2011). Comet assay 지표로는 전체 핵 대비 DNA 파손율을 나타내는 % DNA in tail, tail 내 DNA 생성률을 제시하는 Tail Moment 및 DNA 파손 분포와 정도를 상대적으로 나타내는 Olive Moment가 있다. 계사 사육 형태 간 DNA 손상률 분석에 관한 연구로 Sohn et al.(2011)은 레그혼을 대상으로 16주령부터 64주령까지 평사와 케이지 사육 개체 간의 DNA 손상률을 분석한 바 모든 comet 지표들이 케이지 사육 계군이 평사 계군보다 높았다고 하여 본 연구 결과와 일치되는 결과를 제시하였다. 따라서 케이지 사육 개체들의 comet 지표들이 평사 사육 개체들보다 모두 상승한 것은 세포 내 DNA 손상이 증가함을 의미하는 것으로 닭에 있어 케이지 사육 형태가 평사 사육과 비교해 개체들에게 상대적으로 높은 스트레스적 환경임을 시사한다고 하겠다.
| Housing types | % DNA in tail | Tail moment | Olive moment |
|---|---|---|---|
| Cages | 5.17±0.80a | 6.28±1.55a | 7.51±1.42a |
| Floor-pens | 4.26±0.56b | 5.34±1.72b | 5.42±1.17b |
| P-values | <0.0001 | 0.0021 | <0.0001 |
Values are mean±standard deviation.
The different superscripts within column significantly differ.
이상 케이지 사육 개체와 평사 사육 개체 간의 텔로미어 함유율, H/L ratio, HSP 유전자 발현율 및 DNA 손상률을 비교 분석한 결과, 모든 표지에서 케이지 사육 개체들이 평사 사육 개체에 비해 높은 스트레스 지표 값을 보여 닭에 있어서 케이지 사육 형태가 평사 사육 형태보다 상대적으로 높은 스트레스적 환경인 것으로 사료된다.








