Article
저병원성 조류인플루엔자 감염에 따른 육계의 면역인자 변화
김덕환1
,
김규직2
,
노진용2
,
이선학1
,
손지선3,4
,
박혜경5
,
남상섭6,†
Changes in Immunological Factors Induced by H9N2 Avian Influenza Challenge in Broilers
Deok-Hwan Kim1
,
Kyu-Jik Kim2
,
Jin-Yong Noh2
,
Sun-Hak Lee1
,
Chang-Seon Song3,4
,
Hae Kyoung Park5
,
Sang-Soep Nahm6,†
Author Information & Copyright ▼
1건국대학교 수의과대학 조류질병학 실험실 대학원생
1Graduate Studnet, Avian Disease Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
2Reseatcher, KCAV Co., Ltd., Seoul 05029, Republic of Korea
3Professor, Avian Disease Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
4Representative, KCAV Co. Ltd., Seoul 05029, Republic of Korea
5Reseatcher, Veterinary Anatomy Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
5건국대학교 수의과대학 수의해부학 실험실 연구원
6Professor, Veterinary Anatomy Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
© Copyright 2020, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 12, 2020; Revised: Dec 01, 2020; Accepted: Dec 21, 2020
Published Online: Dec 31, 2020
요약
가금산업에서 전염성 질병은 농장의 생산성에 악영향을 미치는 중요한 요인이다. 그 중 저병원성 조류인플루엔자는 산란율과 증체율에 영향을 준다. 본 연구에서는 육계에서 저병원성 조류인플루엔자 감염시 혈청 단백질 및 사이토카인의 변화 양상을 조사하였다. 1일령의 육계를 1주령부터 4주령까지 각 주령마다 저병원성 조류인플루엔자를 공격 접종 후 혈중 chDBP, Chicken Ovotransferrin, chIL-1β, chIL-6, chIFN-γ의 양을 비교하였다. 어린 주령에 저병원성 조류인플루엔자를 공격접종한 그룹에서는 4주령에 음성대조군과 비교해 chIL-1β, chIL-6가 유의성 있는 낮은 값을 보이는 것을 확인하였다. 추가적인 연구를 통하여 chIL-1β, chIL-6가 질병의 경과를 확인할 수 있는 보조적인 감염 지표로 활용될 수 있을 것으로 판단된다.
ABSTRACT
Avian influenza virus infection, one of the most important diseases recognized in the poultry industry, is known to cause changes in cytokine and serum protein levels. However, the normal ranges and/or age-dependent changes in important cytokines and serum proteins associated with influenza infection have not been fully elucidated. In this study, the levels of cytokines (interleukin-1β, interleukin-6, and interferon-γ) and serum proteins (vitamin D binding protein and ovotransferrin) were determined in 1-week- to 4-week-old broilers at 1-week intervals after challenge with a low pathogenic influenza virus. The results showed that the physiological levels of cytokines and serum proteins varied with aging during the 4 weeks. The levels of interleukin-1β and interleukin-6 increased from 20% to 35% after influenza infection compared to those in the negative control group, indicating that these cytokines may be used to monitor disease progression.
Keywords: broiler; cytokine; serum protein; low pathogenic avian influenza
서 론
가금산업에서 전염성 질병은 농장의 생산성에 악영향을 미치는 아주 중요한 요소로서 이를 막기 위해 효과적인 차단방역 및 백신접종 시스템의 도입과 적용이 요구된다(Conan et al., 2012). 그러나 새로운 전염성 질병의 출현에 따른 적절한 차단방역이나 백신접종 실패로 인해 질병의 근절에 많은 어려움을 겪고 있어, 질병의 조기 탐색과 진단 역시 중요한 요소로 인식되고 있다. 현재 가금산업에서 가장 중요시 인식되고 있는 질병 중 하나인 고병원성 조류인플루엔자 바이러스는 닭에 감염 시 높은 폐사율과 이환율을 나타내며, 막대한 경제적 피해를 야기하고 있으며(Lee et al., 2013), 저병원성 조류인플루엔자도 산란계에서는 산란율과 육계에서는 증체율에 영향을 미치기 때문에(Garber et al., 2019) 조류인플루엔자의 방역 및 조기 진단을 위해 다양한 방법이 강구되고 있다.
조류인플루엔자에 감염되면 숙주의 면역을 억제하려는 인플루엔자의 다양한 비구조 단백질 때문에, 면역체계를 포함한 체내의 여러 인자들이 변화한다는 연구 결과가 보고되었다(James et al., 2019). 일반적으로 아직 면역체계가 미성숙한 어린 주령의 가금에서 질병 감염은 더욱 높은 임상증상을 유발하며, 이후 다양한 면역인자들이 사육단계에서 영향을 미치는 것으로 알려져 있다(Huang et al., 2017). 그러나 감염에 따른 면역인자의 지속적인 변화 추이를 관찰하거나 감염 시기의 영향에 대한 연구는 미흡한 실정이다.
본 연구에서는 상대적으로 사육 기간은 짧지만 사육 농가수와 규모면에서 산란계보다 많은 육계를 모델로 실험을 실시하였다. 실제 양계농장의 상황을 실험적으로 재현하기 위해 specific pathogen free 실험동물이 아닌 육계를 이용하였고, 조류인플루엔자 감염 직후의 임상증상의 관찰보다는 일정기간 경과 후 혈청내 사이토카인과 특정 단백질의 변화 양상을 조사하였다. 특히 인플루엔자 감염에 수반되는 염증 때문에 분비되는 면역매개물질로서 진단학적 활용 가능성이 높은 3개의 사이토카인(Chicken interleukin 1 beta, Chicken Interleukin 6, Chicken Interferon gamma)과 2개의 혈청 단백질(Chicken Vitamin-D binding protein, Chicken Ovotransferrin)의 변화 양상에 대해 조사하였다(Xie et al., 2002; Lee et al., 2011; Mohamed Sarjoon Abdul-Cader et al., 2018).
재료 및 방법
1. 실험동물
조류인플루엔자 H9N2에 대한 혈청 내 항체를 Hemagglutination Inhibition(HI) assay를 이용해 검사하였다. 검사 후, H9N2에 대해 항체가 확인되지 않은 아바에이커 1일령 육계 32마리를 외부와의 접촉이 차단된 닭 격리 사육장치(Three Shine, Korea)에 사육하였다. 본 실험은 건국대학교 동물실험 계획서에 의거 동물보호법 및 건국대학교 동물실험윤리위원회에서 승인된 동물실험방법(승인번호 KU19230)에 따라 수행되었다.
2. 저병원성 조류인플루엔자 공격접종
실험 전 조류인플루엔자에 대한 항체가 형성되지 않은 것을 확인하기 위하여 시험에 사용할 육계의 목정맥에서 채혈 후 37℃에 2시간 동안 혈청을 분리하였다. 분리된 혈청은 다시 1,3000 rpm으로 2분간 원심분리하여 순수한 혈청만 실험에 사용하였다. 조류인플루엔자 항체에 대해 ELISA(Bionote, Hwaseong, Korea)를 실시하여 음성으로 확인된 32마리를 실험에 사용하였다.
본 실험의 목적은 육계가 농장에서 실질적으로 사육되는 기간 중 인플루엔자에 감염되는 상황을 조사하는 것이므로 1주차부터 3주차까지 매주 8마리에 저병원성 조류인플루엔자 subtype H9N2(A/Chicken/Korea/01310/2001(H9N2))를 마리당 106.0EID50/ 100 μL로 비강을 통해 공격접종 후 격리사육을 실시하였다. 이 후 접종된 개체에서 동일한 방법으로 채혈하여 혈중 사이토카인의 변화 양상을 확인하였다(Choi et al., 2008). 4주차에는 공격접종 시험군과 무접종 대조군을 전수 채혈하였다(Table 1).
Table 1.
Experimental schedule for avian influenza challenge and serum collection Group
| Group |
Schedule of challenged date |
| 1 week |
2 weeks |
3 weeks |
4 weeks |
| Control (n=8) |
Serum collection |
Serum collection |
Serum collection |
Serum collection |
| Group 1 (n=8) |
Challenged |
Serum collection |
Serum collection |
Serum collection |
| Group 2 (n=8) |
- |
Challenged |
Serum collection |
Serum collection |
| Group 3 (n=8) |
- |
- |
Challenged |
Serum collection |
Download Excel Table
3. 사이토카인 효소면역측정
3개의 공격접종 시험군과 무접종 대조군은 Table 1과 같은 일정으로 접종을 실시하고 1주일 간격으로 채혈하여 혈청을 분리하였다. 혈청 분리는 위에서 설명한 방법과 동일한 방법을 사용하였다. 분리된 혈청은 MybioSource사(California, USA) 5개의 ELISA(Enzyme-Linked Immunosorbent Assay) kit를 이용해 세 가지 사이토카인(Chicken Interleukin 1 beta, Chicken Interleukin 6, Chicken interferon gamma)과 두 가지(Vitamin-D binding Protein, Chicken Ovotransferrin)의 양적 변화 양상을 확인하였다.
4. 통계처리
최종 결과는 평균과 표준편차로 제시하였다. 통계적 유의성 분석은 Prism 5.0(Graphpad software, California, USA)을 이용하여 one-way ANOVA를 실시한 뒤 Tukey 사후 검정을 실시하여 각각 주령별, 그룹별로 비교하였다(*P<0.05, **P<0.01, ***P<0.001).
결 과
1. H9N2 공격접종 후 Chicken Vitamin-D Binding Protien(chDBP) 변화 양상
무접종 대조군의 chDBP 농도는 3주령까지 유의미한 변화가 관찰되지 않았으나, 4주령에 증가하는 양상을 보였다(Fig. 1). 1주령에 공격접종을 실시한 Group 1은 공격접종 1주 후(2주령)와 2주 후(3주령)에 비해 3주 후(4주령)에서 2배 정도의 높은 값을 나타냈다(P<0.05, Fig. 2). Group 1의 chDBP 농도는 무접종 대조군에 비하여 공격접종 1주 후와 2주 후에서 상대적으로 낮은 결과 값을 나타냈으나 통계학적 유의성은 없었고, 4주 후 검사 시 비슷한 수치를 나타냈다. 2주령에 공격접종을 실시한 Group 2와 3주령에 공격접종을 실시한 Group 3에서는 control과 주령별 비슷한 결과 값을 보였다(Table 2).
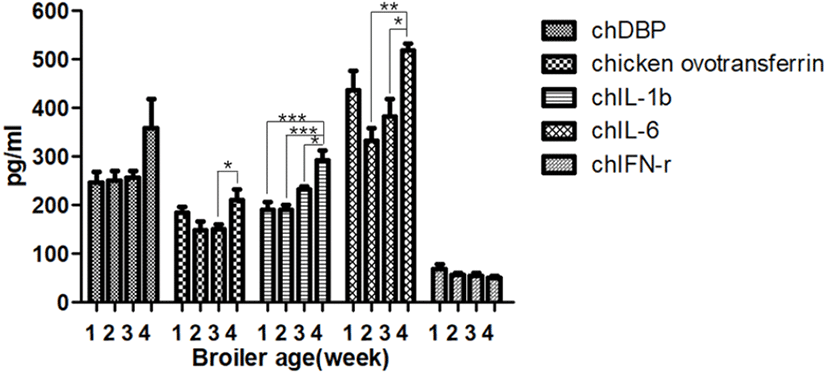
Fig. 1.
Age dependent changes of immunological factors in normal control. *P<0.05, **P<0.01, ***P<0.001.
Download Original Figure
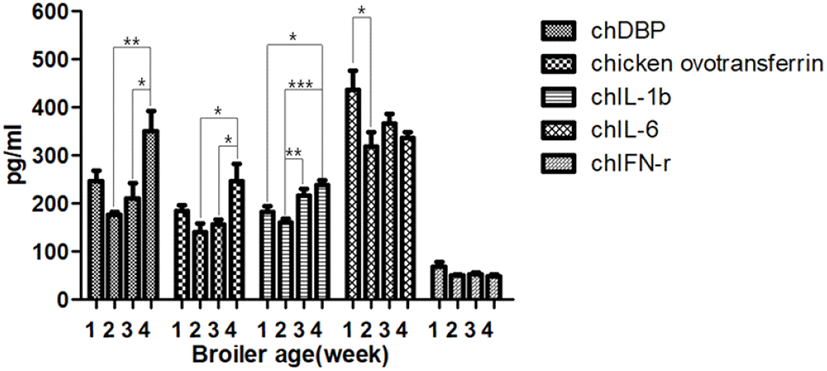
Fig. 2.
Change of immunological factors in chickens challenged at 1 week. The graph values of week 1 were borrowed from the negative control group. *P<0.05, **P<0.01, ***P<0.001.
Download Original Figure
Table 2.
Change of immunological factors in chickens all groups
| factors |
Group |
1 week |
2 weeks |
3 weeks |
4 weeks |
| chDBP |
Control |
248.0±54.2 |
251.6±53.6 |
256.5±38.9 |
358.2±159.1 |
| Group 1 |
nd |
176.1±19.3 |
210.4±88.4 |
350.5±113.8 |
| Group 2 |
nd |
nd |
268.8±57.2 |
328.1±88.2 |
| Group 3 |
nd |
nd |
nd |
319.6±99.6 |
| Chicken ovoferrin |
Control |
185.6±32.5 |
149.4±47.0 |
150.6±28.6 |
211.6±55.3 |
| Group 1 |
nd |
141.6±44.4 |
156.5±30.2 |
246.3±96.3 |
| Group 2 |
nd |
nd |
211.5±26.5 |
270.7±58.2 |
| Group 3 |
nd |
nd |
nd |
231.9±89.4 |
| ChIL-1β |
Control |
183.6±31.9 |
191.8±24.7 |
232.7±15.9 |
292.9±54.7 a |
| Group 1 |
nd |
160.4±23.0 |
217.6±36.7 |
238.2±29.8b |
| Group 2 |
nd |
nd |
222.8±22.9 |
237.6±25.2 b |
| Group 3 |
nd |
nd |
nd |
292.0±25.2 a |
| ChIL-6 |
Control |
436.6±90.5 |
332.6±69.2 |
382.8±90.4 |
518.7±39.6c |
| Group 1 |
nd |
319.3±67.0 |
366.0±53.6 |
336.6±34.7e |
| Group 2 |
nd |
nd |
405.1±62.8 |
338.7±49.0e |
| Group 3 |
nd |
nd |
nd |
435.5±37.0d |
| ChIFN-γ |
Control |
68.8±29.5 |
57.3±9.2 |
55.7±14.3 |
51.9±8.5 |
| Group 1 |
nd |
51.1±4.4 |
52.8±10.7 |
49.7±6.3 |
| Group 2 |
nd |
nd |
60.2±12.6 |
57.9±10.6 |
| Group 3 |
nd |
nd |
nd |
54.5±5.1 |
Download Excel Table
2. H9N2 공격접종 후 Chicken Ovotransferrin 변화 양상
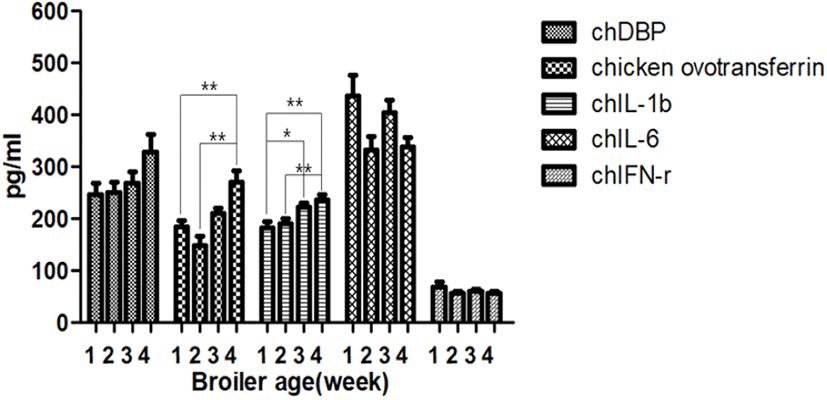
무접종 대조군의 Chicken ovotransferrin의 농도는 2주령에서 1주령보다 감소하다가 4주령에 유의성 있게 증가하는 양상을 보였다(Fig. 1). 1주령에 공격접종을 실시한 Group 1는 4주령에서 공격접종 1주 후와 2주 후에 비해 2배 이상의 높은 값을 나타냈다(P<0.05, Fig. 2). 2주령에 공격접종을 실시한 Group 2은 공격접종 1주 후(3주령)와 비교하여 공격접종 2주 후(4주령)에서 2배 정도 증가하는 양상을 보였다(P<0.05, Fig. 3). Group 2의 Chicken ovotransferrin의 농도는 공격접종 1주 후와 2주 후 검사시 무접종 대조군에 비하여 상대적으로 높은 값을 나타냈으나, 통계학적 유의성은 나타내지 않았다. 반면, 1주령에 공격접종을 실시한 Group 1과 3주령에 공격접종을 실시한 Group 3은 무접종 대조군인 control과 주령별 비슷한 결과값을 보였다(Table 2).
Fig. 3.
Changes of immunological factors in chickens challenged at 2 weeks. The graph values of week 1 and week 2 were borrowed from the negative control group. *P<0.05, **P<0.01, ***P<0.001.
Download Original Figure
3. H9N2 공격접종 후 Chicken Interleukin-1β(chIL-1β) 변화 양상
무접종 대조군의 chIL-1β 의 농도는 3주령까지 유의미한 변화가 관찰되지 않았지만 4주령에 1.5배 정도 증가하는 양상을 보였다(P<0.05, Fig. 1). 1주령에 공격접종을 실시한 Group 1은 공격접종 3주 후에서 2주령과 비교하여 1.5배 증가하였다(P<0.05, Fig. 2). Group 1과 Group 2의 chIL-1β 농도는 무접종 대조군에 비하여 3주령까지 큰 변화를 나타내지 않았으나, 4주령에 25% 정도 낮은 수치를 보였다(P<0.05). 3주령에 공격접종을 실시한 Group 3은 control과 비교하여 주령별 비슷한 결과 값을 보였다(Table 2).
4. H9N2 공격접종 후 Chichen Interleukin-6(chIL-6) 변화 양상
무접종 대조군의 chIL-6의 농도는 2주령까지 감소하다가 다시 4주령까지 유의성 있게 증가하는 양상을 보였다(P<0.05, Fig. 1). 2주령에 공격접종을 실시한 Group 2는 공격접종 1주 후에 비해 공격접종 2주 후에서 감소하였으나, 유의성을 나타내지 못했다(Fig. 3). 1주령에 공격접종을 실시한 Group 1과 2주령에 공격접종을 실시한 Group 2의 농도는 3주령에서 무접종 대조군인 control과 비슷한 수치를 나타냈으나, 4주령에서는 40% 정도 낮은 값을 나타냈다(P<0.05, Table 2). 3주령에 공격접종을 실시한 Group 3은 공격접종 1주 후에서 control에 비해 20% 낮은 값을 나타내었고(P<0.05), Group 1과 Group 2에 비해 1.3배 정도의 높은 값을 보였다(P<0.05, Table 2).
5. H9N2 공격접종 후 Chicken Interferon—γ(chIFN-γ) 변화 양상
무접종 대조군의 chIFN-γ의 농도는 전반적으로 다른 사이토카인의 농도에 비해 낮은 값을 나타냈으며, 닭의 주령이 증가함에 따라 점차 농도가 감소하는 경향을 보였다(Fig. 1). 공격접종 시험군의 chIFN-γ 농도는 무접종 대조군과 차이를 보이지 않았다(Table 2).
고 찰
사이토카인과 단백질은 다양한 종류의 세포로부터 방출되며, 선천면역 또는 감염 후 면역반응에 중요한 역할을 수행하고 있다(Akdis et al., 2011). 본 연구에서는 기존 연구에서 감염 후 주로 변화 양상을 보이는 사이토카인인 ChIL-1β, ChIL-6, ChIFN-γ 세 가지와 ChDBP, Chicken ovotransferrin 혈청 단백질 두 가지에 대해 육계에서의 주령 별 감염 시 변화 양상을 확인하였다.
chDBP 1차적으로 간에서 분비되며, 대식세포 활성화에 관여하는 단백질 전구체로서 혈청에 풍부하다고 알려져 있다(White et al., 2000; Fang et al., 2009). chDBP는 인체에서 인플루엔자 감염 시 탈글리코실화 되어 대식세포의 활성화 능력을 잃게 하여 면역 결핍을 유도한다고 보고되었다(Yamamoto et al., 2005). 본 실험 결과에서도 비교적 어린 1주령에 조류인플루엔자 감염 시 음성대조군에 비하여 이 단백질이 낮은 수치를 나타냈으나, 이후의 주령에 감염될 시에는 특이적인 변화양상이 확인되지 않았으며, 4주령에 이르러서는 모든 그룹이 비슷한 결과 값을 보였다.
Chicken ovotransferrin은 급성 감염 시에 간과 수란관으로부터 분비되는 단백질로서(Sylte et al., 2012) 바이러스뿐만 아니라, 세균과 곰팡이들의 증식을 억제하는 역할을 수행하고 있다(Valenti et al., 2005; Cooper et al., 2019). 본 실험에서는 육계에서 감염 시 무접종 대조군과 실험군간에 차이가 없는 것을 확인할 수 있었다.
조류인플루엔자의 감염 시에 Toll-like receptors(TLRs)에 의해 pro-inflammatory 사이토카인 중 하나인 chIL-1β와 chIL-6의 분비가 활성화되며(Dinarello et al., 1998; Abdul-Cader et al., 2018), 이에 의해 대식세포와 같은 면역능이 활성화되는 것으로 알려져 있다(Nishimichi et al., 2005; Huipao et al., 2017). 두 가지의 사이토카인 모두 1주령과 2주령에 바이러스 감염 시 낮은 분비량을 나타냈으며, 특히 chIL-6의 경우 3주령에 감염된 시험군에서도 음성대조군에 비하여 낮은 결과 값을 나타냈다. 반면, 인플루엔자 감염 시 분비가 활성화되어 세포막에 부착해 다양한 항바이러스 단백질의 분비를 촉진시키는 것으로 연구되어진 chIFN-γ(Schultz et al., 1999; Yeh et al., 1999)의 경우, 감염 주령에 따라 분비량에 큰 차이를 보이지 않는 것으로 확인되었다.
본 실험은 저병원성 조류인플루엔자 발생 상황을 실제 가금농가와 비슷하게 재현하기 위해 실질적으로 사용되는 육계를 이용하였다. 육계는 사육기간이 짧아 사육기간이 긴 산란계보다 경제적인 피해는 크지 않다. 그러나 육계 역시 조류인플루엔자에 임상증상 및 병원성을 나타내며, 주변 산란계 농가에 전파요인이 될 수도 있으므로 발생농가에 대한 파악 및 방역 또한 중요하다. 육계는 대부분 4주령 전후로 출하가 됨으로 본 실험에서는 출하시기 이전에 공격접종을 실시하였으며, 그에 따른 출하시기 이전까지의 면역학적 변화를 관찰하였다.
본 실험 결과를 통해 얻어진 결과는 저병원성 조류인플루엔자가 어린 주령에 감염될수록 면역능 형성에 영향을 미치며 특히 1주령과 2주령에 감염된 경우 일정 기간이 경과했을 때 혈중 사이토카인의 변화가 더 크다는 것을 확인하였다. 본 실험을 통해 chIL-1β와 chIL-6 혈중 농도의 변화는 음성대조군과 비교하여 조류인플루엔자 감염에 따라 감소하는 지표로 확인되었다. 짧은 기간만을 사육하는 육계의 특성상 높은 폐사율이나 뚜렷한 임상증상을 보이지 않는 질병 감염 유무에 대하여 일일이 파악하기는 힘들지만 사육기간이 긴 산란계나 종계에서 chIL-1β와 chIL-6 혈중 농도의 변화는 추후에 심층적인 연구와 실험를 통하여 질병의 경과를 확인할 수 있는 보조적인 감염 지표로 활용될 수 있을 것으로 판단된다.
사 사
본 결과물은 농림축산식품부의 재원으로 농림식품기술기획평가원의 가축질병대응기술개발사업(318047-3, 318041-3)의 지원을 받아 연구되었습니다.
REFERENCES
Abdul-Cader MS, De Silva Senapathi U, Nagy E, Sharif S, Abdul-Careem MF 2018 Antiviral response elicited against avian influenza virus infection following activation of toll‑like receptor (TLR)7 signaling pathway is attributable to interleukin (IL) 1β production. BMC Res Notes 11(1):859.

,

,


Akdis M, Burgler S, Crameri R, Eiwegger T, Fujita H, Gomez E, Klunker S, Meyer N, O'Mahony L, Palomares O, Rhyner C, Ouaked N, Schaffartzik A, Van De Veen W, Zeller S, Zimmermann M Akdis CA 2011 Interleukins, from 1 to 37, and interferon-γ: receptors, functions, and roles in diseases. J Allergy Clin Immunol 127(3):701-21.e1-70.

,


Choi JG, Lee YJ, Kim YJ, Lee EK, Jeong OM, Sung HW, Kim JH, Kwon JH 2008 An inactivated vaccine to control the current H9N2 low pathogenic avian influenza in Korea. J Vet Sci 9(1):67-74.

,

,


Conan A, Goutard FL, Sorn S, Vong S 2012 Biosecurity measures for backyard poultry in developing countries: a systematic review. BMC Vet Res 8:240.

,

,


Cooper CA, Tizard ML, Stanborough T, Moore SC, Chandry PS, Jenkins KA, Wise TG, O'Neil TE, Layton DS, Morris KR, Moore RJ, Fegan N, Doran TJ 2012 Overexpressing ovotransferrin and avianβ-defensin-3 improves antimicrobial capacity of chickens and poultry products. Transgenic Res 28(1):51-76.

,


Dinarello, CA 1998 Interleukin-1, interleukin-1 receptors and interleukin-1 receptor antagonist Int Rev Immunol 16(5-6):457-499.

,


Fang Y, van Meurs JB, Arp P, van Leeuwen JP, Hofman A, Pols HA, Uitterlinden AG 2009 Vitamin D binding protein genotype and osteoporosis. Calcif Tissue Int 85(2):85-93.

,

,


Garber L, Malladi S, Gustafson L, Jones R, Tsao K, Schoenbaum M 2019 Mortality and egg production patterns in the United States Prior to HP/LPAI H7N9 detection. Avian Dis 63(sp1):263-267.

,


Huang XY, Ansari AR, Huang HB, Zhao X, Li NY, Sun ZJ, Peng KM, Zhong J, Liu HZ 2017 Lipopolysaccharide mediates immuno-pathological alterations in young chicken liver through TLR4 signaling. BMC Immunol 18(1):12.

,

,


Huipao N, Borwornpinyo S, Wiboon-Ut S, Campbell CR, Lee IH, Hiranyachattada S, Sukasem C, Thitithanyanont A, Pholpramool C, Cook DI, Dinudom A 2017 P2Y6 receptors are involved in mediating the effect of inactivated avian influenza virus H5N1 on IL-6 & CXCL8 mRNA expression in respiratory epithelium. PLoS One 12(5):e0176974.

,

,


James J, Smith N, Ross C, Iqbal M, Goodbourn S, Digard P, Barclay WS, Shelton H 2019 The cellular localization of avian influenza virus PB1-F2 protein alters the magnitude of IFN2 promoter and NFκB-dependent promoter antagonism in chicken cells. J Gen Virol 100(3):414-430.

,


Lee DH, Park JK, Kwon JH, Yuk SS, Erdene-Ochir TO, Jang YH, Seong BL, Lee JB, Park SY, Choi IS, and Song CS 2013 Efficacy of single dose of a bivalent vaccine containing inactivated newcastle disease virus and reassortant highly pathogenic avian influenza H5N1 virus against lethal HPAI and NDV infection in chickens. PLoS One 8(3):e58186.

,

,


Lee HT, Jung KH, Park JH, Ha GW, Oh YK, Oh JS, Chai YG 2011 Proteomic analysis of the serum from chicken infected by avian influenza. Virus J Bacteriol Virol 41(3) :195-204.


Abdul-Cader MS, Senapathi UDS, Nagy E, Sharif S, Abdul-Careem MF 2018 Antiviral response elicited against avian influenza virus infection following activation of toll-like receptor (TLR)7 signaling pathway is attributable to interleukin (IL)-1β production. BMC Res Notes 11:859.

,

,


Nishimichi N, Aosasa M, Kawashima T, Horiuchi H, Furusawa S, Matsuda H 2005 Biological activity of recombinant chicken interleukin-6 in chicken hybridoma cells. Vet Immunol Immunopathol 106(1-2):97-105.

,


Schultz U, Chisari FV 1999 Recombinant duck interferon gamma inhibits duck hepatitis B virus replication in primary hepatocytes. J Virol 73(4):3162-3168.

,

,


Sylte MJ, Suarez DL 2012 Vaccination and acute phase mediator production in chickens challenged with low pathogenic avian influenza virus; novel markers for vaccine efficacy? Vaccine 30(20):3097-3105.

,


Valenti P, Antonini G 2005 Lactoferrin: an important host defence against microbial and viral attack. Cell Mol Life Sci 62:2576-2587.

,


White P, Cooke N 2000 The multifunctional properties and characteristics of vitamin D-binding protein. Trends Endocrinol Metab 11:320-327.


Xie H, Newberry L, Clark FD, Huff WE, Huff GR, Balog JM, Rath NC 2002 Changes in serum ovotransferrin levels in chickens with experimentally induced inflammation and diseases. Avian Dis 46(1):122-131.


Yamamoto N, Urade M 2005 Pathogenic significance of alpha-N-acetylgalactosaminidase activity found in the hemagglutinin of influenza virus. Microbes Infect 7(4):674-681.

,


Yeh HY, Winslow BJ, Junker DE, Sharma JM 1999
In vitro effects of recombinant chicken interferon-gamma on immune cells. J Interferon Cytokine Res 19(6):687-691.

,