Article
White Leghorn Chick의 초기 성장단계에서 소화기관의 발달, 소장의 소화 효소 및 간 조직의 항산화 방어작용
Post-Hatching Development of Digestive Organs, Intestinal Digestive Enzymes and Hepatic Antioxidant Defense System in White Leghorn Chicks
Min-Jeong Kim1
,
Joo-Hyun Lee2
,
In-Surk Jang3,†
Author Information & Copyright ▼
1Graduate Student, Department of Animal Science & Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
2Student, Department of Animal Science & Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
3Professor, Department of Animal Science & Biotechnology, Gyeongnam National University of Science and Technology, Jinju 52725, Republic of Korea
© Copyright 2021, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Feb 01, 2021; Revised: Feb 19, 2021; Accepted: Mar 11, 2021
Published Online: Mar 31, 2021
적요
본 연구는 White Leghorn에서 부화 후 일령(0-d, 3-d, 7-d, 14-d 및 21-d)에 따른 소화기관의 발달과 기능 및 항산화 방어작용에 대한 변화를 조사하기 위해 실시하였다. 일령에 따른 체중은 부화 후 0, 3 및 7일령까지는 변화가 적었지만, 7일령 이후에는 유의하게(P<0.05) 증가하였다. 체중에 따른 소화 장기의 상대적 무게(g/100 g BW)에서, 간의 상대적 무게는 0일령에서 현저히 낮았지만 3~7일령에 현저히 증가한 후(P<0.05) 21일령까지 유의차 없이 점차 감소하였다. 상대적 췌장 무게 역시 간 무게의 변화와 유사한 경향을 보이며, 7일령에서 최대 발달을 보였지만(P<0.05) 그 이후에는 점차 감소하는 경향을 보였다. 상대적 소장 무게와 길이의 변화는 부화 후 급격히 증가하여 7일령에서 최대 성장을 보이고(P<0.05) 점차 감소하여 21일령 이후에는 현저히 낮아졌다. 소장 점막세포의 무게는 부화 후 현저히 증가하여(P<0.05) 14일령에 최대 발달률을 보였으나 21일령에는 감소하였다(P<0.05). 이당류 분해효소의 특이적 활성도는 0일령에 가장 낮았으나, 3일령에서 유의적으로 높은 최대 활성도 증가를 보였다(P<0.05). Sucrase 활성도는 14일령 이후 유의하게 감소하였으나(P<0.05), maltase는 지속적으로 높은 활성도를 유지하는 것으로 나타났다. Leucine aminopeptiase 특이적 활성도는 0일령부터 높게 나타나 일령에 상관없이 일정하게 유지되는 것으로 나타났다. SOD와 GST 특이적 활성도는 0일령에서 가장 낮았으나, 7일령 이후 유의적으로 높은 활성도를 보였다(P<0.05). GPX 활성도는 0, 7일령과 비교 시 14일령 이후 활성도가 현저하게 증가하였다(P<0.05). 지질 과산화(MDA) 함량은 모든 일령에서 매우 낮게 나타나 일령에 따른 차이가 없었다. 이상의 결과로 보아, White Leghorn 병아리는 부화 후 3~7일령에서 소화 장기 발달과 소화 효소 활성도가 급격히 증가하며, 7일령 이후 체 성장과 간 조직의 대사 작용이 활발해지면서 항산화 효소의 활성도가 함께 증가하는 것으로 나타났다.
ABSTRACT
We aimed to investigate the age-dependent development of digestive organs, intestinal enzymes, and hepatic antioxidant defense system in White Leghorn chicks aged 0, 3, 7, 14, and 21 days. Body weight (BW) did not significantly change between days 0 and 7 but significantly increased (P<0.05) after day 7. The relative liver weight (g/100 g of BW) was significantly lower at day 0 than at the other ages but markedly increased at days 3 and 7 (P<0.05). The relative pancreatic weight changed similar to the change in liver weight, with the maximum development at 7 days (P<0.05). The relative intestinal and mucosal tissue weights increased rapidly after hatching (P<0.05), with the maximum growth at 7 days. Furthermore, maltase and sucrase activities were significantly higher at day 3 than at day 0 (P<0.05). Leucine aminopeptidase activity was high at day 0 and remained constant as age increased. Superoxide dismutase and glutathione S-transferase activities in the liver were the lowest at day 0 but significantly increased after 7 days (P<0.05). Glutathione peroxidase activity increased significantly after day 14 compared with that at days 0 and 7 (P<0.05). Lipid peroxidation was not affected by age. In conclusion, the digestive organ weights and hydrolase activity of chicks increased rapidly during the first 3 or 7 days post-hatching. Hepatic antioxidant enzyme activity increased simultaneously with the increase in digestive organ weights, after 7 days.
Keywords: 화이트 레그혼 병아리; 소화기관; 소화효소; 항산화 효소
Keywords: White Leghorn chicks; digestive organs; digestive enzymes; antioxidant enzymes
서 론
닭은 부화 후 첫 주에 소화기관의 형태와 기능이 대부분 발달됨에 따라 이 시기가 성장을 좌우하는 생애에서 가장 중요하다(Iji et al., 2001a). 부화 후 72시간 동안은 난황에서 영양소를 공급받아 소화기관의 발달에 주로 이용되며(Noy and Sklan, 2001), 그 이후에는 사료를 통해 영양소를 얻는 방법으로 급격히 전환되면서 소화기관에 엄청난 변화를 초래한다. 이 시기에는 병아리의 소화기관 발달이 체중 발달보다 훨씬 빨라, 6~10일령에 급격한 소장의 발달이 이루어진다(Sklan, 2001). 따라서 부화 후 초기 성장단계에서 소화기 발달은 닭의 소화생리작용에 많은 영향을 미쳐 소화기 발달이 우수한 동물에서 생산성이 현저히 증가한다(Lilburn and Loeffler, 2015).
닭에서 소화 효소를 분비하는 소장과 췌장의 발달은 8일령 정도에서 최대로 이루어지며, 그 후 21일령까지 서서히 발달률이 감소되는 것으로 보고되었다(Nitsan et al., 1991a). Lilburn and Leoffler(2015)는 소화기관의 성장 발육과 비슷한 시기에 소화 효소의 분비와 활성이 현저하게 증가한다고 보고하였다. Amylase와 같은 췌장 효소는 부화 후 10일-15일령에 활성도가 최대로 발달하는 것으로 알려져 있다(Nir et al., 1993). 소장 미세융모에 존재하는 maltase와 aminopeptidase의 전체 활성도는 일령에 따라 증가하지만, 특이적 활성도는 1~7일령에서 최대 활성도를 나타내고, 그 후 점차 감소하는 것으로 보고되었다(Iji et al., 2001b). 닭에서 부화 후 소화기관의 발달은 유전, 영양 등과 같은 다양한 요인에 영향을 받으며 조절된다(Lilburn and Loeffler, 2015). Nir et al.(1993)이 산란계와 육계의 소장 발달률과 성장과의 상관관계를 조사한 결과, 두 품종 모두 사료 급여가 소화기관 발달에 큰 영향을 미치는 요인으로 보고하였다. 사료 급여에 따른 품종 간의 증가율 비교 시 육계가 산란계보다 소화 장기 발달이 낮았는데, 이는 대형 품종은 이미 배아 상태에서 소장의 발육이 우수하였기 때문이다(Newcombe and Summers, 1984). 부화 후 닭의 소화기관 발달은 장관에 존재하는 미생물 집단에 의해서도 많은 영향을 받는 것으로 일반 환경에서 성장한 병아리의 소장 융모 면적이 미생물 부재(germ free) 닭에 비해 현저하게 증가한다(Cook and Bird, 1973).
닭의 체 조직에서 대사 작용에 따라 생성되는 활성산소는 세포 수준에서 나타나는 가장 유해한 스트레스 요인으로서 특히 육종에 따른 고도의 생산성을 나타내는 닭에서 산화적 스트레스가 높다(Surai et al., 2019). 따라서 닭에서 면역, 건강 등의 항상성 유지를 위해 세포의 손상을 초래하는 산화물질을 제거하는 항산화 작용은 매우 중요한 신체 방어기전이다(Naito and Yoshikawa, 2011; Circu and Aw, 2012). 활성산소를 제거하는 주요 효소로서 superoxide dismutase(SOD)는 O2–를 H2O2로 전환하는 효소이다(Jaeschke, 1995). 생성된 H2O2는 glutathione peroxidase(GPX)에 의해 H2O로 전환되고, 지질 과산화수소를 무독화 한다(Fantel, 1996). Glutathione S-transferase(GST)는 glutathione 함유 효소로서 독성물질을 수용화해서 배설을 촉진한다(Egaas, et al. 1995). 동물들은 진화과정에서 활성산소를 제거하여 항상성을 유지하는 항산화 시스템이 잘 발달되어 있는데, 나이, 품종, 질병, 영양소 종류 등에 따라 다양한 영향을 받는다(Nijhoff and Peters, 1992; Egaas et al., 1995). 지금까지 진행된 연구들은 조직의 분화발달이 활발하여 산소 요구량이 높은 배아발생 시기의 항산화 방어작용에 관해 주로 진행되어 왔다(Surai, 1999; Yigit et al., 2014; Yang et al., 2018). 그러나 부화 후 성장이 왕성한 초기 성장기(1~21일령)의 항산화 방어작용에 관한 연구는 매우 드문 실정이다. 항산화 방어작용은 모든 장기에서 일어나지만, 간, 심장조직에서 가장 활발하게 이루어져 항상성 유지에 중요한 역할을 한다(Surai, 1999; Tang et al., 2019).
닭에서 부화 후 개체발생적으로 발현되는 소화기 발달 및 항산화 방어작용에 관한 조사는 각종 스트레스에 대응하여 최적의 사양관리 시스템을 구축하여 건강한 병아리를 사육하는데 필요한 기초 생리적 자료이다. 따라서 본 연구는 White Leghorn에서 부화 후 소화기관 발달 및 항산화 방어작용에 관한 발현 양상을 구명하기 위해 0, 3, 7, 14 및 21일령의 병아리에서 소화기관의 형태 변화, 소장의 소화 효소 및 간 조직의 항산화 효소 활성도를 조사하였다.
재료 및 방법
1. 실험동물 및 사양관리
White Leghorn 종계로부터 부화 후 0, 3, 7, 14 및 21일령의 병아리 30수(n=6, 암수 각각 3수)를 실험동물로서 공시하였다. 사양관리 방법으로서 부화 직후 케이지에서 1일 동안 음수만 공급하고, 2일째부터 초생추 사료를 소량 급여하고, 자동급수기로 음수를 급여하였다. 시험사료는 대사에너지 2,890 Mcal/kg, 조단백질 19.14%, lysine 1.06%가 함유된 초생추용(상업용 가루 형태)을 사용하였다. 계사 온도는 33°C에서 22°C까지 계사 사육실 온도관리 프로그램에 따라 조절하였다. 기타 사양관리는 경남과학기술대학교 동물사육장의 사양관리 방법에 따라 실시되었다. 본 연구는 대학의 동물실험윤리위원회의 승인(2020-07)을 받고 규정에 준수하여 동물실험을 시행하였다.
2. 분석 방법
1) 조직 샘플링
부화 후 0, 3, 7, 14 및 21일령으로서 모두 케이지에서 사육하였으며, 각 일령에 해당하는 동물은 정확하게 3시간 절식하고 체중을 측정하였다. 이어서 에테르 마취와 경정맥 절개 후 안락사시키고, 소장, 췌장 및 간을 채취하여 무게를 측정하였다. 소장은 위 유문부 아래부터 결장 앞까지 소장 전체 부위를 채취하였다. 소장 전 부분의 장간막 지방을 제거하고, 생리식염수로 3회 연속으로 세척한 후 내용물을 제거하였다. 소장 전 부위를 절개한 후 glass slide을 이용하여 점막 세포를 분리하였다. 일정량의 생리식염수를 혼합하여 5,000rpm에서 원심분리(Vision, VS-15,000 CF) 후 점막세포를 세척하고 무게를 측정하였다. 간, 소장점막 조직 등 분석용 샘플은 −70°C에 냉동 보관하였다.
2) 소장점막 조직의 특이적 효소활성도 분석
소장 전체 부위에서 채취한 점막조직을 잘 혼합한 후 mannitol buffer(150 mM mannitol, 10 mM tris base, 30 mM succinate, 5 mM K2HPO4; pH 7.4)를 적정 비율로 혼합하여 균질화(Omni tissue homogenizer, Omni Int. NW USA)하였다. 점막조직에 존재하는 효소를 분리하기 위해 2% triton X-100을 1:1 비율로 혼합한 샘플을 1시간(25oC) 저장한 후 5,000 rpm(4oC)에서 원심분리하여 상청액을 효소 활성도 분석에 사용하였다. 이당류분해 효소인 maltase와 sucrase는 Dahlgvist(1968)의 방법을 ELISA reader(VMax, Molecular Devices, CA, USA)에 변형한 방법으로 최종 분해산물(glucose)은 Sigma glucose assay kit로 분석하였다. Leucine aminopeptidase(LAP) 활성도는 Gal-Garber and Uni(2000)의 방법으로 leucine p-nitroaniline를 기질로 사용하여 ELISA reader(405 nm)로 측정하였다. 단백질 분석은 BCA 방법(Pierce BCA protein, Assay Kit 23225)으로 ELISA reader(570 nm)로서 분석하였다. 효소의 특이적 활성도(specific activity)는 전체 활성도에서 단백질 mg당 농도로 나누어 표시하였다.
3) 간 조직에서 항산화 효소활성도 및 지질 과산화 분석
간 조직의 cytosol과 microsome 분획은 Kupfer and Levin(1972)의 방법에 따라 수행하였다. 간단히 기술하면 간 조직 1 g 당 5 mL의 0.25 M sucrose 용액(0.25 M, sucrose, 0.005 M MgCl2, 0.025 M KCl 및 0.008 M CaCl2 pH 7.4)을 혼합하여 균질기로서 균질화하였다. 상층액을 완충용액 (0.0 125 M sucrose, 0.005 M MgCl2 및 0.008 M CaCl2)으로 희석한 다음 10,000 g에서 15분간 원심 분리하였다. 분리된 상청액을 cytosol, 펠렛을 1 mL의 1.15% KCl 용액에 균질화하여 microsome으로 분획하여 −70°C에 보관하였다. Superoxide dismutase(SOD) 활성도는 Sigma assay kit(No. 19160, Sigma-Aldrich, St. Louis, MO, USA)로 측정하였다. 효소 측정 방법은 xanthine oxidase를 혼합한 시료를 첨가한 후 반응을 시작하여 ELISA reader(450 nm)에서 흡광도를 측정하였다. 그 외 상세한 방법은 kit에 제시한 방법에 따라 분석하였다. 단위 값은 SOD 활성도를 50% 저해하는 값을 1 unit로 정의하였다. Glutathione peroxidase(GPX) 활성도는 Tappel(1978)의 방법으로 시료에 반응용액(0.1 mM NADPH, glutathione reductase 1 unit/mL, reduced glutathione, 0.25 mM; pH 7.4)을 가한 후 5분간 37°C incubator에서 배양시킨 다음 H2O2를 가하여 분광광도계(340 nm)에서 흡광도의 감소 속도를 조사하였다. GPX 활성도의 unit는 단백질 mg당 1분 동안 산화되는 NADPH nmol 수로 정의하였다. Glutathione S-transferase(GST)는 1 mM reduced glutathione을 chlorodinitrobenzene(CDNB) 혼합물에 희석한 시료를 가한 후 340 nm에서 흡광도가 변화되는 비율을 측정하였으며, 1 unit는 mg protein당 1분간 반응하는 CDNB의 μmol 수로 표시하였다(Habig et al. 1974). Microsome의 지질과산화물은 thiobarbituric acid 방법에 의해 생성된 malondialdehyde(MDA)량을 532 nm에서 분광광도계로서 흡광도를 측정하여 조사하였다(Bidlack and Tappel, 1973). 효소의 특이적 활성도(specific activity)는 전체 활성도에서 단백질 mg당 농도로 나누어 표시하였다.
3. 통계
닭의 일령이 체중, 소화장기 무게 및 각종 효소활성도에 미치는 영향은 SAS program(SAS, 1996)을 이용하여 General Linear Model(GLM) Procedure에 따라 유의성을 검정하였다. 유의차가 인정될 때 Tukey 방법에 의한 다중검정(95%)을 실시하여 일령의 변화에 따른 유의성 분석을 수행하였다.
결과 및 고찰
1. 체중 및 소화기관의 형태적 변화
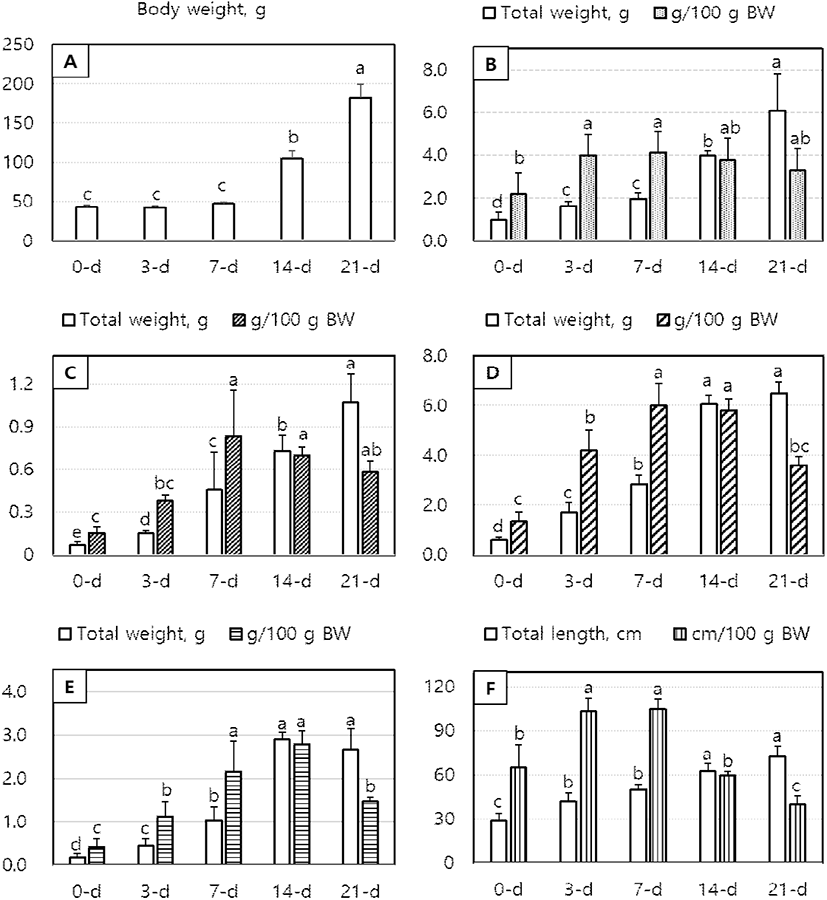
White Leghorn 병아리의 일령에 따른 체중의 변화를 살펴보면(Fig. 1A), 부화 후 0, 3 및 7일령까지 체중의 변화가 적었지만 7일령 이후 현저하게 증가하였다(P<0.05). 각종 소화 장기의 총 무게(total weight, g)와 체중에 따른 상대적 무게(g/100 g BW)는 Fig. 1(B, C, D, E 및 F)에 나타낸 바와 같다. 먼저 일령의 변화에 따른 간의 총 중량은 0일령에 비하여 3일령과 7일령에 유의하게 증가하였다(P<0.05). 체중에 따른 간의 상대적 무게는 0일령에서 현저히 낮았지만 3~7일령에 급격히 증가한 후(P<0.05) 21일령까지 유의차 없이 점차 감소하는 경향을 보였다(Fig. 1 B). 췌장의 총 무게는 0일령부터 3, 7, 14 및 21일령까지 각 일령별로 현저히 증가하였다(P<0.05). 상대적 췌장 무게 역시 간 무게의 변화와 유사한 경향을 보이며, 7일령에서 최대 발달율을 보였고(P<0.05), 그 이후 점차 감소하는 경향을 보였다(Fig. 1 C). 전체 소장 무게와 점막세포 무게는 부화 후 14일령까지 직선적으로 현저히 증가하였고, 체중 대비 상대적 무게는 7~14일령까지 증가한 후 21일령에서 유의하게 감소하였다(P<0.05, Fig. 1 D, E). 소장의 길이의 변화를 보면, 전체 길이는 3 및 14일령에서 급격히 증가하고, 상대적 길이는 3~7일령에서 최대로 발달되는 것으로 나타났다(P<0.05, Fig. 1 F).
Fig. 1.
Age-dependent changes in body weight (A) and the weights of total and relative (g/100 g BW) digestive organs (B: Liver, C: pancreas, D: intestine and E: intestinal mucosal tissues, and F: intestinal length) in White Leghorn chicks aged 0-d, 3-d, 7-d, 14-d and 21-d after hatching. a~e Values with different superscripts differ significantly (P<0.05) among ages (Mean±SD, n=6).
Download Original Figure
간은 영양소 대사 및 이물질 해독작용에 중요한 역할을 하는 부소화기관으로서 특히 닭에서는 지방 합성의 중추적 역할을 담당한다(Richard, 2005; D’Andre et al., 2013). 본 연구에서 조사한 체중 대비 간의 상대적 중량은 0일령에 비하여 3일령과 7일령에 유의하게 높은 발달율을 보였다. 이러한 결과는 여러 닭의 품종에서 간의 발달율을 조사한 결과와도 유사한데 대부분 품종에서 3~9일령에서 가장 높은 상대적 간의 무게 증가가 나타난다고 하였다(Nitsan et al., 1991a, 1991b).
췌장은 탄수화물, 단백질 및 지질의 소화 효소를 분비하는 곳으로 부화 후 4일령까지는 조직의 발달이 낮았으나, 7일령 이후 급격하게 발달한다고 보고되었다(Uni et al., 1995). White Leghorn에서도 체중에 따른 췌장의 상대적 발달도 10일령 전후에서 가장 높았고, 그 이후 점차 감소하는 것으로 보고되었다(Oakberg, 1949). 췌장의 무게 발달과 함께 amylase와 trypsin 등 췌장 효소도 부화 후 10~15일령에 활성도가 최대로 증가하는 것으로 알려져 있다(Nir et al., 1993). 본 연구에서도 췌장의 상대적 무게는 3일령 이후 급속히 발달하여 7일령에서 정점을 이룬 후 서서히 감소하며, 전체 무게는 21일령까지도 지속해서 증가하였다.
닭은 부화 후 소화기관의 발육과 기능이 엄청난 속도로 발달되는데, 특히 소장의 발달이 가장 왕성하다(Nitsan et al., 1991a). 소장은 성장에 필요한 영양소를 소화 흡수하는 곳으로 부화 직후 난황으로부터 영양소를 공급받지만 3일령 이후에는 사료로부터 영양소를 흡수함으로 급격하게 발달한다(Jin et al., 1998; Sklan, 2001). 소장의 발달은 유전에 따라 자연발생적으로 빠르게 발달하지만, 섭취하는 영양소에 따라 발달 정도가 영향을 받는 것으로 알려져 있다(Sklan, 2001). 본 연구 결과에서도 일령의 변화에 따라 급격하게 소장 무게, 길이 및 점막세포의 발달이 진행되는 것으로 나타났는데, 특히 7일령에서 상대적 발달이 가장 높았고, 21일령 이후에는 그 정도가 낮았다. 이러한 결과는 Iji et al.(2001a)이 육계에서 소장의 상대적 성장 발달율이 7일령에서 가장 높았음을 보고하여 본 연구와 일치하였다. Ross와 Steggles 교잡종에서도 체중에 따른 상대적 소장의 무게와 점막 단백질의 발달이 7일령에서 가장 높은 비율을 보여, 이 시기에 닭의 소장 발달에 가장 중요한 시기인 것으로 나타났다(Iji et al., 2001a).
2. 소장 점막세포의 소화 효소 특이적 활성도 변화
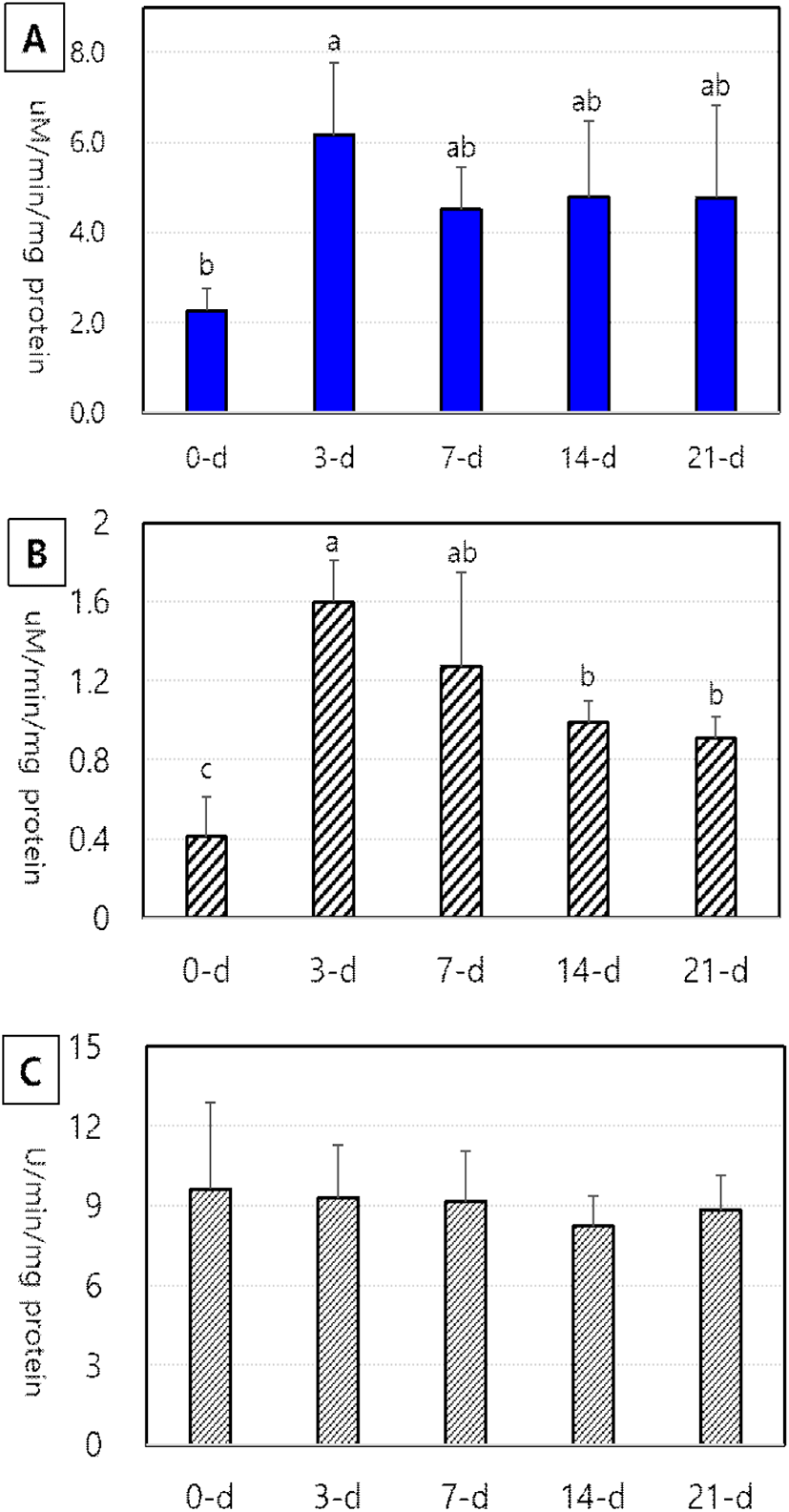
White Leghorn 병아리 부화 후 일령에 따른 소장 점막상피세포에 존재하는 maltase, sucrase 및 leucine aminopeptiase의 특이적 활성도 변화는 Fig. 2(A, B 및 C)에 나타낸 바와 같다. 이당류 분해효소인 maltase와 sucrase 특이적 활성도는 모두 0일령에 가장 낮았으나, 3일령에서 유의적으로 높은 최대 활성도를 보였다(P<0.05). 이당류 분해효소들의 활성도는 3일령 이후 21일령까지 점차 감소하는 경향을 보였으나, 비교적 높은 수준을 유지하는 것으로 나타났다(Fig. 2 A 및 B). 특히 sucrase 활성도는 3일령에서 최대를 보인 후 점차 감소하여 14일령 이후에는 유의하게 감소하였다(P<0.05). 한편, leucine aminopeptiase 특이적 활성도는 0일령부터 높게 나타나 일령이 증가함에 따라 일정하게 유지되는 것으로 나타났다(Fig. 2 C). 한편, 동량의 단백질로 표현되는 특이적 활성도는 일령에 따라 뚜렷한 차이를 보였으나, 소장 점막세포의 양이 일령에 따라 현저하게 증가함으로 소장 흡수세포에서 전체 이당류 효소의 총량은 일령이 증가함에 따라 증가된다.
Fig. 2.
Age-dependent changes in the specific activity of digestive enzymes (A: maltase, B: sucrase and C: leucine aminopeptidase) in the small intestine of White Leghorn chicks aged 0-d, 3-d, 7-d, 14-d and 21-d after hatching. a~c Values with different superscripts differ significantly (P<0.05) among ages (Mean±SD, n=6).
Download Original Figure
3일령의 병아리에서 이당류 분해효소의 특이적 활성도가 최대로 증가한다는 본 연구의 결과는 부화 후 2일령에서 최대 maltase와 sucrase 활성도를 보인 후 점차 12일령까지 일정한 수준을 유지한다고 보고한 Uni et al.(1995)의 연구 결과와 비슷하였다. 이러한 결과는 육계와 산란계 병아리에서 부화 후 3일령에서 소장 포도당 운반단백질(SGLU1) mRNA 발현이 최대로 증가하였다는 연구(Li et al., 2020)로 보아 최대 효소활성도가 발현되는 시기와 정확하게 일치하였다. 그러나 Sell et al.(1991)은 부화 후 1일령에서 최대 maltase 활성도를 나타내지만, 그 이후 6일령까지 감소한 후 다시 8일령에서 증가한다고 하여 본 결과와는 다소 차이가 있다. Angel et al.(1990)은 maltase 활성도는 부화 1일령에서 최대 활성도를 보인 후 9일령까지 감소한 후 다시 44일령까지 증가한다고 보고하였다. 소장에 존재하는 이당류 분해효소들은 융모 세포의 구성 성분으로 탄수화물의 소화작용과 밀접한 연관이 있는데, 고수준의 탄수화물 사료를 섭취하는 닭에서 maltase와 sucrase의 특이적 활성도는 증가하였다(Sell et al., 1989). Aminopeptidase 역시 소장 점막세포에 존재하는 단백질 분해효소로서 상대적으로 부화직후 발현도가 매우 높은 것으로 보고된바(Tarvid, 1992) 본 연구에서도 이와 유사한 결과를 보였다. Iji et al.(2001b)도 부화 후 1일령 육계 병아리에서 aminopeptiasde 활성도가 매우 높게 발현되어 오히려 21일령 병아리의 활성도보다 높았다고 보고하였다. 이와 같이 소장에 존재하는 각종 소화 효소의 특이적 활성도는 일령에 따라 증감이 나타나는 변화를 보였으나, 실제 닭에서 일령이 증가할수록 소장 무게와 점막세포량이 증가하기 때문에 소화 효소의 전체 활성도는 현저히 증가한다(Tarvid, 1995; Jin et al., 1998; Sklan, 2001; Lilburn and Loeffler, 2015). 소화 효소의 활성도와 체중의 변화는 고도의 상관관계가 있어 영양소의 소화율이 증가할수록 증체율이 높아진다.
이상의 결과로 보아 병아리는 부화 후 3~7일령에서 소화기관의 발육과 소화효소의 발현이 급격히 진행되고, 이러한 결과 14일령에서 현저한 체중의 증가로 나타났다고 생각된다. 병아리 초기 성장기 동안 사료를 급여하는 시기, 사료의 영양소 성분 등 다양한 사양관리 요인이 소화 효소 활성도의 발현 차이를 유발한다. 또한 초기 성장기 소화 효소 발현은 자연 발생학적 유전적 요인으로 부화 중(10일째)에 이미 다양한 소화 효소들과 영양소 운반단백질이 배아 상태에서 발현되는 것으로도 보고되었다(Matusushita et al., 1985; Speier et al., 2012).
3. 간 조직의 항산화 효소의 특이적 활성도 변화
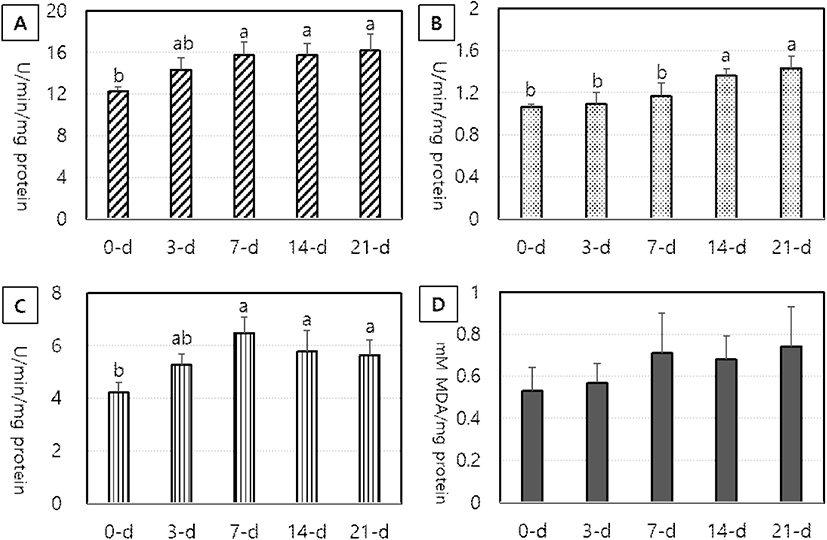
White Leghorn에서 부화 후 일령의 증가에 따른 간 조직의 항산화 효소 활성도와 지질과산화도 변화는 Fig. 3(A, B, C 및 D)에 나타낸 바와 같다. SOD 특이적 활성도는 0일령에서 가장 낮았으나, 7일령 이후 유의적으로 높은 활성도를 나타내었다(P<0.05, Fig. 3 A). GPX 활성도는 0~7일령까지 비교적 낮은 수준을 유지하였으나, 14일령 이후 활성도가 현저하게 증가하였다(P<0.05, Fig. 3 B). GST 활성도는 0일령에서 가장 낮았으나, 7일령 이후 21일령까지 유의하게 증가하는 것으로 관찰되었다(P<0.05, Fig. 3 C). 한편, 지질 과산화(MDA) 함량은 모든 일령에서 변화없이 매우 낮은 수준으로 유지되는 것으로 관찰되었다(Fig. 3 D).
Fig. 3.
Age-dependent changes in the specific activity of antioxidant enzymes (A: SOD, B: GPX and C: GST) and lipid peroxidation (D: MDA) in the liver of White Leghorn chicks aged 0-d, 3-d, 7-d, 14-d and 21-d after hatching. a,b Values with different superscripts differ significantly (P<0.05) among ages (Mean±SD, n=6).
Download Original Figure
닭은 부화 전후 급격한 성장에 따른 대사 작용으로 발생하는 활성산소에 의해 엄청난 산화적 스트레스를 받게 된다(Yang et al., 2018; Surai et al., 2019). 따라서 대사 과정에서 필연적으로 발생하는 산화 스트레스에 대응하기 위해 닭에서는 항산화 방어작용이 진화적으로 잘 발달되어 있다(Circu and Aw, 2012). 그러나 부화 후 체 조직의 발육이 왕성한 초기 성장기(1~21일령)의 병아리에서 항산화 방어체계에 관한 연구는 매우 미진한 실정이다. 닭은 부화 전후 항산화 방어 효소가 모든 장기 조직에서 존재하지만, 간, 심장 및 신장에서 가장 활발하게 발현되며, 항상성 유지작용에 중요한 역할을 한다(Surai et al., 1999). 그러나 최근 지나친 생산성 위주의 육종에 따라 닭의 체 조직에서는 과도한 산화적 스트레스가 발생하고 있다(Surai et al., 2019). Tang et al.(2019)은 1, 3, 7, 11, 14, 21, 35 및 42일령의 육계에서 항산화 효소의 특이적 활성도를 조사한 결과, 소장과 간 조직에서 SOD 활성도는 일령에 따른 차이가 없었고, GPX 활성도는 3일령에서 현저히 증가한 후 7일령부터는 다시 감소하는 것으로 보고하였다. 부화 후 병아리는 대부분의 장기가 급격하게 발달하는 과정에서 활성산소를 다량 생산하기 때문에 높은 수준의 SOD와 GPX 활성도를 유지하며, 특히 간 조직에서 다른 조직들에 비해 월등히 높은 GPX 활성도를 유지한다(Tang et al., 2019). 2주령, 4주령 및 6주령 육계의 심장에서 항산화 시스템 지표를 조사한 결과, GPX 활성도는 4주령에서 SOD와 지질과산화도는 6주령에서 유의하게 증가하였음을 보고하였다(Milinkovic-Tur et al., 2009). 본 연구에서 SOD, GPX 및 GST 활성도는 부화 후 0일령부터 비교적 높게 유지되지만 7~14일령부터 현저히 증가하였다. 이러한 결과는 병아리가 7일령 이후 급격한 체 성장이 이루어지면서 간 조직의 대사 작용으로 발생되는 다량의 유해산소기를 제거하기 위해 항산화 방어작용이 활성화되는 것으로 해석할 수 있다.
사 사
본 연구는 경남과학기술대학교 대학회계 연구비 지원(2020~2021년)에 의해 연구가 수행되었습니다. 연구수행 과정에서 본 대학 동물생명산업센터(RAIC) 분석 장비 사용에 감사드립니다.
REFERENCES
Angel CR, Sell JL, Trampel DW 1990 Stunting syndrome in turkeys: physical and physiological changes. Poult Sci 69(11):1931-1942.


Bidlack WR, Tappel AL 1973 Damage to microsomal membrane by lipid peroxidation. Lipid 8(4):177-182.


Circu ML, Aw TY 2012 Intestinal redox biology and oxidative stress. Semin Cell Dev Biol 23(7):729-737.


Cook RH, Bird FH 1973 Duodenal villus area and epithelial cellular migration in conventional and germ-free chicks. Poult Sci 52(6):2276-2280.


Dahlgvist A 1968 Assay of the intestinal disaccharidase. Anal Biochem 22(1):99-107.

D'Andre HC, Paul W, Shen X, Jia X, Zhang R, Sun L, Zhang X 2013 Identification and characterization of genes that control fat deposition in chickens. J Anim Sci Biotechnol 4(1):43-59.


Egaas E, Falls JG, Svendsen NO, Ramstad H, Skaare JU, Dauterman WC 1995 Strain-and sex-specific differences in the glutathione S-transferase class pi in the mouse examined by gradient elution of the glutathione-affinity matrix and reverse-phase high performance liquid chromatography. Biochim Biophys Acta 1243(2):256-264.


Fantel AG 1996 Reactive oxygen species in developmental toxicity: review and hypothesis. Teratology 53(3):196-217.


Gal-Garber O, Uni Z 2000 Chicken intestinal aminopeptidase: partial sequence of the gene, expression and activity. Poult Sci 79(1):41-45.


Habig WH, Pabst MJ, Jakoby WB 1974 Glutathionine S transferase: the first enzymatic steps in mercapturic acid formation. J Biol Chem 249(22):7130-7139.


Iji PA, Saki A, Tivey DR 2001a Body and intestinal growth of broiler chicks on a commercial starter diet. 1. Intestinal weight and mucosal development. Br Poult Sci 42(4):505-513.


Iji PA, Saki A, Tivey DR 2001b Body and intestinal growth of broiler chicks on a commercial starter diet. 2. Development and characteristics of intestinal enzymes. Br Poult Sci 42(4):514-522.


Jaeschke H. 1995 Mechanisms of oxidant stress-induced acute tissue injury. Proc Soc Exp Biol Med 209(2):104-111.


Jin S, Corless A, Sell JL 1998 Digestive system development in post-hatch poultry. World's Poult Sci J 54(4):335-345.


Kupfer D, Levin E 1972 Monooxygenase drug metabolizing activity in CaCl
2-aggregated hepatic microsomes from rat liver. Biochem Biophys Res Commun 47(3):611-618.


Li H, Cheng J, Yuan Y, Luo R, Zhu Z 2020 Age-related intestinal monosaccharides transporters expression and villus surface area increase in broiler and layer chickens. J Anim Physiol Anim Nutr(Berl) 104(1):144-155.


Lilburn MS, Loeffler S 2015 Early intestinal growth and development in poultry. Poult Sci 94(7):1569-1576.


Matsushita S 1985 Development of sucrase in the chick small intestine. J Exp Zool 233(3):377-383.


Milinkovic-Tur S, Aladrovi J, Ljubic B, Poljicak-Milas N 2009 Age-related antioxidant enzyme activities and lipid peroxidation in heart muscles of broiler chickens fed with supplementary organic selenium. Veterinarski Arhiv 79(5): 481-489.

Naito Y, Yoshikawa T 2011 Neutrophil-dependent oxidative stress in inflammatory gastrointestinal diseases. Pages 35-54 In: Free Radical Biology in Digestive Diseases. Front Gastrointest Res(Basel) Karger, Switzerland.

Newcombe M, Summers JD 1984 Effect of previous diet on feed intake and body weight gain of broiler and Leghorn chicks. Poult Sci 63(6):1237-1242.


Nijhoff WA, Peters WH 1992 Induction of rat hepatic and intestinal glutathione S-transferases by dietary butylated hydroxyanisole. Biochem Pharmacol 44(3):596-600.


Nir I, Nitsan Z, Mahagna M 1993 Comparative growth and development of the digestive organs and of some enzymes in broiler and egg type chicks after hatching. Br Poult Sci 34(3):523-532.


Nitsan Z, Ben-Avraham G, Zoref Z, Nir I 1991a. Growth and development of the digestive organs and some enzymes in broiler chicks after hatching. Br Poult Sci 32(3):515-523.


Nitsan Z, Dunnington EA, Siegel PB 1991b Organ growth and digestive enzyme levels to fifteen days of age in lines of chickens differing in body weight. Poult Sci 70(10): 2040-2048.


Noy Y, Sklan D 2001 Yolk and exogenous feed utilization in the post-hatch chick. Poult Sci 80(10):1490-1495.


Oakberg EF 1949 Quantitative studies of pancreas and islands of Langerhans in relation to age, sex, and body weight in White Leghorn chickens. Am J Anatomy 84(2):279-310.


Richard J 2005 Production and growth related disorders and other metabolic diseases of poultry. A review. Vet J 169(3):350-369.


SAS 1996 User's Guide: Statistics Version 6.12 Ed. SAS Inst., Inc., Cary, NC.

Sell JL, Angel CR, Piquer FJ, Mallarino EG, al-Batshan HA 1991 Developmental patterns of selected characteristics of the gastrointestinal tract of young turkeys. Poult Sci 70(5):1200-1205.


Sell JL, Koldovsky O, Reid BL 1989 Intestinal disaccharidases of young turkeys: temporal development and influence of diet composition. Poult Sci 68(2):265-277.


Sklan D 2001 Development of the digestive tract of poultry. World's Poult Sci J 57(4):415-427.


Speier JS, Yadgary L, Uni Z, Wong EA 2012 Gene expression of nutrient transporters and digestive enzymes in the yolk sac membrane and small intestine of the developing embryonic chick. Poult Sci 91(8):1941-1949.


Surai PF. 1999 Tissue-specific changes in the activities of antioxidant enzymes during the development of the chicken embryo. Br Poult Sci 40(3):397-405.


Surai PF, Kochish II, Fisinin VI, Kidd MT 2019 Antioxidant defense systems and oxidative stress in poultry biology: an update. Antioxidants(Basel) 8(7):235-271.


Surai PF, Speake BK, Noble RC, Sparks NH 1999 Tissue-specific antioxidant profiles and susceptibility to lipid peroxidation of the newly hatched chick. Biol Trace Elem Res 68(1):63-78.


Tang D, Wu J, Jiao H, Wang X, Zhao J, Lin H 2019 The development of antioxidant system in the intestinal tract of broiler chickens. Poult Sci 98(2):664-678.


Tappel AL 1978 Glutathione peroxidase and hydroperoxides. Methods in Enzymol 52:506-513.


Tarvid I. 1992 Effect of early postnatal long-term fasting on the development of peptide hydrolysis in chicks. Comp Biochem Physiol A Comp Physiol 101(1):161-166.


Tarvid IL 1995 The development of protein digestion in poultry. Poult and Avian Biol Rev 6:35-54.

Uni Z, Noy Y, Sklan D 1995 Post-hatch changes in morphology and function of the small intestines in heavy-and light-strain chicks. Poult Sci 74(10):1622-1629.


Yang S, Wang LL, Shi Z, Ou X, Wang W, Chen X, Liu G 2018 Transcriptional profiling of liver tissues in chicken embryo at day 16 and 20 using RNA sequencing reveals differential antioxidant enzyme activity. PLoS One 13(2):e0192253.


Yigit A, Panda A, Cherian G 2014 The avian embryo and its antioxidant defense system. World's Poult Sci 70(3):563-570.