Article
닭 신선 정자 운동성과 첨체안정성에 보존 온도, 희석제 및 용기가 미치는 영향
김성우1,†
,
이재영1
,
김찬란1
,
고응규2
,
이성수2
Effects of Temperature, Diluents, and Plastic Tubes on the Motility and Acrosome Intactness of Fresh Rooster Semen
Sung Woo Kim1,†
,
Jae-Yeong Lee1
,
Chan-Lan Kim1
,
Yeoung-Gyu Ko2
,
Sung Soo Lee2
Author Information & Copyright ▼
1농촌진흥청 국립축산과학원 가축유전자원센터 연구사
2농촌진흥청 국립축산과학원 가축유전자원센터 연구관
1Researcher, Rural Development Administration, Animal Genetic Resources Research Center, National Institute of Animal Science, Hamyang 50000, Republic of Korea
2Senior Researcher, Rural Development Administration, Animal Genetic Resources Research Center, National Institute of Animal Science, Hamyang 50000, Republic of Korea
© Copyright 2021, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 25, 2021; Revised: Nov 17, 2021; Accepted: Nov 22, 2021
Published Online: Dec 31, 2021
적요
닭 정자는 저온 환경에서 생존하는 능력을 보유하고 있으나 정자의 운동성과 첨체 손상에 대한 연구는 상세히 알려져 있지 않다고 판단된다. 본 연구에서는 닭 정자를 BPSE 및 Lake 희석액으로 희석하고 보존 용기를 1.5 mL e-tube와 0.5 mL 스트로에 보존하여 정자 장수성을 조사하였다. 밀봉된 0.5 mL 스트로에 보존된 정자의 운동성이 3일동안 저온 보존 시 더 높은 것으로 관찰되었다(68.6±3.1% vs. 22.1±5.7%). BPSE로 희석하여 0.5 mL 스트로에 보존된 닭 정자의 운동성 또한 Lake 희석액보다 더 높게 관찰되었다(57.7±5.6% vs. 37.7±5.4%). 첨체 온전성도 0.5 mL 스트로에 보존하는 것이 우수하였고 냉장보존일이 증가함에 따라 손상된 첨체 비율이 증가하였다. 본 연구에서 0.5 mL에 밀봉된 닭 정자는 저온 보존에 이용될 수 있으며 정자의 운동성을 높여주며 첨체 온전성을 증가시키는 것으로 관찰되었다.
ABSTRACT
Chicken spermatozoa have the ability to survive in low-temperature environments; however, the effects of low temperature on sperm motility and acrosome damage have not been studied in detail. The present study investigated semen longevity following dilution of rooster semen with Beltsville Poultry Semen Extender (BPSE) and Lake extender in preservation vessels (1.5 mL e-tube and 0.5 mL straw). Spermatozoa motility in the closed-type vessel (0.5 mL straw) was higher than that in the 1.5 mL e-tube on day 3 of preservation (68.6±3.1% vs. 22.1±5.7%). The motility of rooster semen diluted with BPSE in 0.5 mL straw was also higher than that of the Lake extender on day 3 of preservation (57.7±5.6% vs. 37.7±5.4%). Furthermore, acrosome intactness was higher in 0.5 mL straw than in the 1.5 mL e-tube, and the rate of acrosome cap damage increased with preservation days. The present study demonstrates that a closed 0.5-mL straw vessel could be used for low-temperature semen preservation, with an increased motility rate and acrosome integrity in fresh rooster semen.
Keywords: 닭 정액; 저온 저장; 운동성; 첨체 손상
Keywords: rooster semen; low temperature preservation; motility; acrosome damage
서 론
가금 종축은 해마다 수입되고 있으며, 종계를 보유한 농가에서는 종축의 유지 및 관리에 많은 노력을 기울이고 있다. 닭 정액을 저온에서 저장하는 방법은 수컷 종계를 이용하는 방법으로 중요하지만 소, 돼지 및 개와 같은 포유류에 비하여 연구 결과가 부족하다고 판단된다. 특히 가금의 정액은 포유류와 달리 저온에 대한 저항성이 높고 정자는 운동성을 유지하고 있다. 그러나 소, 돼지 및 개 희석정액은 장기 냉장 보존에서 수정 능력을 유지하지만, 닭은 쉽게 잃어 버리는 특성이 있다(Clark et al., 1982) 닭 정액의 성상 검사는 종축으로서 활용도를 생각할 때 매우 중요하나 닭 정액에 대한 연구 자료는 미진한 편이다. 또한, 닭은 동결 보존 연구의 대상으로 가장 먼저 연구되었으나 아직까지도 닭 동결 정액의 산업적 이용성은 매우 저조하다(Neville et al., 1949; Polge et al., 1949). 그 이유는 희석된 동결 정액을 활용할 때, 연구자에 따라 균일하지 않은 수정결과가 보고되고 있으며, 융해된 닭 정자의 활력도가 우수한 경우에도 수정율이 낮은 경우가 보고되고 있다(Hammerstedt and Graham, 1992; Gill et al., 1996; Hou et al., 2008; Hanzawa et al., 2010; Choi et al., 2012). 그러므로 닭 정액 희석제 연구를 통하여 저장 능력을 증진시키는 것은 닭 유전자원 생산과 종축의 유전적 다양성 확보를 위하여 반드시 필요하다고 판단된다(Lake, 1986).
닭 정액은 포유류 정자와 같은 형태가 아니며 두부가 창형 구조(spike-like)로 사행성 운동으로 정자가 이동하고 있다. 두부가 유연하게 움직이는 구조로서 표면적이 넓기 때문에 동결과정에서 더 손상을 받기 쉽다(Long, 2006; Dinnyes et al., 2007). 닭 정자의 두부가 뚜렷하게 구별되지 않아 손상 정도를 판별하는 것은 더 힘들기 때문에 많은 연구자들이 어려움에 직면하고 있다. 또한, 닭 정자 꼬리도 매우 길기 때문에 현미경으로 관찰하기가 어려우며(Svoradova et al., 2021) 도말 슬라이드에서 정자는 서로 중첩되어 관찰되기 쉬우므로 관찰에 더 많은 노력이 필요하다(Lukaszewicz et al., 2008).
닭 정액을 종계에서 채취하고 정액을 활용하는 방법은 크게 3가지로 나누어 볼 수 있다. 첫째, 가장 흔한 방법은 원 정액을 희석하거나 그대로 이용하는 방법이며, 둘째, 정액을 희석제로 희석한 후 냉장 보존하여 인공수정에 이용하는 방법, 마지막으로 동결 정액을 활용하는 방법으로 구분된다. 일반적으로 병아리를 생산하는 농가에서는 첫번째와 두번째 방법을 가장 많이 이용하며 이는 수정란 생산능력과 비용 등을 고려하여 선택하고 있다. 이때 가장 중요한 것은 닭 정자의 생존율이며 형태적 이상성을 판단하여 종계로 사용할 개체의 문제점을 빨리 파악하는 것이다(Lukaszewicz et al., 2008). 닭 정액의 성상을 판단하는 기준으로 여러가지를 고려해 볼 수 있다. 이를 위하여 가장 먼저 분석하는 것은 정자의 운동성이며 이것으로 우선 생존성을 판단하고 자료의 객관화를 위하여 정자의 운동성을 분석하여 정자 활력을 정량화 할 수 있다(Makler, 1980; Vantman et al., 1998; King et al., 2000). 또한, 정자의 구조적인 안정성을 정량적으로 판단하기 위하여 현미경을 이용한 정자 염색 도말 검사 기법으로 형태적 이상성을 분석 하는 과정은 필수적이다(Santiago-Moreno et al., 2016). 닭 정자 기형률(abnormality)은 현미경으로 관찰한 정자의 형태학을 기준으로 조사하여 판단한다. 닭 정액을 적당한 농도로 희석하여 슬라이드 도말을 만들고 염색 시약으로 염색하여 관찰하는데, 닭 정자의 특성상 다양한 판단 기준을 가지고 있다. 우선 정자의 첨체 이상을 관찰하고, 두부의 형태적 이상을 관찰한다. 두부가 편모로 부드럽게 연결되어 있고 이 부분에 미토콘드리아가 분포하며 이것의 안정성을 관찰할 수 있다. 또한 닭 정자의 두부가 꼬여져 있는 이상성이 존재하며, 편모의 꺾임 현상, 미부의 편모가 헤어져 있는 형태 등으로 연구자마다 다양한 판별 기준을 제시하고 있다(Lukaszewicz et al., 2008; Andraszek et al., 2018). 이러한 형태적 이상성 중에서 가장 중요한 기준은 첨체의 이상성이라고 판단된다. 그 이유는 운동성을 결정하는 중편부와 미부를 결정되는 편모 이상성이 가장 중요하지만, 최종적 수정과정에서 가장 중요한 기능을 가지고 있는 미세구조가 첨체(acrosome cap)이기 때문이다. 닭 첨체는 난관으로 떨어진 난황과 직접 접촉하여 난황막을 녹이고 전핵 형성을 위한 단백질 분해 효소를 함유하고 있다(Bakst, 2011). 이는 수정과정에서 난황막에 웅성 전핵을 형성하는데 필수적인 것으로 알려져 있고 효소적 반응으로 이루어진다. 닭 첨체의 구조 또한 포유류의 정자와 형태적으로 다르며, 정자의 핵 부분과 물리적으로 구분된 첨체를 가지고 있다고 보고되었다(Santiago-Moreno et al., 2016).
닭 정자의 생리적 이해도는 아직 미진하며 암탉이 난관에 정자를 보존하여 수정란을 생산하는 기간을 고려할 때, 정상적 형태의 정자가 수정에 중요할 것으로 판단된다(Bakst et al., 1994). 종축 농가에서 닭 정액을 활용하는 방법은 희석된 신선 정액(fresh semen)을 이용하며 인공 수정하는 방법으로 규모가 작은 농가는 원 정액(raw semen)을 이용하는 경우가 많다. 그러므로, 본 연구에서는 닭 신선 정액을 냉장 보존하는 방법에 관한 연구를 수행하였으며 희석액, 보존 용기 및 보존 기간이 닭 첨체의 온전성에 미치는 영향을 조사하였다. 냉장 보존과정에서 나타날 수 있는 닭 정자 첨체 기형률을 분석하였고 정액의 냉장 보존에 필요한 조건을 탐색하였다. 이러한 기본 자료는 닭 신선 정액를 활용하는데 도움이 될 것으로 판단된다.
재료 및 방법
1. 공시축
공시축은 국립축산과학원 가축유전자원센터에 사육 중인 오계(Ogye)계통 52~65주령의 수컷20수를 사용하였다. 시험에 사용된 오계의 사양관리 및 정액 채취는 국립축산과학원 동물실험 윤리위원회의 승인으로 규정을 준수하여 시행하였다(승인번호 2021-511).
2. 시약 및 희석액의 조성
본 연구에 사용된 시약은 Sigma-Aldrich Chemical Co.(USA)의 제품을 이용하였다. 정액 희석액 제조에 이용된 물은 Irvine Scientific(Santa Ana, USA)에서 공급한 체외수정 클리닉 등급(water for assisted reproductive technology)을 이용하였다. 닭 정액 냉장 보존을 위하여 희석제로 이용되는 BPSE-I(Beltsville poultry semen extender-I)와 Lake’s solution을 이용하였다. BPSE-1은 potassium phosphate dibasic trihydrate 1.27 g, sodium L glutamate 0.867 g, D-fructose(anhydrous) 0.5 g, sodium acetate trihydrate 0.43 g, TES 0.195 g, potassium citrate 0.064 g, potassium phosphate monobasic 0.065 g 및 magnesium chloride anhydrous 0.034 g을 최종 부피가 100 mL가 되도록 세포 배양용 초순수를 용해하여 제조하였다(Sexton and Fewlass, 1978). Lake 희석액은 sodium glutamate monohydrate 1.92 g, glucose 0.6 g, magnesium acetate tetrahydrate 0.08 g, tri-potassium citrate monohydrate 0.128 g, sodium acetate 0.51 g을 100 mL 초순수에 용해하여 제조하였다(Lake, 1960; Lake and Ravie, 1979).
3. 정액의 채취, 희석 정액의 제조 및 냉장 보존
닭 정액은 횡취법을 이용하였으며 약 5~10수의 신선 정액을 채취하여 5 mL 튜브(round cap tube)에 옮겼다. 보온병에 미리 준비한 5℃ 실험용 얼음에 옮기고 BPSE-1로 1:1 비율로 정액을 희석하였다. 15분 이내에 실험실로 이송하여 BPSE-1희석제로 다시 희석하여 냉장실에 보존하였다. 보존 용기에 의한 차이를 관찰하기 위하여 정자를 냉장 저장하였을 때, 닭 정액을 Fig. 1에서 설명되는 바와 같이 0.5 mL 스트로에 포장하였다. 희석된 정액을 가운데 두고 2~3 mm의 공기 방울로 간격을 두며 희석액을 채웠고 파우더를 이용하여 밀봉하였다.
Fig. 1.
The image of rooster semen preservation in 0.5 mL straw. The 0.5 mL was filled by diluent (b), air compartment (3 mm), diluted semen (c), air compartment (3 mm), and a diluent (b). The cotton area (d) and the sealing part (a) of straw were also marked. The straw was placed on tissue paper and covered with aluminum foil.
Download Original Figure
4. 신선 정액 정자 분석
동결정액은 5℃ 저온수조(FHK, Japan)에서 2분간 정액을 융해하였다. BPSE-1희석제로 최종 희석배율이 200배가 되도록 희석하여 1.5 mL tube로 옮긴 후 Eppendorf ThermoMixerTM에 이동하여 5분간 37℃로 가온하였다. 희석된 정액 10 µL를 동일한 온도로 가온한 Makler counting chamber에 점적하여 정자분석용 프로그램(Computer Assisted Sperm Analyzer, CASA)으로 ISAS(Poiser R & D, Paterna, Spain)를 이용하여 정자의 운동성을 관찰하였다.
5. 닭 정자 첨체 염색 및 기형률 조사
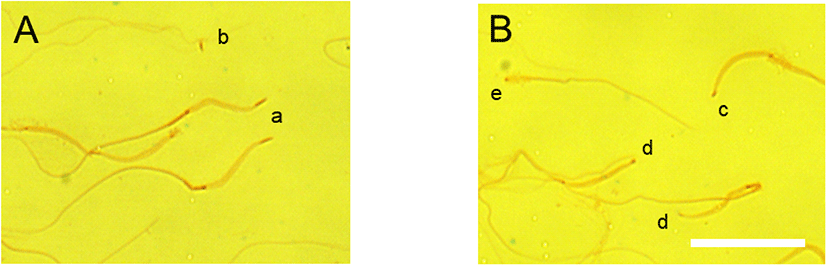
정자의 첨체를 염색하기 위하여 4배로 희석된 정자를 3~5 µL를 슬라이드의 한쪽 끝에 점적하고 다른 슬라이드로 한쪽 끝까지 천천히 밀고 슬라이드 워머에서 3~5분간 건조하였다. 완전히 건조한 도말을 3.7% paraformaldehyde를 이용하여 1분간 염색하여 다시 건조시키고, Diff Quik stain kit 내에 있는 eosin 염색시약에 3~4초간 침지한 후 Coomassie Brilliant Blue R-250(CBB) 0.04% 용액을 다시 침지하여 첨체를 염색하였다. CBB염색시약은 1차 농축액으로 CBB 0.2 g을 methanol 45 mL에 완전히 녹인 후 acetic acid glacial과 2차 증류수의 비율이 1:9인 혼합액 55 mL을 넣어 최종 농도가 0.2%인 농축용액을 준비하였다. 이 용액을 다시 2차 증류수로 희석하여 0.04% CBB 염색시약을 준비하여 정자를 염색하였다. 닭 정자의 첨체는 Fig. 1에서 보는 바와 같이 신선 정액의 경우, CBB에 의하여 정상적인 acrosome이 두부와 구별되어 염색되었다(Fig. 2A). 그러나 3일 동안 BPSE-1희석액에서 5℃에서 냉장보존을 실시하면, 첨체가 짧아지거나 첨체가 탈락된 비정상적인 첨체 기형 정자가 관찰됨을 알 수 있었다(Fig. 2B).
Fig. 2.
The image of intact and abnormal acrosome caps preserved in low temperature. A: Normal rooster spermatozoa with standard acrosome cap (a). The detached acrosome (b) from damaged spermatozoa B: Abnormal spermatozoa with short (c), missing (d) acrosome or missing head (e). The white bar is 20 µm.
Download Original Figure
6. 통계 자료 분석
각 실험은 3회 반복 실시하였으며, 보존 용기에 대한 정자 운동성은 Student’s t-test로 분석을 실시하였고, 보존일에 따른 운동성의 변화량과 첨체 온전성은 일원배치 분산분석(one way analysis of variance, ANOVA)으로 유의성을 검증하였다. P값이 0.05보다 낮은 실험군은 통계적으로 유의성이 있는 것으로 간주하였다.
결 과
1. 보존 용기가 닭 정자 운동성에 미치는 영향
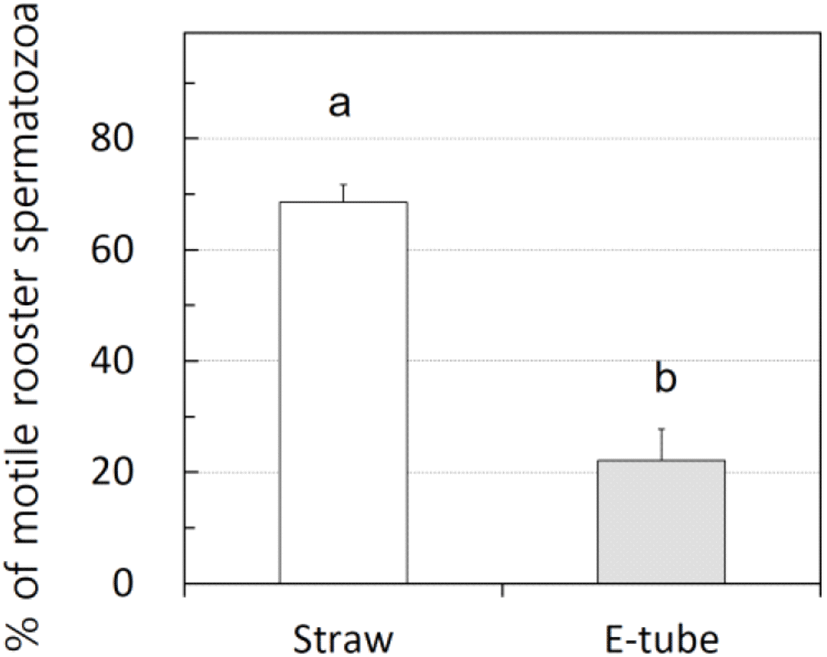
Fig. 3에서 관찰하는 바와 같이 닭 정액을 5℃에서 3일간 냉장보존하면 운동성이 떨어지는 것을 알 수 있다. 보존 용기의 최적화를 위하여 1.5 mL e-tube를 이용하는 경우와 0.5 mL 스트로를 이용하는 경우를 비교하여 보면, 0.5 mL 스트로에 보존된 경우가 유의적으로 운동성이 높았다(68.6±3.1% vs 22.1±5.7%, P<0.05).
Fig. 3.
Effects of preservation ware on the motility of rooster sperm at low temperature. The diluted semen was preserved at 5℃ in 0.5 mL straw or 1.5 mL Eppendorf tube.
Download Original Figure
2. 희석제가 저온 저장된 닭 정자의 운동성에 미치는 영향
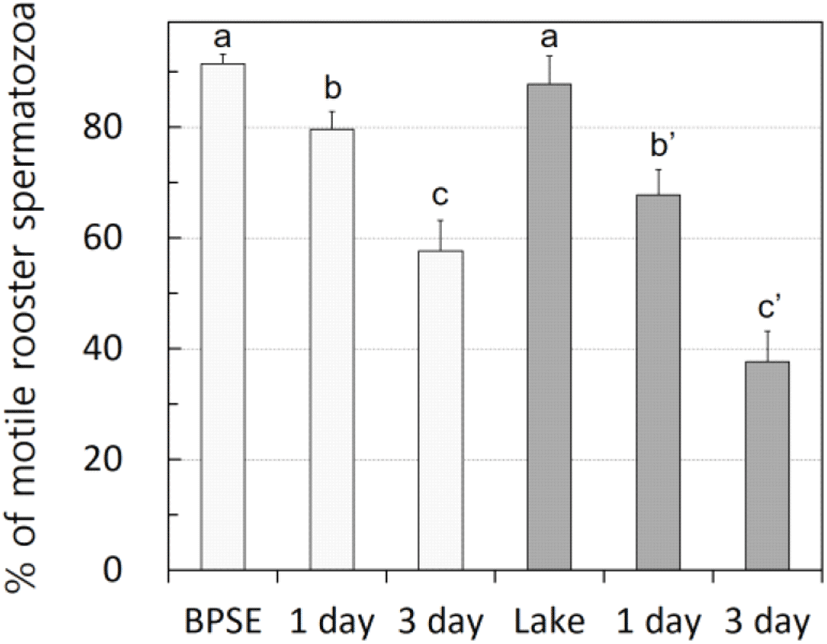
닭 정액 보존을 위하여 0.5 mL스트로를 이용하여 5℃에 보존을 실시할 때 2가지 희석제의 능력을 Fig. 4에서 비교하였다. 냉장 보존용 희석제는 BPSE-I이 우수한 것으로 관찰되었다. 희석 직후에는 두 희석제는 정자의 운동성에 영향을 주지 않았으나(91.5±1.8% vs. 87.8±5.1%), BPSE-1이 1일째 및 3일째 정자 운동성이 유의적으로 높았다(79.7±3.1% vs. 67.8±4.6%, 57.7±5.6% vs. 37.7±5.4%, P<0.05).
Fig. 4.
The effects of diluents on the motility of low temperature preserved rooster semen. The fresh semen was diluted with BPSE and Lake diluent, packed into 0.5 mL straw and preserved at 5℃. Different superscripts indicate a significant difference between groups (P<0.05).
Download Original Figure
3. 저온 보존 효과가 닭 신선 정자 첨체에 미치는 영향
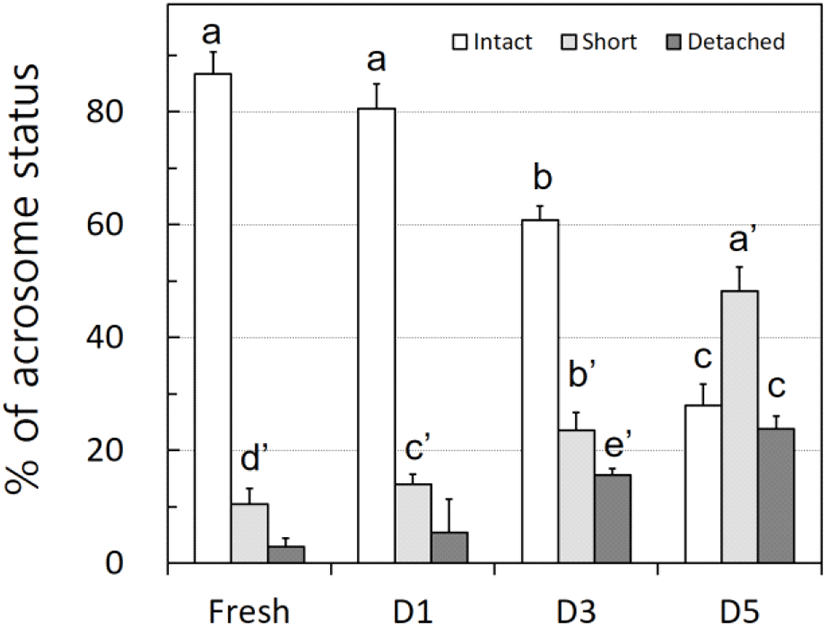
저온 보존과정에서 나타날 수 있는 닭 정자 변화도를 조사하기 위하여 정자 두부의 첨체를 CBB로 염색하여 현미경으로 정자 첨체의 온전성(intactness)을 조사하였다. Fig. 5에서 보는 바와 같이 신선 정액의 경우 온전한 첨체를 가진 정자의 비율이 86.7±3.9%로 매우 높은 수준을 유지하였으나, 1일 이후에는 80.5±4.1%로 낮아졌으나 유의적 차이는 관찰할 수 없었다. 그러나, 3일자와 5일자의 저온 저장은 첨체 안정성을 60.7±2.5%와 27.9±3.8%로 낮추었다. 흥미롭게도 첨체가 짧아지는 현상이 관찰되었으며 이는 저온 저장이 길어질수록 지속적으로 증가하는 경향을 관찰할 수 있었다. 첨체 탈락 현상은 1일까지 유의적 차이가 없었으며, 3일자, 5일자에서도 유의적으로 증가하였다.
Fig. 5.
The effects of preservation period on the acrosome status of rooster semen. The low temperature-preserved fresh semen was stained by CBB acrosome cap staining. Different superscripts indicate a significant difference between groups (P<0.05).
Download Original Figure
고 찰
우리나라는 산업용으로 생산하는 실용계 생산을 위하여 종계를 지속적으로 수입하고 있어 닭 산업은 외국 종축 회사에 의존하고 있다. 종계를 유지하는 것은 근친도를 최소화 하면서 능력을 극대화하는 방법인데, 닭 또한 정액을 이용한 계통의 다양성을 확보하는 기술이 매우 중요하다. 병아리를 생산하는 농가에서 수컷의 다양성을 확보하기 위하여 정액을 교류하여 사용할 수 있는데, 이러한 경우 희석 정액을 냉장 보존하여 이송하는 것이 매우 중요하다. 영구 보존된 동결 정액을 활용할 수 있으나, 후대 생산 효율이 매우 낮으며 동일한 방법도 변이가 매우 심한 것이 특징이므로 바람직하지 못한 것으로 판단된다.
닭 정액을 냉장 보존하여 이용하는 방법은 포유류에서 정액을 사용하는 방법으로 동일한 목적으로 이용된다. 그러나, 보존 용기에 따라 정자의 운동성을 증진시킬 수 있음은 아직까지 결과가 없으며 저온 저장된 닭 정자의 첨체 안정성을 CBB로 관찰한 연구 자료는 보고되지 않았다. 액상 정액을 가장 흔히 이용하는 돼지의 경우, 저장 온도가 16~18℃가 최적인 반면, 닭의 경우 4~5℃가 가장 우수하다고 알려져 있다(Szymanowicz et al., 2019; Blackburn et al., 2009). 또한 정액을 소량 보존하여 실험에 이용할 경우에도 1.5 mL e-tube보다 0.5 mL 스트로를 활용하여 냉장 보존하는 것이 유리하다고 판단된다. 닭 정자는 희석 배율을 소와 돼지와 같이 대량으로 희석할 수 없기 때문에, 정자가 서로 중첩되는 경우가 낮은 용기일수록 정자의 보존성은 더 높아질 것으로 추정된다.
저온 보존과정에서 닭 정액을 보존할 때 수정률이 떨어지는 것은 잘 알려져 있다. 이러한 원인을 분석하기 위하여 닭 정자의 수정 기작에 중요한 기능을 담당하는 첨체를 조직학적 차별 염색법으로 염색하였을 때, 첨체 손상도가 유의적으로 증가하고 있음을 밝혔다. 닭 신선 정액을 37.5℃에서 3시간만 배양하여도 수정 능력이 극도로 저하되며 이는 정자 첨체가 손상되어 수정 능력을 잃어버린 정자의 비율이 높아져서 일어나는 것으로 판단된다. 또한, 희석하여 보존된 정액은 두부의 단면적이 높게 관찰되는 경우가 있는데, 이는 첨체 온전성 이외의 다른 기작으로 닭 정자 자체의 손상이 나타날 수 있음을 짐작할 수 있다.
본 연구에서는 닭 정자의 저온 저장 효과를 극대화 하는 방법으로 0.5 mL 스트로를 사용하는 것을 제안하였다. 그러나 1점의 스트로로 약 4마리만 인공 수정할 수 있으므로 다량의 정자를 손쉽게 보존하는 연구가 추가적으로 필요할 것으로 판단된다. 닭 정자는 스트로에 밀봉될 경우, 산소 공급이 차단될 것으로 기대되는데 이러한 효과에 의하여 미토콘드리아의 산화적 인산화가 억제되며 세포 대사율이 떨어지므로 장수성이 높아지는 것으로 믿어진다. 또한 희석용액으로서 BPSE-I이 Lake solution보다 우수한 것으로 판단되며 약 3~4일간 보존한 정액도 후대 생산에 이용할 수 있음을 추정할 수 있다. 그러나 50% 이상의 정자가 생존하고 온전한 정자의 비율까지 고려할 때 2일 정도가 가장 성적이 우수할 것으로 예상되며 앞으로 추가 연구로 더 장기간 보존하는 결과를 얻을 수 있을 것으로 기대된다. 일반적으로 국내에서 종축 정액을 이용하여 병아리를 이용하고자 할 경우, 2~3일 정도로 냉장 보존성이 높아지면, 충분히 농장 간 이송이 가능하다. 이러한 특성은 병아리 생산 농가에서 종축을 얻고자 할 때, 다른 농장에서 얻은 냉장 정액을 활용하면 다양성이 풍부한 계군을 유지할 수 있다고 믿어진다. 냉장 저장된 닭 정자 첨체는 지속적으로 손상이 일어나기 때문에 닭 정자의 농도를 높여서 활력이 우수한 정자를 다량 공급하는 것이 후대 생산에 중요할 것으로 파악된다. 또한 가금의 번식 생리 특성상, 건강한 암컷은 수정능을 보유한 정자를 자성생식도관에 저장할 수 있는 능력이 있으므로, 저온 저장된 정자는 시차를 두고 반복적으로 인공 수정할 경우, 후대 생산성을 높일 수 있다고 판단된다.
사 사
본 연구는 농촌진흥청 가축유전자원센터에서 수행하고 있는 “닭 동결 유전자원 수집 보존 체계 확립(PJ01558302)”과제의 지원에 의하여 이루어진 것임.
REFERENCES
Andraszek K, Banaszewska D, Biesiada-Drzazga B 2018 The use of two staining methods for identification of spermatozoon structure in roosters. Poult Sci 97(7):2575-2581.

,


Bakst MR, Wishart GJ, Brillard JP 1994 Oviductal sperm selection, transport and storage in poultry. Poult Sci Rev 5(3):117-143.

Bakst MR 2011 Role of the oviduct in maintaining sustained fertility in hens. J Anim Sci 89(5):1323-1329.

,


Blackburn HD, Silversides F, Purdy PH 2009 Inseminating fresh or cryopreserved semen for maximum efficiency: implications for gene banks and industry. Poultry Science 88(10):2192-2198.

,


Choi JS, Kim SW, Shin DB, Ko YG, Do YJ, Kim DH, Kong IK, Park SB 2012 Effects of N-methylacetamide on the viability, fertility and hatchability of Cryopreserved Ogye (Korean Native Black Fowl) Semen. Korean J Poult Sci 39(4):291-295.


Clarke RN, Sexton TJ, Ottinger MA 1982 Effects of holding temperature and storage time on respiratory rate, motility, and fertility of chicken and turkey semen. Poultry Science 61(9):1912-1917.

,


Dinnyes A, Liu J, Nedambale TL 2007 Novel gamete storage. Reprodo Fertil Dev 19(6):719-731.

,


Gill SP, Buss EG, Mallis RJ 1996 Cryopreservation of rooster semen in thirteen and sixteen percent glycerol. Poult Sci 75(2):254-256.

,


Hanzawa S, Niinomi T, Miyata T, Tsutsui M, Tajima A 2010 Cryopreservation of chicken semen using N-methylacetamide as cryoprotectant. Jp Poult Sci 47(J1):27-32.

Hammerstedt RH, Graham JK 1992 Cryopreservation of poultry sperm: The enigma of glycerol. Cryobiology 29(1):26-38.


Hou ML, Huang SY, Lai YK, Lee WC 2008 Rooster spermatozoa cryopreservation and quality assessment. Anim Reprod Sci 104(1):56-68.


King LM, Holsberger DR, Donoghue AM 2000 Correlation of CASA velocity and linearity parameters with sperm mobility phenotype in turkeys. J Androl 21(1):65-71.

Lake PE 1960 Studies on the dilution and storage of fowl semen. J Reprod Fertil 1(1):30-35.

,


Lake PE, Ravie O 1979 Effect on fertility of storing fowl semen for 24 h at 5 degrees C in fluids of different pH. J Reprod Fertil 57(1):149-155.

,


Long JA 2006 Avian semen cryopreservation: What are the biological challenges?. Poult Sci 85(2):232-236.

,


Lukaszewicz E, Jerysz A, Partyka A, Siudzińska A 2008 Efficacy of evaluation of rooster sperm morphology using different staining methods. Res Vet Sci 85(3):583-588.

,


Makler A 1980 The improved 10 micrometer chamber for rapid sperm count and motility evalutation. Fertil Stril 33(3):337-338.


Neville WJ, Macpherson JW, Reinhart B 1971 The contraceptive action of glycerol in chickens. Poult Sci 50(5):1411-1415.

,


Polge C, Smith AU, Parkes AS 1949 Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature 164(4172):666.

,


Santiago-Moreno J, Esteso MC, Villaverde-Morcillo S, Toledano-Déaz A, Castaño C, Velázquez R, López-Sebastián A, Goya AL, Martínez JG 2016 Recent advances in bird sperm morphometric analysis and its role in male gamete characterization and reproduction technologies. Asian J Androl 18(6):882-888.

,

,


Shanmugam M, Vinoth A, Rajaravindra KS, Rajkumar U 2014 Evaluation of semen quality in roosters of different age during hot climatic condition. Anim Reprod Sci 145(1-2):81-85.

,


Sexton TJ and Fewlass TA 1978 A new poultry semen extender. Effect of the diluent components on the fertility of chicken semen stored at 5℃. Poult Sci 57(1): 277-284.

,


Svoradova A, Kuzelova L, Vasicek J, Balazi A, Olexikova L, Makarevich A, Chrenek P 2021 Perspective: rooster spermatozoa cryopreservation and quality assessment. Cryo Letters 42(2):59-66.

Szymanowicz J, Schwarz T, Murawski M, Małopolska M, Oszczęda Z, Tuz R, Nowicki J, Bartlewski PM 2019 Storage of boar semen at 16-18℃ in the long-term commercial extender prepared with deionized water or nanowater. Anim Reprod 16(4):864-870.


Vantman D, Koukoulis G, Dennison L, Zinaman M, Sherins RJ 1998 Computer-assisted semen analysis: evaluation of method and assessment of the influence of sperm concentration on linear velocity determination. Fertil Steril 49(3):510-515.