서 론
기후변화에 의한 지구의 온난화는 가축 산업에 가장 큰 위해 요소 중 하나이면서 동물복지에도 많은 영향을 준다. 육계는 성장과 근육 발달 중심 선발과 육종이 수십 년간 진행되어 왔다. 그러나 이들과 연관된 내부 장기, 즉 열 스트레스 발생시 과호흡과 열 손실을 도와주는 핵심 장기인 심장과 폐는 비례적으로 성장하지 못하여 급격한 환경 온도 변화에 대처하기가 어렵다(Havenstein et al., 2003; David et al., 2017). 따라서 현대의 육용형 가금은 극단적인 환경변화, 특히 고온 스트레스에 매우 취약하여 고온 스트레스에 노출되면 사료 섭취량과 성장 능력, 발병율, 폐사율 그리고 육질까지 영향을 받는다(Yahav, 2009). 병아리는 부화 후 첫 36시간 동안에 열 스트레스를 경험할 가능성이 높은데, 이는 부화 후 부화기의 높은 온도에 노출되어 있으면서, 물과 사료에 자유롭게 접근할 수 없는 조건에 있기 때문이다(Halevy et al., 2001). 이에 더하여 병아리 작업과 수송 과정에도 저온 혹은 고온 등과 같이 다양한 주변 온도에 수일간 추가로 노출되게 되어 스트레스와 같은 생리적 반응뿐만 아니라 동물복지에도 부정적 결과를 주게 된다. 병아리의 부화 후 초기 생육기간은 근육 성장에 있어서 가장 결정적 순간으로 이 기간에 위성세포는 증식을 완료하고 세포의 말단 분화 및 근섬유 융합을 진행한다. 병아리가 부화 후 처음 2주 동안 열 스트레스에 길게 노출되게 되면 근육세포 발달에 부정적 영향을 주게 되고, 이는 결국 단기뿐만 아니라 장기적으로 체중 및 가슴 근육량 감소로 이어진다(Piestun et al., 2017; Patael et al., 2019). 이와 같이 육계의 부화후 초기 수일간은 육계의 전 생애에서 가장 중요한 시기임을 알 수 있다. 따라서 본 원고에서는 육계의 생애 초기 사육기간 동안 열 스트레스 관리의 중요성을 강조하고, 닭의 체온조절 및 근육발달 과정, 열 스트레스가 근육 발달에 미치는 영향, 그리고 열 스트레스를 저감하기 위한 연구들을 소개하고자 한다.
본 론
갓 부화된 어린 병아리는 체온조절 기능이 효율적으로 작동되지 못하며, 부화 후 수일이 지나고 나면 체온조절 능력이 크게 향상된다(Freeman, 1967; Wekstein and Zolman, 1969). 이는 조류가 부화 후 4-5일까지 변온동물과 같이 체온조절을 하다가 그 이후에 항온동물로 전환하고 이에 따라 좁은 온도범위 내에서 자신의 체온을 조절하고 유지할 수 있기 때문이다(Gonzalez-Rivas et al., 2020; Halevy, 2020). 부화 후 3주령에 저온에 노출되면 대사율이 증가하고 탄수화물과 저장된 지방을 동원하지만, 체온조절에는 실질적으로 탄수화물만 이용된다(Freeman, 1976). 이러한 생리적 조건과 대사적 변화 때문에 갓 부화된 병아리는 변온성 동물에서 항온성 동물로 점진적으로 전환하게 된다. 조류는 피부에 체온 조절용 열 방출 기관인 땀샘을 가지고 있지 않고 호흡을 통한 열 방출(respiratory evaporation)이 체온조절의 주요한 수단이기 때문에 여름철 고온에 취약하다(Lin et al., 2005). 특히 사육 환경온도가 체온에 근접해지면 호흡이 더 많이 일어나고 온도가 높아짐에 따라 호흡 빈도도 더불어 증가한다(Wiernusz and Teeter, 1996). 가금에서 호흡 이외 비호흡 증발에 의한 열 방출, 즉 체내 심층부로부터 따뜻한 혈액이 표피조직으로 이동하면서 노출된 피부 표면과 깃털에서 열이 발산되는 부가적인 체온조절이 있다(Lin et al., 2005; Watts et al., 2011). 닭이 스트레스에 직면하게 되면 제일 먼저 신경계에서 반응하게 되고, 혈당, 호흡, 근육긴장도, 신경민감도 등을 높인다. 열 스트레스는 시상하부-뇌하수체-부신피질 축에 영향을 주어 뇌하수체에서 ACTH (adrenocorticotropic hormone)을 분비하게 하고, ACTH는 부신피질에서 코티코스테로이드를 분비하게 한다(Lotvedt et al., 2017). 열 스트레스가 주어지면 닭은 항상성 유지를 위하여 혈중에 높아진 코티코스테로이드에 의해 포도당 생성 및 광물질 대사를 증가시킨다(Binsiya et al., 2017). 포도당 생성은 열 스트레스에 의한 사료 섭취량 감소에 대한 반응이며, 광물질 대사는 호흡 증가에 따른 이산화탄소의 배출로 높아진 혈액 pH를 완화하기 위한 중탄산염과 칼슘 등의 가용성을 높이기 위함이다. 빠른 성장 목적의 육종의 결과, 산란계에 비하여 육계는 높은 대사활동에 의해 체내 열 생산은 더 많이 증가하는데 근육내 모세혈관 밀도는 상대적으로 오히려 낮아 열 제거를 위한 능력은 감소한다(Joiner et al., 2014). 또한 육계 중에서도 암컷보다 수컷 브로일러가 열 스트레스에 더 취약하다. 따라서 부화 후 4-5일 후 육계가 온도가 높은 사육환경에 노출되면 큰 스트레스가 될 수 있다. 대부분의 포유동물은 흰색지방과 갈색지방을 가지고 있으며 그 중에서 갈색지방은 비떨림열발생(non-shivering thermogenesis)을 위한 주요 기관이다(Anghel and Wahli, 2007). 그러나 갈색지방이 없는 조류는 저온에 노출되었을 때 체온 조절을 위하여 골격근 떨림(muscle shivering)에 의존해 체온을 올리는 것으로 알려졌지만 비떨림열생성에 의한 열생성도 하는 것으로 알려져 있다(Raimbault et al., 2001; Ijiri et al., 2009). 조류는 체온유지를 위해 비떨림열발생을 이용하고 낮은 온도에 대응하여 갈색지방 유사세포인 다각형 지방세포를 형성한다(Barre et al., 1986). 조류는 실제 포유동물에서 볼 수 있는 기능성 갈색지방은 없기 때문에 갈색지방 표지유전자인 UCP1유전자가 없다(Olson et al., 1988; Saarela et al., 1991). 그러나 포유동물의 갈색지방과 유사한 갈색지방 유사세포가 확인이 되었으며, 포유동물의 갈색지방 분화와 유사한 경로를 활용하는 체계가 있어 비떨림열발생에 의한 체온조절 가능성을 제시하였다(Mezentseva et al., 2008). 포유동물의 갈색지방에서 발현되고 열 발생의 주요 유전자인 UCPs과 상동성(homologue)을 지닌 조류UCP(avian UCP 혹은 avUCP)가 62주령 로드 아일랜드 레드 닭의 지방조직이나 간조직이 아닌 근육세포 특이적으로 발현되는 것을 확인하였고, 8주령 브로일러의 경우 비특이적 즉 대부분의 장기조직(비장, 폐, 간, 신장, 지방조직 등)에서 발현되었지만 역시 골격근육에서 가장 많이 발현되었다(Raimbault et al., 2001; Evock-Clover et al., 2002). 위에 소개된 연구 결과들을 보면 닭의 품종과 연령에 관계없이 근육세포에서 조류 UCP가 많이 발현된다는 사실이다. 또한 이 유전자가 저온 환경에서 조류(닭, 오리, 펭귄 등)의 조건적 체온조절의 핵심 인자임을 알 수 있다(Dridi et al., 2004). 따라서 저온 환경에 노출된 조류의 체온조절은 골격근육의 떨림(shivering thermogenesis)에 의한 열생성이 주요 체온조절 기작이 되며, 조건적 비떨림 열생성(facultative non- shivering thermogenesis)은 골격근육이 성숙된 부화 후 8일 이후에 저온 저항성을 갖게 된다(Ijiri et al., 2009). 지난 수십 년간 성장과 고기생산을 주목적으로 하는 유전적 선발이 지속된 육용형 가금은 고온 스트레스에 대처를 제대로 하지 못한다. 따라서 육계의 생리적 체온조절에 대한 이해가 육종에 있어 깊이 있게 고려해야 할 항목임을 알 수 있다.
위성세포(satellite cells)는 개구리의 골격근육조직 주변을 전자현미경으로 관찰하는 과정에서 근육의 기저판(basal lamina)과 근형질막(sarcolemma) 사이에서 처음 발견되었다(Mauro, 1961). 위성세포는 근육전구세포(muscle progenitor cell) 혹은 성체 근원세포(adult type myoblast)로 명명하기도 한다(Moss and Leblond, 1971; Hartley et al., 1992). 위성세포는 배 발생(embryogenesis) 초기 원체절(somite)에서 기원을 하지만 닭의 경우 발생 후기단계에서 식별이 가능한데, 배 발생 14일경에 낮은 수가 관찰되고 18일경에는 그 수가 많아진다(Hartley et al., 1992; Gros et al., 2005). 닭에서 근육생성 단계는 배 발생초기(발생 3일-7일)와 후기(발생 8일 이후), 그리고 부화 직후(neonatal) 3단계로 나눌 수 있다(Chal and Pourquie, 2017)(Fig. 1). 부화 직후 3단계에 근육생성이 다시 시작되는데 이때 위성세포는 대규모로 세포분열과 말단 분화를 하게 된다. 육계의 경우 이 3단계는 매우 짧아 약 8일간이 된다(Halevy et al., 2000; Halevy et al., 2006; Allouh et al., 2008). 배 발달 초기의 배아와 후기 태아의 근육생성(myogenesis) 단계에서 세포의 증식(proliferation)과 분화(differentiation)가 일어나는 근원세포(myoblasts)와 달리, 배 발생기의 위성세포는 세포분열은 하지만 분화는 하지 않는다(Stockdale, 1992; Chal and Pourquie, 2017). 발생 초기 단계에서는 최초의 근섬유(primary myofiber)가 형성되고 성체 근육의 기초가 된다(Fig. 1)(Chal and Pourquie, 2017). 발생 후기단계에서는 분열하는 위성세포로부터 핵의 제공과 세포 융합에 의한 근육의 성장이 지속된다. 배아에서 근원세포의 말단 분화에 의한 근세포(myocyte)로의 전환은 myogenin에 의하여 조절 받는다(Venuti et al., 1995). 많은 생물 종들은 각 근육에 있는 성체 근섬유(adult muscle fiber)의 총수는 출생시에 이미 결정되어 있다. 그러나 이미 존재하는 근섬유에 추가적으로 근핵(myonuclei)을 제공하여 출생 이후에 근육 전구세포의 증식과 융합 과정이 일어난다. 그러나 이러한 과정은 동물의 성장에 따라 느리게 진행되며, 성체가 된 후에는 근원세포의 증식 혹은 근섬유로의 융합이 매우 낮거나 없다. 다만 상처나 특정 스트레스 하에서는 근원세포의 증식과 근섬유와의 융합이 일어날 수 있다(Campion, 1984; White and Esser, 1989). 앞에서 언급한 것처럼 부화 직후에 근육생성 단계가 다시 시작되는데, 육계에서 부화 후 약 8일 정도가 지나면 위성세포의 활성은 급격하게 감소하고 세포의 수도 총 근육세포 핵의 1-5%까지 낮아지며, 이들 위성세포는 대부분 활동이 없는 상태로 된다. 이들 세포는 근육 재생(muscle regeneration)이 필요한 경우 즉 근육의 손상(예: 상처), 운동, 스트레스(예: 고온 혹은 저온 스트레스), 질병(예: 근병증) 등에 의해서만 다시 활성화되고, 활성화된 위성세포는 근육생성 프로그램 단계 즉, 세포분열 주기와 새로운 근섬유 형성을 위해 말단 분화가 일어난다(Zammit et al., 2006; Yablonka-Reuveni, 2011). 근육세포의 재생은 위성세포 유래 근핵의 DNA복제가 아닌 단핵세포의 근원세포와의 융합에 의한 것이다. 위성세포는 비대칭적(asymmetric)인 방법으로 전구체 세포로 분열하여 근세포로 분화되거나 혹은 근육세포 저장소로서 줄기세포로 분열하는 능력을 가진 성체 근줄기세포로 된다(Collins et al., 2005). 위성세포는 또한 특별한 환경이 주어졌을 때 연골조직, 지방조직 혹은 섬유조직으로 될 수 있는 중간엽 세포(mesenchymal cell)로 교차분화(trans-differentiation)를 할 수 있는 능력을 가지고 있다(Brack et al., 2007; Yin et al., 2013). 심장근육은 위성세포를 가지고 있지 않으며, 이에 따라 심장근육 세포는 재생 능력을 갖지 못한다(Scharner and Zammit, 2011). 위성세포의 증식과 분화에 영향을 미치는 성장인자에는 FGF(fibroblast growth factor), IGF(insulin-like growth factor), TGF-β(transforming growth factor-beta), HGF(hepatocyte growth factor) 등이 있으며 성장호르몬과 성장호르몬 수용체 또한 닭의 위성세포 증식과 분화에 영향을 미친다(Florini et al., 1991; Halevy et al., 1996; Gal-Levi et al., 1998). 휴지기의 위성세포는 근육발달 유도 전사인자(MyoD, Myogenin, Pax7, Prox1)의 발현이 없지만, 일단 활성화가 되면 이들 전사인자들의 발현 양상은 배아 혹은 태아 근원세포에서와 유사하게 된다(Yablonka-Reuveni, 1995). 위성세포의 수는 나이가 들면서 감소하는데, 쥐의 경우 태어난 직후 근육세포 핵의 약 30-35%를 차지하나 28일령에는 약 10%까지 감소하고, 성체가 되면 5% 이하로 떨어진다(Allbrook et al., 1971). 근육이 나이가 들면 위성세포의 형태도 변하며, 리보솜의 수가 감소하고 소포체도 크게 감소하여 결국 세포의 대사적 활성 감소로 이어진다(Schultz, 1976). 따라서 출생 후 성장과정 중에 위성세포 증식에 의한 근원세포를 제공하기 위해서는 위성세포가 성숙한 근육세포에서 세포주기의 유사 분열적 휴지기에 들어가기 전에 위성세포의 증식이 필요하다.
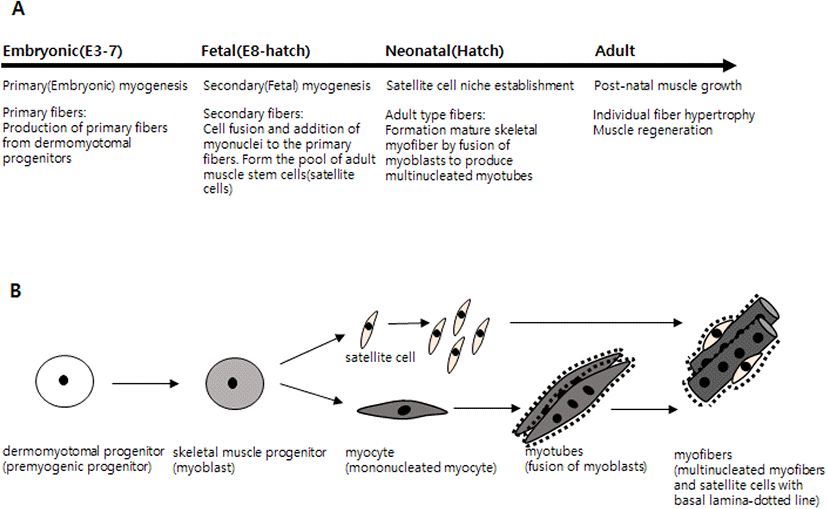
병아리의 부화 후 초기 생육기간은 근육 성장에 있어서 가장 결정적 순간으로 이 기간에 위성세포는 증식을 완료하고 세포의 말단 분화 및 근섬유 융합을 진행한다. 따라서 부화 초기 약 1주일 동안 조기 사료공급 여부 및 영양소의 종류 등 영양의 변화 또는 온도와 빛과 같은 환경 조건 등이 근육생성 과정에 크게 영향을 미치고 결과적으로 근육 성장이 완료되는 나머지 시간 동안 영향을 주게 된다(Halevy et al., 2001; Powell et al., 2016). 병아리가 부화 후 처음 2주 동안 열 스트레스에 길게 노출되게 되면 근육세포 발달에 부정적 영향을 주게 되고, 이는 결국 단기뿐만 아니라 장기적으로 체중 및 가슴 근육량 감소로 이어진다(Piestun et al., 2017; Patael et al., 2019). 열 스트레스는 근육 비대(muscle hypertrophy) 감소에 의한 골격 근육 성장을 감소시키고 닭의 근관세포(myotube)에서 단백질 분해를 증가시킨다(Nakashima et al., 2004). 육계의 성장 및 근육생산 위주의 육종과 선발이 위성세포의 성질에 영향을 준 것으로 여겨지며, 육계와 칠면조 유래 위성세포를 이용한 배양에서 가슴 근육이 특히 온도 변화에 매우 민감하다(Harding et al., 2015; Clark et al., 2016). 이러한 부정적 영향은 일반 상업적 육계 사육 온도보다 2°C 높은 약한 열 스트레스에서는 최소로 나타나거나 또는 거의 나타나지 않는다. 권장 육계 사육 온도보다 조금 낮은 저온 조건하에서 자란 병아리에서 위성세포의 증식이 오히려 높게 나타나기도 한다(Patael et al., 2019). 위의 내용을 종합해 보면, 병아리의 부화 후 초기 사육시 환경 온도는 사육 후반에 근육 전구세포와 근육 비대 등에 영향을 미치는 중요한 요인임을 알 수 있다.
육계의 근육과 근육 사이의 지방 축적은 다양한 스트레스 조건에서 일어나는데, 대표적인 것에는 사료섭취 제한, 사료섭취 지연, 열 스트레스 등이 이에 해당된다(Yahav et al., 1996; Velleman et al., 2014; Powell et al., 2016). 열 스트레스는 시상하부-뇌하수체-부신 축 자극 촉진으로 혈중 코티코스테론 호르몬 농도를 증가시키고, 이는 단백질 및 지방 대사, 체조성 및 육질에 큰 영향을 준다(Sapolsky et al., 2000; Scanes, 2016). 열 스트레스를 받는 동안 가금은 갑상샘호르몬(thyroid hormone, T3)의 분비가 감소하는데 이는 기초대사량과 육체적 활동을 감소시킬 뿐만 아니라 성장을 위한 가용 에너지를 다른 방향, 즉 복부 혹은 피하지방으로 전환시켜 저장한다(Zaboli et al., 2017). 닭의 위성세포는 일반적 생리조건 하에서는 근육으로만 분화되어 근섬유를 형성해야 하는 운명이지만, 열 스트레스를 받은 경우 부분적으로 일부 세포는 지방합성과정으로 방향을 전환한다. 위와 같은 현상은 위성세포가 이질적인(heterogeneous) 다양한 성질의 세포로 구성되어 있는 줄기세포이기 때문에 잘 설명될 수 있다. 즉 유래되는 근섬유 형태에 따라 위성세포의 이질성이 존재한다(Lagord et al., 1998; Manzano et al., 2011). 이러한 이유로 이질적 위성세포는 다양한 증식율의 차이, 근육조직을 만드는 조절인자들의 발현 차이, 다양한 근육적 잠재력의 차이 등을 보이게 된다. 같은 종류의 근섬유 유래 위성세포라도 이질성이 존재하고 증식율, 유전자 발현, 성장인자 혹은 신호물질에 대한 반응 또한 다양하다. 줄기세포로서 위성세포는 뼈세포 또는 지방세포로 교차분화가 가능하다(Asakura et al., 2001; Rossi et al., 2010). 근조직에서 지방의 축적은 열 스트레스에 노출된 위성세포 배양시험에서 확인이 되었으며, 열 스트레스를 받은 닭의 위성세포에서도 지방세포의 형성을 볼 수 있다(Harding et al., 2015; Piestun et al., 2017). 그러나 시간이 지남에 따라 이들 세포들은 근관세포과 근섬유로 분화된다. 위와 같은 지방 축적은 위성세포에서 지방합성 특이적 유전자 및 단백질 발현의 유도에 기인하는데 이는 위성세포가 부분적으로 지방세포 계(adipogenic lineage)로 교차분화가 진행되었음을 의미한다(Piestun et al., 2017; Patael et al., 2019), 이러한 위성세포는 근육세포의 특성을 완전히 잃지 않고, 지방 축적과 더불어 근관 세포로의 말단 분화와 근섬유에 융합까지 진행을 한다. 위의 과정을 겪은 세포들은 근육세포의 표현형은 가지고 있지만, 일부 근섬유는 수축하는 능력을 잃어 근육으로서 고유기능을 일부 상실하고 근병증을 나타내기도 한다.
육계 병아리가 부화 직후 관리 과정 중에 만성 열 스트레스를 받게 되면 위성세포에 의한 근육성장과 근육구조(예, 적은 단백질과 많은 지방 축적)에 부정적으로 작용하며 지방 축적은 증가한다(Piestun et al., 2017; Patael et al., 2019). 열 스트레스, 특히 부화 후 초기 성장 기간 동안에 노출이 심하게 되면 근육상실로 이어지고, 근육조직 사이의 지방형성 전구세포가 증가, 인근 조직에서 지방세포의 보충, 최종적으로 근섬유 조직 사이에 섬유 조직 및 지방축적이 증가 한다. 이는 위성세포의 수적 감소와 근섬유의 기능적 이상 초래와 함께 일어날 수 있다(Piestun et al., 2017; Patael et al., 2019). 병아리가 부화 후 처음 2주 동안 비록 약하지만 낮은 수준의 열 스트레스를 받게 되어도 장기적으로 가슴 근육에 부정적 결과가 올 수 있다. 열 스트레스를 받은 닭의 가슴 근육은 근섬유와 지방 축적이 이루어진 영역 사이에 근병증의 대표적 형태인 많은 양의 축적된 콜라겐(섬유조직)을 볼 수 있다(Kuttappan et al., 2016; Patael et al., 2019). 가금류의 다양한 근막병인 백색 줄무늬(white striping), 나무 가슴 살(wooden breast), 스파게티 고기(spaghetti meat) 등은 체성장 및 특히 가슴 근육고기 생산 목적의 현대의 유전적 선발과 부정확 혹은 최적이 아닌 영양 및 관리 등에 의해 발생한다(Branciari et al., 2009; Kuttappan et al., 2016; Tonniges et al., 2019). 이러한 근막병증은 육류의 양과 품질에 엄청난 손실을 주어 가금 산업에 심각한 경제적 영향을 미친다(Kuttappan et al., 2016). 종합하면, 현대 육계는 높은 신진 대사와 열 생산, 그리고 혈액 공급이 부족한 생리적 조건을 지니고 있기 때문에 생애 전반 사육기간 동안 열 스트레스는 최소화되어야 하며, 특히 부화 초기의 열 스트레스 관리가 매우 중요함을 보여 준다.
육계의 사육환경에는 많은 스트레스 요인들이 있는데, 최적 환경에 맞지 않은 온도와 습도, 동물 무리간의 서열행동, 사료 내 오염된 독소 등은 시상하부 또는 근육세포 내 DNA와 히스톤의 구조적 변화를 유도하고 관련 유전자들의 발현에도 영향을 미친다(Fresard et al., 2013; David et al., 2017; David et al., 2019). 특히 초기 배아 발생기에는 환경에 매우 민감한 시기인데 작은 환경변화에도 그 이후 진행되는 세포분열에 영향을 미치게 된다. 자신의 체온조절과 피드백 기작이 아직 미숙한 동물의 생애 매우 이른 시기에 온도조작을 하게 되면 동물의 체온조절 역치 반응(thermoregulatory threshold response)이 변하게 된다(Yahav, 2000). 따라서 배 발생기 동안 온도 조작을 적용하게 되면 배아나 갓 부화된 병아리의 체온조절 역치 반응 변화를 효과적으로 유도할 수 있다. 이러한 온도 조작은 동물의 열 생산 역치 반응의 변화를 위한 시상하부-뇌하수체-갑상선 축의 발달과 스트레스 반응 증가를 회피하기 위한 시상하부-뇌하수체-부신 축의 발달과 연결되어 있다(Yahav et al., 2004). 가금류의 배아발달 단계 중 신체기능의 발달은 일찍 시작되는데, 배 발달의 중간과 후기가 온도 조절의 좋은 기간이며, 이 기간은 또한 체온조절과 관련된 시상하부-뇌하수체-갑상선 축과 스트레스와 연관된 시상하부-뇌하수체-부신 축이 발달하는 시기이다(Thommes et al., 1984; Tzschentke, 2007). 병아리는 배발생 8일과 12일 사이에 배아 내 갑상선과 부신축의 발달이 일어나는데 이 시기와 근섬유의 주요 부분이 생성되는 근신생(myogenesis)의 주요 단계와 대부분 겹친다(Thommes et al., 1984). 앞에서 기술한 것처럼 위성세포가 세포 분열하는 활성은 배아발생 15일과 19일 사이에 일어나며, 배아발생 17일에 최고에 이르고 시상하부-뇌하수체-부신 축도 이 기간 동안 활성화된다(Halevy et al., 2006; Piestun et al., 2009). 따라서 이 두 기간은 부화 후 열내성 증가와 근육 성장을 촉진시키기 위한 이상적인 온도조작 영역이 될 수 있다. 위와 같은 생리적 변화를 기반으로 2가지 방향의 연구들이 주로 진행되었는데, 첫 번째는 가금에서 부화 초기에 높은 환경온도에 노출시켜 온도 저항성을 향상시켜 체온감소, 폐사율 등을 낮추는 방법을 제시하였으나 사육환경을 정교하게 온도 조절하는 실용적 적용에 문제점이 있다(Yahav and Hurwitz, 1996; De Basilio et al., 2001). 두 번째는 실용적으로 현장에서 적용 가능한 방법으로, 열 조작을 배 발생단계에 실시함으로써 온도 저항성을 확보하는 것이다(Yahav et al., 2004).
온도조작 시점과 기간을 달리하면 장기적으로 열 내성과 가슴근육 성장에 다른 영향을 미치게 된다. 온도조작을 비교적 좁은 범위, 즉 매일 3시간 동안 39.5°C로 온도(대조구 37.8°C) 관리를 배발생 16일에서 18일까지 적용하였을 때 혈장 코티코스테론 감소와 함께 열내성 향상과 사육성적 및 가슴근육 성장에 대해 최적의 결과를 얻었다(Yahav et al., 2004). 그러나 매일 3시간 동안 배발생 8일부터 10일 사이, 혹은 16일부터 18일에 위와 같은 온도 조건으로 온도조작을 한 경우 모두 앞과 같은 열 내성 결과를 얻지 못하였지만 배발생 후기에서의 온도조작에서 가슴근육 성장이 향상된 경우도 있다(Collin et al., 2007). 온도조작(대조구 37.8°C: 처리구 39.5°C)을 앞에 연구자들보다 더 길게 설정하여 매일 12시간 배발생 7일부터 16일 사이에 적용한 경우 열 저항성, 생체중 및 근섬유 비대에 의한 가슴근육 성장이 부화 후 35일령뿐만 아니라 최대 70일 동안 오래 지속되었다(Piestun et al., 2013; Loyau et al., 2014). 배아기간의 온도조작에 대한 근육 성장 관련 장기 효과에 대한 현상은 근원세포 수의 증가에 의한 것이며, 이러한 추세는 부화 후까지 지속된다. 이러한 결과는 근육이 새롭게 만들어지는 과정에서 근육 전구세포의 잠재적 저장 능력의 증가로 해석된다(Piestun et al., 2015). 또 다른 원인은 유사한 온도관리 체계 하에서, 대조군과 온도 처리된 배아에서 취한 가슴 유래 주요 근육에 대한 유전체 microarray 분석에서 세포증식과 근육성장, 에너지 대사 및 미토콘드리아 기능, 그리고 혈관형성에 관여하는 유전자에 대한 다양한 발현 패턴을 보여줌으로써 온도조작에 대한 후성 유전적 효과를 확인해 준다(Loyau et al., 2016). 이상의 내용을 종합하면, 시상하부-뇌하수체-갑상선 및 부신 축의 발달 및 근육생성 과정에 대응하는 배아 발생 기간의 온도조작은 DNA와 히스톤의 구조적 변화와 이에 따른 특정 유전자 발현의 변화를 촉발하여 육계의 열 내성과 근육성장이 오래 지속될 수 있도록 유도하는 것으로 보인다.
열 스트레스에 대한 저항성을 높이기 위한 연구들이 위에 언급한 부화 기간 동안 온도조절 방법뿐만 아니라 부화 초기 온도 적응을 위한 방법들도 시도되고 있다. 이러한 접근법들은 발생 기간 동안이나 부화 후 이른 시기에 체온조절 체계의 결정적 발달 단계에 환경온도와 같이 생애 전반에 영향을 줄 수 있는 요소를 인위적으로 변화시킴으로서 후성유전학적 조절이 일어날 수 있도록 하는 것에 기반을 두고 있다(Tzschentke, 2007). 열 저항성에 대한 체온조절 기작은 혈중 갑상선 호르몬(T3)과 코티코스테론 호르몬 수준의 감소와 혈관운동성 반응의 변화로 체온이 떨어지게 된다(Yahav, 2000). 따라서 위에서 말한 결정적 단계가 열 저항성을 확보하는데 매우 중요한 요소가 된다. 닭 뇌의 발달과 체온조절 체계는 부화 후 처음 10일 안에 완성이 되고, 따라서 이 시기가 부화 후 병아리의 최적의 온도 조작기간이 된다(Arad, 1991). 육계가 부화 후 5일령에 온도조작으로 36°C에서 24시간 강도가 낮은 급성 열 스트레스에 노출시키고 시장출하 전에 육계가 높은 온도에 대한 적응도를 높일 경우 스트레스 노출 초기에 일시적 성장 지연이 있지만 4주령에는 보상성장이 완성되며, 육계의 체중 증가 및 발병율과 폐사율도 낮다(Yahav and Hurwitz, 1996; Yahav and Plavnik, 1999). 부화 후 1일령부터 5일령 사이 역시 강도가 낮은 36°C 혹은 37.5°C로 열 스트레스에 24시간 노출한 결과를 보면 3일령에 열 스트레스에 노출된 육계가 고온에 가장 잘 적응하고 갑상선호르몬(T3)의 감소와 더불어 증체와 시장 출하시 성적이 가장 좋게 나타난다(Yahav and McMurtry, 2001). 닭에서 위성세포의 증식(DNA 합성) 활성은 세포배양 시험뿐만 아니라 in vivo에서도 부화 후 3일에 최고에 달한다(Halevy et al., 2004). 이는 온도조작에 의한 위성세포 활성을 높이기 위한 가장 좋은 시기임을 알 수 있다. 부화 후 3일에 37.5°C로 열 스트레스에 24시간 노출하는 온도관리로 가슴근육의 위성세포의 수를 증가시켜, 결국 이는 시장 출하까지 근육세포의 분화를 촉진함으로서 가슴근육량을 높이는데 기여한다(Halevy et al., 2001). 온도관리에 대한 위성세포의 긍정적인 증식과 분화는 직접적인 열 효과보다는 간접적이고 전신적인 효과의 결과로 보인다. 온도조작에 의해 영향을 받을 수 있는 요인들을 살펴보면, HGF와 근육 IGF-I의 발현 유도인데 이들은 근육 스트레스를 받은 다음에 높게 발현되어 위성세포의 분화를 촉진하는 성장 인자들이다(Halevy et al., 2001; Goldspink et al., 2008). 온도조작에 반응하여 갑상선호르몬의 감소 또한 위성세포의 분화를 높이는데 영향을 미칠 수 있다(Yahav and Hurwitz, 1996; Yahav, 2009). 근원세포와 위성세포의 분화는 부화 후 세포주기의 중지와 근육 특이 유전자 발현 조절의 협업으로 이루어지며, 이때 MyoD계 전사인자(MyoD, Myf5, myogenin, MRF4)들이 근육발달 조절에 관여하게 된다(Weintraub, 1993). 휴지기의 위성세포는 MyoD계 전사인자들(myf5 제외)의 발현이 없지만, 상처 혹은 기계적 스트레스 등의 요인들이 주어지면 이들 전사인자들은 근원세포들의 증식과 더불어 시차적 형태로 발현되어 새로운 근관세포(myotube)를 형성한다(Cornelison and Wold, 1997). 그러나 과도한 열 스트레스 혹은 과도한 근육운동에 의한 스트레스는 체내 열조절 시스템을 불가역적으로 유도하여 근육의 손상을 일으킬 수 있으며 동물에게는 치명적일 수도 있다(Clarkson and Sayers, 1999). 따라서 앞에 언급한 것처럼 현재까지 연구 결과에서는 온도조작은 부화 후 3일령에 낮은 정도의 열 스트레스에서 24시간 노출이 최적의 증체와 근육생성 및 열 내성을 보인다. 그러나 열 저항성과 가슴 근육 성장 모두에 대한 긍정적인 결과에도 불구하고 실제 현장인 농장에서 적용할 수 있는지와 상업용으로 광범위하게 적용하기까지는 좀 더 연구가 필요하다.








