서 론
Coenzyme Q10(CoQ10)은 지용성 비타민과 유사하게 동물의 세포에 널리 발견되며(Battino et al., 1990), 미토콘드리아 세포막 전자전달계의 산화적 인산화 작용에 관여하여 ATP를 생산하는 대사 작용에 중요한 역할을 수행한다(Ernster and Dallner, 1995). 특히 대사 작용이 매우 활발한 간, 심장, 신장 및 근육 등과 같은 장기의 미토콘드리아에 CoQ10이 다량 존재하는 것으로 알려져 있다(Acosta et al., 2016). 장기 조직의 필수 성분인 CoQ10 결핍은 세포의 대사 및 미토콘드리아 기능 장애 등이 유발할 수 있는 것으로 보고되고 있다(Turunen et al., 2004; Gutierrez-Mariscal et al., 2020). 이러한 CoQ10의 생리적 기능과 더불어 CoQ10은 동물체 조직의 이중인지질막에도 존재하며 산화-환원(redox) 반응에 의한 항산화 작용에도 관여하는 것으로 최근 많은 연구에서 주목을 받고 있다(Quiles et al., 2005). CoQ10은 근육 세포주와 마우스 조직에서 발생하는 활성산소를 제거하여 지질과산화 반응을 억제하는 항산화 기능이 보고(Kamzalov et al., 2003; Bullon et al., 2015) 되었으며 비타민 C나 E보다도 항산화력이 강력한 것으로 알려져 있다(James et al., 2004; Niklowit et al., 2004).
Krizman et al.(2013)은 산란계에 CoQ10(5 mg/kg)을 급여하면 혈액, 간, 근육 등에서 CoQ10의 수준이 유의하게 증가하는 것을 보고하였다. 또한 육계(Arbor Acre, Cobb 400)에서 CoQ10 급여 시 조직의 항산화력이 증가되고 체 지방 함량이 감소되어 복수증(ascites)의 발병이 감소하는 것으로 나타났다(Geng et al., 2004; Gopi et al., 2014). 이러한 효과는 CoQ10 급여가 심장과 폐 조직의 미토콘드리아에서 세포호흡 과정의 효소 활성도 증가 및 항산화 작용 등에 의해 복수증 발생이 억제되었기 때문이다(Currie, 1999; Geng and Guo, 2005). Shetty et al.(2014)는 CoQ10 부족 시 미토콘드리아에서 tocopheroxyl radical 같은 활성 유해기의 발생이 증가함으로 CoQ10 급여는 산화작용을 억제하는 중요한 역할을 수행한다고 보고하였다. 최근에는 육용종계(Ross 308)에서 in ovo로 CoQ10을 투여하면 부화율, 성장, 면역 작용을 증가시킬 수 있다는 연구 결과도 보고되고 있다(Kalantar et al., 2019). 육계(Arbor Acre)의 체 조직과 난황에서 유발된 과도한 산화 스트레스가 부화율을 감소시킬 수 있음으로(Niu et al., 2009) 부화란에 CoQ10를 투여하면 난황에서 지방산의 β-산화작용을 억제하여 부화율 저하를 예방할 수 있다는 것이다(Kalantar et al., 2019).
여러 연구 결과로 보아 정상적 생리적 조건에서는 내생 CoQ10이 체 조직에 충분히 존재하기 때문에 비교적 큰 문제를 야기하지는 않지만 동물이 심한 대사 스트레스에 노출되는 상황에서 CoQ10 급여는 효과적인 것으로 보고되었다(Geng et al., 2004; Acosta et al., 2016). 닭은 간에서 체 지방의 80% 이상을 합성하며 고혈당과 고인슐린증이 빈발하게 나타난다(Walzem and Chen, 2014). 특히 생산성 향상을 위해 고도로 육종된 산란계의 경우 지방간 현상이 빈발하여 간 조직의 산화적 스트레스가 매우 심각하다(Julian, 2005; Trott et al., 2014; Lin et al., 2021). 따라서 산란계에 CoQ10을 급여할 경우 체 조직의 미토콘드리아 기능과 항산화 작용의 증진으로 대사작용으로 발생되는 산화 스트레스부터 신체를 방어하는 중요한 역할을 기대할 수 있다(Krizman et al., 2013; Jang and Moon, 2016). 육용종계 암탉에서도 CoQ10 급여 시 간 기능 장애와 체 지방을 감소시켜 미토콘드리아 대사 작용이 활성화되는 것으로 보고되었다(Sharideh et al., 2020). 따라서 산란에 따른 대사 스트레스가 높은 산란계에게 항산화 사료첨가제의 급여는 동물복지 사양관리 측면에서도 매우 중요한 방법이 될 수 있다.
현재까지 연구에 의하면 CoQ10 등과 같은 항산화제의 효과는 동물의 생리적 상태 및 내외적 스트레스 요인 등(Shekelle et al., 2003; Sohal et al., 2006; Acosta et al., 2016)과 더불어 첨가물질의 화학적 형태 역시 매우 중요한 요인으로 알려져 있다. 특히 친지질성의 항산화 물질은 지질에 유화시키면 닭의 소장에서 흡수가 쉬워 생체 이용률이 현저히 증가될 수 있다(Jang et al., 2014). 따라서 본 연구는 산란계에게 효과적으로 체내 흡수될 수 있는 유화 형태의 CoQ10을 급여하여 체 조직에서 항산화력, 항산화 효소 발현 및 지질과산화에 미치는 영향을 조사하였다.
재료 및 방법
본 시험에는 40주령의 Lohmann Brown 36수가 공시되었다. 완전 임의 배치법에 따라 대조군(CON), 분말 CoQ10 급여군(PCoQ, 100 mg/kg 사료), 유화 처리 CoQ10 급여군(ECoQ, 100 mg/kg 사료) 등 총 3 처리군에 케이지당 3수씩 배치하였다. 시험에는 분말(Purity 99.3% Coenzyme Q10, Inner Mongolia Kingdomway Pharmaceutical Limited, China)과 분말을 유화한 CoQ10을 사용하였다. CoQ10 유화는 옥수수유에 대두 lecithin을 0.4% 첨가하여 50°C에서 1시간 완전히 혼합하여 처리하였다. 기초 사료는 상업용 사료(Table 1)를 이용하여 분말 또는 유화 형태의 CoQ10을 사료 kg당 100 mg 수준으로 배합하였다. 사양시험은 40주령부터 45주령까지 5주 동안 실시하였으며, 시험기간 사료는 자유급이하고 자동급수기를 이용하여 음수를 공급하였다. 점등관리는 오전 6시부터 오후 9시까지 1일 15시간 실시하였으며 조도는 20 Lux로 설정하였다. 각 처리군당 12수로서 시험을 개시하였으나 카니발리즘 등에 의한 체중 감소가 발생한 개체는 시험 결과에서 제외하였다. 본 시험은 대학 종합농장 시설 사용 및 동물실험윤리위원회(2014-02) 규정을 준수하여 사양시험을 실시하였다.
DDGS: Distiller’s dried grains with soluble.
1 Contained per kg: vit A, 7,000,000 IU; vit D3, 1,500,000 IU; vit E, 10,000 IU; vit K, 1,000 mg; thiamin, 1,000 mg; riboflavin, 3,000 mg; pyridoxine, 6,000 mg; vitamin B12, 18 mg; biotin, 40 mg; folic acid, 400 mg; Mg, 150 mg; Cu, 8,000 mg; Fe, 40,000 mg; Zn, 60,000 mg; Co, 100 mg; I, 1,000 mg; Co, 100 mg; Se, 250 mg; Mn, 90,000 mg.
사양시험 종료 즉시 각 처리구당 평균 체중에 가까운 6수(n=6)를 선발하여 왼쪽 경정맥을 가위로 절개하여 채혈한 혈액은 sodium heparin이 함유된 진공 시험관에 넣어 3,000 rpm에서 20분간 원심 분리하여 혈장을 분리하였다. 간과 비장은 체중 100 g당으로 환산하여 표기하였으며 채취한 조직들은(혈장 및 간) −70°C 초저온 냉동고에 분석 시까지 보관하였다.
본 시험에 사용한 산란계 혈액의 항산화력 측정은 Total antioxidant power kit(Oxford Biomedical Res. TA02, UK)를 이용하여 ELISA(VMax, Molecular Devices, CA, USA)로서 450 nm에서 분석하였다. 표준용액으로서 Trolox를 사용하여 상대적 항산화력을 비교·분석하였다.
각 처리군 별로 선발한 산란계의 간 조직으로부터 RNAsolTM kit(TEL-TEST Inc, USA)을 이용하여 total RNA를 추출하였다. 조직을 RNAzol 용액에서 균질화한 후 chloroform을 혼합 후 원심분리하고 2-propanol으로 RNA를 침전시켜 분리하였다. RNA를 1 μg/μL 농도로 정량하여 Improm-II Reverse transcription system(Promega, Fitchburg, USA)을 이용하여 cDNA를 합성하였다.
Real-time PCR은 MyiQ(Bio-Rad Inc, USA)을 이용하여 다음과 같은 방법으로 실시하였다. PCR 반응물은 cDNA(10 ng) 5 μL, primer(5 pmole)는 각각 0.5 μL, SYBR Green 10 μL, ddH2O 4 μL를 넣어 총 20 μL가 되도록 혼합하고 95°C 3분간 최초 변성을 시킨 다음 95°C 15초간 변성, 60°C에서 15초간 접합, 72°C 40초간 확장과정을 40회 반복하였다. 이어서 94°C 1분간 재접합 과정을 거친 후 55°C에서 1분간 재 확장과정을 실시하였다. 마지막 과정으로 55°C에서 0.5°C씩 상승시켜 형광접합물질인 SYBR Green이 떨어져 나오는 마지막 과정을 수행하고 유전자의 상대적 발현량은 ΔCt값과 Livak and Schmittgen(2001)이 제시한 2−ΔΔCt 방법으로 표시하였다. Real-time PCR에 사용한 primer는 Table 2에 나타낸 바와 같다.
간 조직의 cytosol과 microsome 분획은 0.25 M sucrose 용액(0.25 M sucrose, 0.005 M MgCl2, 0.025 M KCl 및 0.008 M CaCl2 pH 7.4)에 조직을 균질화하여 10,000 × g에서 20분간 원심분리 후 상층액을 획득하였다. 이어서 초고속 원심분리기(Centrikon T-2080, Kontron Instruments, Switzerland)로 105,000 × g(1 시간)에서 원심 분리한 상청액은 cytosol, 펠렛은 1 ml의 1.15% KCl 용액에 균질화하여 microsome으로 분획하여 −70°C에 냉동 보관하였다. 간 조직의 superoxide dismutase(SOD) 활성도는 Fridovich(1974) 방법으로 측정하였다. 효소 활성도 측정 방법을 간단히 설명하면 반응용액에 xanthine oxidase를 혼합하여 0.02 abs/mL이 되도록 기준선을 설정하였다. 이어서 위의 혼합액에 시료를 가하여 반응개시와 동시에 cytochrome C의 분자 흡광계수로부터 SOD 활성도를 구하였다. 동일한 조건에서 cytochrome C 환원이 50% 억제되는 비율을 1 unit로 정의하였다. Glutathione peroxidase(GPX) 활성도는 Tappel et al.(1978) 방법에 따라 시료에 반응용액(0.1 mM NADPH, glutathione reductase 1 unit/mL, reduced glutathione, 0.25 mM; pH 7.4)을 첨가한 후 5분간 37°C incubator에서 저장하고 H2O2를 혼합하여 분광광도계에서 흡광도(340 nm)의 감소 속도를 측정하였다. GPX 활성도 unit는 단백질 mg당 1분 동안 산화되는 NADPH nmol 수로 정의하였다. Catalase(CAT) 활성도는 H2O2가 H2O와 O2로 분해되는 속도를 분광광도계(240 nm)로서 2분간 측정하여 조사하였다(Aebi, 1974). 1 unit 활성도는 25°C에서 분당 1 mM H2O2를 분해하는 효소량으로 정의하였다. Microsome의 지질과산화물은 thiobarbituric acid 방법에 따라 malondialdehyde(MDA) 생성량을 분광광도계(532 nm)로 흡광도를 측정하여 분석하였다(Bidlack and Tappel, 1973). 효소의 특이적 활성도는 전체 활성도에서 단백질 mg당 농도로 환산하여 표시하였다. 단백질 분석은 BCA kit(Thermo Scientific, USA)를 사용하여 ELISA(560 nm)로 측정하였다.
각 처리군의 결과를 평균±표준편차로 표시하였고 통계 처리는 처리에 따른 Proc GLM(SAS Institute Inc., Cary, NC, US, 1996)에 의한 일원 분산분석을 실시하였다. F-값의 유의성이 인정될 경우 Tukey 방법으로 95% 수준(P<0.05)에서 유의성을 검정하였다. 분석결과에 대한 증가 또는 감소 경향성은 85% 수준(P<0.15)에서 인정 범위로 하였다.
결 과
본 연구는 산란계를 이용하여 대조군(CON), CoQ10 분말 급여군(PCoQ), CoQ10 유화 처리군(ECoQ) 등 3군으로 설정하여 5주간 사양 시험을 실시하고 체내 항산화 방어 작용 지표를 조사하였다. 먼저 시험 기간 동안 체중의 변화, 시험 종료 후 간 및 비장의 무게를 측정한 결과는 Table 3 및 4에 각각 제시하였다. 100 mg/kg 수준의 분말 또는 유화 CoQ10을 급여한 사양 시험 결과, 산란계의 체중 및 증체는 처리간 차이가 없는 것으로 나타났다. 간 및 비장의 상대적 무게(g/100 체중) 역시 이들 CoQ10 급여 및 급여원에 따른 유의한 영향은 없었다.
Mean±SD (n=9).
| Item | Treatment1 | ||
|---|---|---|---|
| CON | PCoQ | ECoQ | |
| Liver, g/100 g BW | 2.06±0.23 | 1.98±0.15 | 2.08±0.48 |
| Spleen, g/100 g BW | 0.12±10.02 | 0.11±0.03 | 0.12±0.02 |
Mean±SD (n=6).
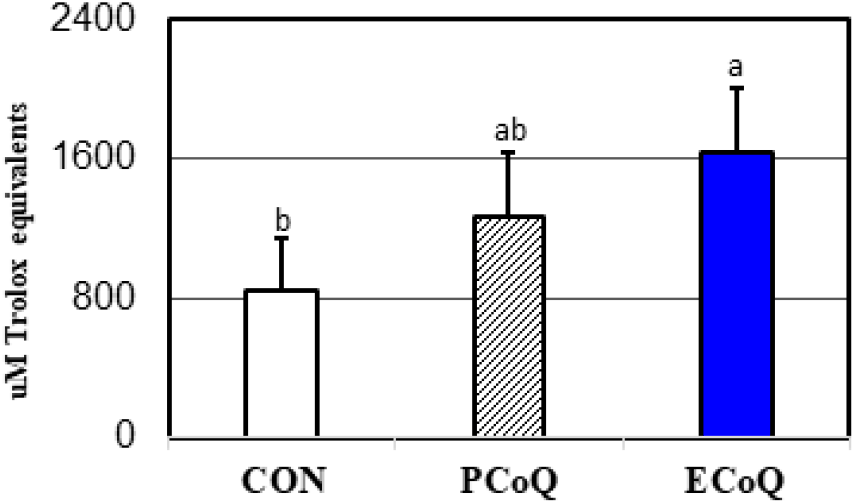
본 시험의 산란계에게 CoQ10 급여 후 혈액에서 분석한 전체 항산화력(total antioxidant power, TAP)의 결과는 Fig. 1에 제시된 바와 같다. 5주간 CoQ10 급여 후 산란계 혈액의 전체 항산화력(TAP)은 ECoQ군(1,638.9±367.3)에서 대조군(840.72±96.3)보다 약 2배 정도 유의적으로(P<0.05) 증가하였다. 그러나 PCoQ군은 대조군과 비교 시 약 1.5배 정도 전체 항산화력(TAP)이 증가하였으나 유의적 차이 없이 증가하는 경향(P<0.07)을 보였다. 한편 ECoQ군과 PCQ군 간에도 유의차 없이 ECoQ군에서 전체 항산화력(TAP)이 증가하는 경향(P<0.13)을 보였다(Fig. 1).
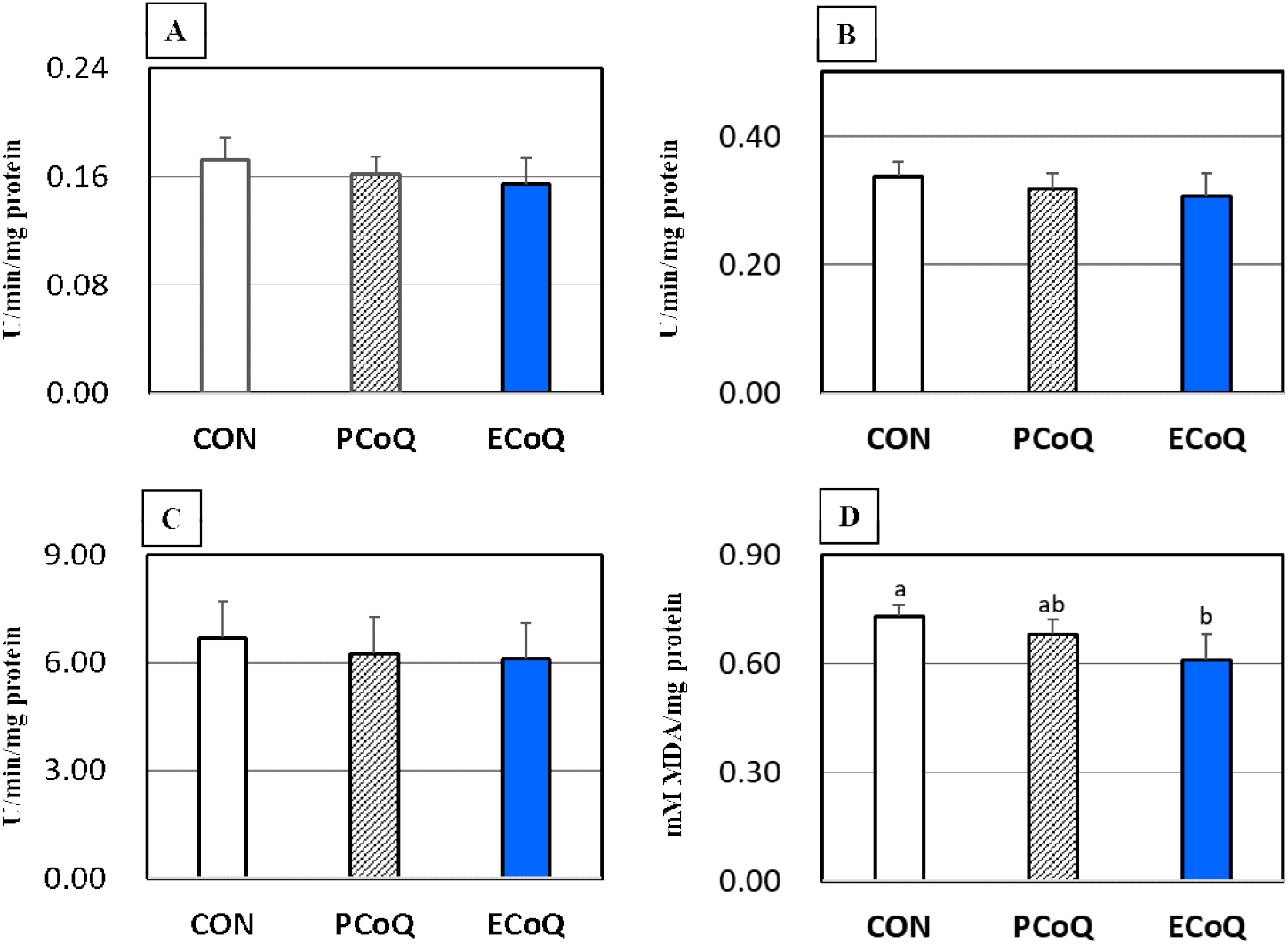
분말 및 유화 CoQ10 급여 후 산란계의 간 조직에 존재하는 항산화 효소의 mRNA 발현 및 특이적 활성도를 조사한 결과는 Table 5 및 Fig. 2에 각각 나타낸 바와 같다. SOD, GPX 및 CAT 등 항산화 효소들의 mRNA 발현은 대조군과 PCoQ군 또는 ECoQ 군간에는 유의적 차이가 없는 것으로 나타났다(Table 5). 간 조직에서 이들 항산화 효소들의 mRNA 발현은 대조군과 비교 시 PCoQ군 또는 ECoQ군간에 SOD mRNA 발현은 평균 0.46-0.78배, GPX mRNA 발현은 0.28-0.38배, CAT mRNA는 0.34-0.36배 낮은 발현 양상을 보였다. 항산화 효소의 특이적 활성도를 조사한 결과 역시 대조군과 비교 시 분말 또는 유화 CoQ10 급여에 따른 유의적 차이는 없었다(Figs. 2A, 2B and 2C). 그러나 산란계 간 조직의 지질과산화(lipid peroxidation) 지표는 ECoQ군에서 대조군보다 유의하게(P<0.05) 낮은 것으로 나타났다(Fig. 2D). 분말 및 유화 CoQ10 급여군간 지질과산화도 비교 시 유의적 차이가 나타나지 않았다.
Mean±SD (n=6).
고 찰
닭에서 CoQ10 첨가사료를 급여하면 혈액, 간 등의 조직에서 CoQ10 수준이 증가하고 체 조직의 산화 스트레스와 지방량이 감소하여 대사성 질병이 저하되는 것으로 보고되고 있다(Geng et al., 2004; Honda et al., 2013; Gutierrez-Mariscal et al., 2020). 따라서 본 연구는 과도한 산란 스트레스로 지방간 현상이 다발하는 산란계에게 CoQ10(100 mg/kg 사료)을 급여하여 혈액과 간 조직의 항산화 작용에 미치는 효과를 조사하였다. 또한 친지질 성분인 CoQ10의 생체 이용성을 높이기 위해 유화 형태로 첨가 급여 시 이들 항산화 지표에 미치는 효과에 대해서도 조사하고자 하였다. 본 연구에서는 산란계에 분말 및 유화 CoQ10을 5주간 급여한 결과와 유사하게 Geng et al.(2004)는 육계에서 CoQ10(20 및 40 mg/kg 사료)를 36일간 급여 시 체중, 사료 섭취량, 사료요구율 및 장기 무게(비장 및 심장)에는 영향을 미치지 않았으나 복수증을 예방하여 치사율이 현저히 감소하는 것으로 보고하였다. 또한 Sharideh et al.(2020)은 암컷 육용종계에서 CoQ10(300, 600 및 900 mg/kg 사료)를 8주간 급여 시 체중 및 간의 중량에는 영향을 미치지 않았으나, 체 지방을 감소시키는 효과가 있음을 보고하였다. 이상의 연구 결과들로 보아 사료 내 100 mg/kg 수준의 CoQ10 급여는 산란계에서 체중과 간, 비장 등 장기의 무게에는 유의한 영향이 없는 것으로 생각된다.
본 연구에서 CoQ10 급여 후 산란계의 혈액에서 전체 항산화력(TAP)은 ECoQ군에서 TAP가 현저하게 증가하였으나 간 조직에서 SOD 등 조사한 항산화 효소의 mRNA 발현과 효소 활성도는 CoQ10 급여에 따른 유의적 차이가 없었다. 한편 간 조직의 지질과산화도는 CoQ10 급여군에서 감소하였으며 특히 ECoQ군에서 지질과산화도가 현저히 저하되었다. Bayril et al.(2020)의 연구에서는 메추리에게 CoQ10 급여 시 혈액과 간 조직 SOD 효소 활성도에는 영향을 미치지 않았지만, 혈액의 지질과산화도를 현저히 감소시키는 효과가 있음을 보고하여 본 시험과 유사한 결과를 보였다. Geng and Guo(2005)는 육계에 CoQ10(40 mg/kg)을 급여한 결과 복수증 발생이 감소하였으며 이는 간 조직 내 미토콘드리아의 항산화 능력 및 세포호흡 관련 효소들의 활성화에 의해 기인된다고 보고하였다. 사람과 설치류를 이용한 많은 연구에서 CoQ10 급여 시 혈액과 간 조직에서 지질과산화도를 현저히 감소시키며 이러한 효과는 체 조직의 산화-환원 반응과정에서 CoQ10의 항산화 작용 때문인 것으로 보고하였다(Weber et al., 1994; Sohet et al., 2009). 체 조직에서 CoQ10 항산화 효과는 ascorbic acid와 α-tocopherol보다도 훨씬 우수한 것으로도 알려져 있다(Weber et al., 1994).
체 조직에서 SOD, GPX, CAT 등과 같은 항산화 효소들은 지질과산화를 유발하는 산화적 스트레스 요인들을 제거하는 작용을 하는 것으로 잘 알려져 있다(Aebi, 1974; Fridovich, 1974; Tappel, 1978). 본 시험 결과 산란계에서 CoQ10이 항산화 효소들의 발현을 증가시키지는 않았지만 Frei et al.(1990)에 의하면 간 조직의 미토콘드리아 전자전달계에서 CoQ10이 직접 산화-환원 반응에 관여하여 항산화력을 증진시킬 수 있다고 하였다. 마우스에서 CoQ10은 혈장, 간 및 심장 조직에서 내생 비타민 E의 축적을 강화해 간접적으로 항산화 작용을 증강하는 작용도 보고되고 있다(Kamzalov et al., 2003). 본 연구에서는 CoQ10 급여 시 산란계에서 간 조직의 항산화 효소들의 발현은 유의적 차이는 없었지만 오히려 낮게 유지되는 경향을 보였다. 이러한 것은 CoQ10이 직접 산화-환원 반응을 통해 활성 산소를 제거하였기 때문에 항산화 효소들의 발현이 감소하는 것으로도 해석할 수 있다. 그러나 실험동물을 이용한 일부 연구에서 CoQ10이 SOD와 GPX 활성도를 증가시켜 지질과산화와 DNA 손상을 예방하는 역할이 있다는 보고도 있다(Wang et al., 2008).
CoQ10이 체 조직의 항산화력에 미치는 작용 기전과 효과는 동물의 생리적 상태, 질병, 연령, 사료 오염, 화학적 급여 형태 및 수준 등에 따라 다양한 차이가 있는 것으로 알려져 있다(Kamzalov et al., 2003; Sohal et al., 2006). Sharideh et al.(2020)의 연구에 의하면 간 기능 장애와 비만 등이 다발하는 육용 종계(암탉)에서 CoQ10 급여 시 체 지방을 감소시키고 미토콘드리아 대사 작용을 활성화해 더욱 긍정적인 영향을 미친다고 보고하였다. 또한 사료에 곰팡 독소 오염에 의한 간 조직의 손상이 발생할 경우 CoQ10 급여가 매우 효과적으로 조직을 보호할 수 있다(Maruyama et al., 1995). 이는 CoQ10의 항산화 작용에 의해 곰팡이 독소에 의해 유발되는 지질과산화물로부터 간 조직의 손상을 보호할 수 있기 때문으로 해석된다(Frei et al., 1990). 이러한 여러 연구 결과들을 종합하면 CoQ10이 체 조직에서 활성산소를 제거하는 직간접적인 항산화 방어 기전에 중요한 역할을 하는 것은 명확한 것으로 보인다.
닭의 경우 콜레스테롤의 주요 합성 장소인 간에서 난황 콜레스테롤의 약 95%를 공급한다(Elkin et al., 2006). Honda et al.(2013)은 산란계에 CoQ10을 급여하였을 때 계란의 난황에서 콜레스테롤의 함량이 약 13% 감소하는 사실을 보고하였다. 또한 Sharideh et al.(2020)도 암컷 육용 종계에 CoQ10 급여 시 간 조직에서 PPAR-α 발현을 증가시켜 지방분해를 통한 에너지 대사 작용을 촉진하는 것으로 보고하였다. 닭의 간 조직에서 콜레스테롤 합성 효소인 HMG-CoA reductase(HMGCR)의 활성이 CoQ10에 의해 억제되기 때문이다(Honda et al., 2010). 본 연구팀의 이전 연구에서도 산란계에게 CoQ10을 급여한 결과 간 조직에서 HMGCR의 유전자 발현이 50% 억제되는 것을 확인한 바 있다(Jang and Moon, 2016). 이러한 결과로 보아 닭에게 CoQ10 급여 시 간 조직에서 콜레스테롤 합성 저하와 에너지 대사 작용을 촉진하여 간 조직의 산화적 손상 또한 감소시킬 수 있는 것으로 추론된다.
산란계에 CoQ10 급여 시 혈액 및 간 조직에서 CoQ10의 수준이 증가하는 것으로 보고되었다(Kamisoyama et al., 2010). 본 연구 결과 분말 형태 급여보다 유화형 CoQ10 급여가 산란계에서 항산화 방어능력을 보다 안정적으로 높이는 것으로 생각된다. 이와 같은 결과는 대두 레시틴(soybean phospholipid)으로 유화한 CoQ10을 산란계에게 급여 시 분말 형태보다 체내 이용률이 증가하였기 때문으로 해석할 수 있다. 인지질(phospholipid)로서 식물성 carotenoid 성분을 유화하면 미셀화 작용으로 소장에서 흡수율이 증가하여 생체 이용률이 현저히 증가하는 것으로 알려져 있다(Marisiddaish and Baskaran, 2009). 랫드에서 carotenoid 성분으로 lutein을 유화할 경우 분말 형태보다 동물의 소장에서 빨리 흡수되어 혈액으로 이동한다는 결과가 보고된 바 있다(Mamatha and Baskaran, 2011).
위 결과를 종합해보면 분말형보다 유화형태의 CoQ10 급여가 산란계에서 혈액의 전체 항산화력을 높이고 간 조직에서 발생하는 활성산소를 효율적으로 제거하여 지질과산화도를 감소시키는 것으로 나타났다. 산란 스트레스로 간의 대사율이 매우 높고 혈액 순환 증가에 따른 심장의 부담이 증가하는 산란계에서 분만형태보다는 체내 이용율이 높은 유화 CoQ10은 건강한 닭을 사육할 수 있는 항산화 사료첨가제로서 가치가 높을 것으로 생각한다.








