서 론
가축의 질병치료와 성장촉진을 위한 항생제 남용은 항생제 내성균(antibiotic resistant bacteria)의 발생을 초래하였다 (Martínez, 2008; Zhu et al., 2013). 이에 따라 현재 많은 국가에서 성장촉진을 위한 항생제 사용은 금지되고 있으며, 질병치료를 위한 항생제 사용 또한 항생제 잔류 문제를 일으킬 수 있어 항생제를 대체할 수 있는 물질에 대한 연구가 활발히 이루어지고 있다(Lillehoj and Lee, 2012; Wang et al., 2019).
항균펩타이드(antimicrobial peptides)는 항생제 대체물질 중 하나로서 12에서 50개 사이의 아미노산으로 구성된 펩타이드로서 박테리아, 바이러스, 곰팡이 등 다양한 병원체를 사멸시켜 선천성 면역에서 중요한 방어기작을 담당하고 있다(Kang et al., 2017; Wiesner and Vilcinskas, 2010). 항균펩타이드는 주로 양이온의 특징을 갖고 있기 때문에, 음이온 특징을 갖는 그람 음성균(gram-negative bacteira)의 lipopolysaccharides(LPS)와 그람 양성균(gram-positive bacteria)의 lipoteichoic acids에 결합하여 박테리아의 세포막을 파괴한다. 그 밖에 다른 항균펩타이드는 박테리아 내부의 DNA나 RNA에 붙어 증식을 억제할 수 있다(Jenssen et al., 2006). 위와 같은 항균효과 이외에도 항균펩타이드는 사이토카인 (cytokine)의 생성을 유도하고 상처를 치유하고 면역세포 증식 등을 증가시키는 등 다양한 면역조절 작용을 하는 것으로 알려져 있다(Hong et al., 2020a; Hong et al., 2020b; Otvos Jr, 2016).
NK-lysin은 주로 natural killer(NK)세포와 T 림프구에서 생성되며 항균 및 항암효과가 있다고 알려져 있다(Hong et al., 2006; Lee et al., 2014). NK-2는 돼지의 NK-lysin의 39–65 아미노산 부분인 α-helix region을 갖는 펩타이드로서 여러 병원체를 사멸시키는 효과를 가지고 있다(Jacobs et al., 2003; Andrä et al., 2004; Schröder-Borm et al., 2005).
닭의 NK-lysin은 Eimeria 감염 닭의 장 림프구(Intestinal lymphocytes)에서 많이 발현되었으며, 돼지의 NK-2 부분에 해당하는 닭의 NK-2(cNK-2) 또한 항균효과를 가지고 있어, 닭에서 콕시듐증(Coccidiosis)을 일으키는 E.tenella와 E. acervulina의 포자소체를 사멸시켰다(Lee et al., 2013). 그 밖에도 cNK-2는 닭의 대식세포주(HD11)와 단핵구(primary monocytes)에서 CCL4, CCL5, IL-1β와 같은 케모카인 (chemokine)과 사이토카인의 발현을 증가시켰으며, p38과 ERK1/2, c-Jun N-terminal kinases (JNK)를 통해 mitogen-activated protein kinase (MAPK) signaling pathway를 유도하는 것으로 나타났다 (Kim et al., 2017).
본 연구에서는 항생제 대체제로서 NK-lysin의 활용가능성을 확인하기 위하여 닭과 돼지의 NK-lysin의 39-65 아미노산 부분인 NK-2를 조합한 펩타이드(cpNK)와 cpNK로부터 크기를 줄인 두 개의 펩타이드 (cpNK-a1, cpNK-a2)의 항균효과를 E. coli, S. Enteritidis, S. Enteritidis, S. Typhimurium, S. Cholerasuis, L. monocytogenes, S. aureus와 같은 병원균과 메티실린 (meticillin) 내성균을 이용하여 측정하였다.
재료 및 방법
닭의 NK-2 (39-65 aa)와 돼지의 NK-2 (39-65 aa)를 조합한 chimeric 펩타이드 (cpNK)와 cpNK의 서열을 기반으로 짧은 서열의 펩타이드인 cpNK-a1과 cpNK-a2를 90%의 순도로 ㈜펩트론 (Daejeon, Republic of Korea)에서 주문 제작하여 사용하였다 (Table 1).
합성된 펩타이드들의 항균효과를 검증하기 위해 그람 음성균인 Escherichia coli ATCC 43888, Salmonella enterica serovar Enteritidis YHS 383, Salmonella enterica serovar Typhimurium ATCC 43174, Salmonella enterica serovar Choleraesuis YHS 386와 그람 양성균인 Listeria monocytogenes ATCC 19115 and Staphylococcus aureus ATCC 27664를 37°C에서 tryptic soy broth (TSB) (Sigma, St. Louis, MO, USA)에 16시간 배양하였다. 배양된 박테리아를 PBS (pH 7.4)를 이용하여 5.0×105 colony-forming units (CFU)/mL이 되도록 희석하였다. 25 μL의 희석된 박테리아에 농도에 맞게 희석된 펩타이드를 처리한 뒤 37°C에서 4시간 배양하였다. 배양 후 standard colony counting assay를 통해 박테리아의 CFU를 측정하였다.
항생제 내성균을 이용한 항균효과 검증을 위해 Methicillin-susceptible strain인 S. aureus RN4220와 Meticillin-resistant strain인 S. aureus MW2와 S. aureus USA300을 Luria-Bertani (LB) broth (Sigma)에 배양 후, 5 × 103 CFU의 박테리아에 25, 50 μg/mL의 cpNK를 처리하여 37°C에서 2, 4시간 배양한 뒤 colony counting assay를 진행하였다 (Yeaman et al., 1992; Xiong et al., 2005).
펩타이드의 molecular weight과 theoretical isoelectric point (pI), hydrophobicity는 Peptide Analyzing Tool (https://www.thermofisher.com/kr/ko/home/life-science/protein-biology/peptides-proteins/custom-peptide-synthesis-services/peptide-analyzing-tool.html)을 통해 측정되었다. 펩타이드 구조는 RaptorX (http://raptorx.uchicago.edu/)를 통하여 예측하였다.
결 과
닭과 돼지의 NK-2를 조합한 펩타이드인 cpNK의 구조를 분석한 결과, cpNK의 네 번째 아미노산인 arginine부터 24번째 아미노산 threonine까지 α-helix 구조를 형성하는 것으로 나타났다 (Fig. 1). 또한 cpNK의 pI값은 12.3으로 procine NK-2와 chicken NK-2보다 높은 것으로 나타났으며 전기적 전하는 porcine NK-2와 같은 +9로 나타났다 (Table 1).

cpNK 펩타이드의 항균효과를 측정하기 위하여 그람 음성균인 E. coli ATCC 43888, Salmonella enterica serovar Enteritidis YHS 383, Salmonella enterica serovar Typhimurium ATCC 43174, Salmonella enterica serovar Choleraesuis YHS 386와 그람 양성균인 Listeria monocytogenes ATCC 19115 and Staphylococcus aureus ATCC 27664과 반응시킨 뒤 세포 생존율(%)을 구하였다 (Fig. 2). E. coli는 0.5 μg/mL의 cpNK에 의해 세포생존율이 25.4%로 감소하였으며, 4 μg/mL의 cpNK에서는 0%의 생존율을 보였다. S. Enteritidis는 4 μg/mL의 cpNK를 처리했을 때 유의적으로 생존율이 5.7%로 감소하였다. S. Typhimurium은 1 μg/mL의 cpNK를 처리시 생존율이 46.6%로 유의적으로 감소하였으며, 4 μg/mL의 cpNK는 모든 S. Typhimurium이 사멸한 것으로 나타났다. S. Choleraesuis도 S. Typhimurium에서와 마찬가지로 1 μg/mL부터 생존율이 유의적으로 감소하였으며 4 μg/mL의 cpNK를 처리했을 때 20.8%의 생존율이 나타났다. 그람 양성균인 L. monocytogenes는 10 μg/mL의 cpNK 처리 후부터 유의적으로 생존율이 감소하였으며, 20과 40 μg/mL의 cpNK에 의해 0%의 생존율을 보였다. 또 다른 그람 양성균인 S. aureus의 경우 5 μg/mL의 cpNK에 의해 2.7%의 생존율을 보였다.
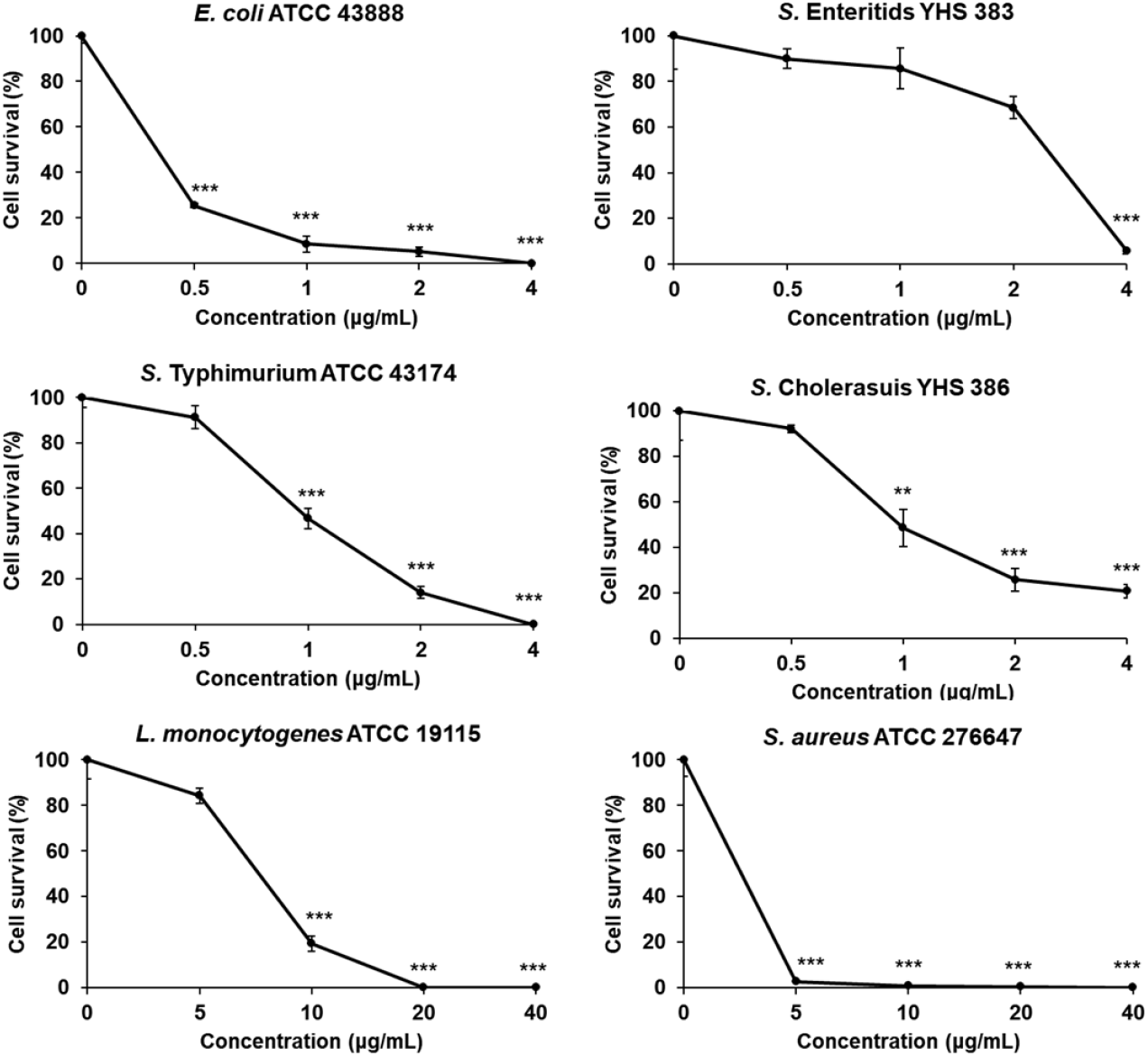
항균효과 검증 실험을 통하여 cpNK는 그람 양성균 보나 음성균에서 더 높은 항균효과를 보여주었으며, 또한 모든 병원체에서 cpNK의 농도가 높아질수록 항균효과가 증가하는 것으로 나타났다.
병원균뿐만 아니라 메티실린 내성 포도상구균 (Methicillin-resistant S. aureus, MRSA)인 S. aureus MW2와 USA300에 대하여 cpNK가 항균효과를 보이는지 실험을 진행하였다. cpNK를 2시간 처리하였을 때, MRSA인 MW2는 25 μg/mL의 cpNK에 의해 36.3%의 생존율을 보였으며, 50 μg/mL의 cpNK에선 25.8%의 생존율을 보였다 (Fig. 3). USA300은 25 μg/mL의 cpNK에 의해 46.5%의 생존율을 보였으며, 50 μg/mL의 cpNK에선 41%의 생존율을 보였다. pcNK를 MW2에 4시간 처리했을 경우, 25 μg/mL에선 13.1%, 50 μg/mL에선 3.6%의 생존율을 보였다. USA300에 cpNK를 4시간 처리했 을 때, 25 μg/mL에선 20.2%, 50 μg/mL에선 7.0%의 생존율을 보였다. 항생제 내성이 없는 RN4220의 경우, cpNK를 2시간 처리한 경우 25 μg/mL에선 1.7%, 50 μg/mL에서는 0.3%의 생존율을 보였다. 또한, 25와 50 μg/mL의 cpNK를 4시간 처리했을 때에 RN4200은 모두 0%의 생존율을 보였다.
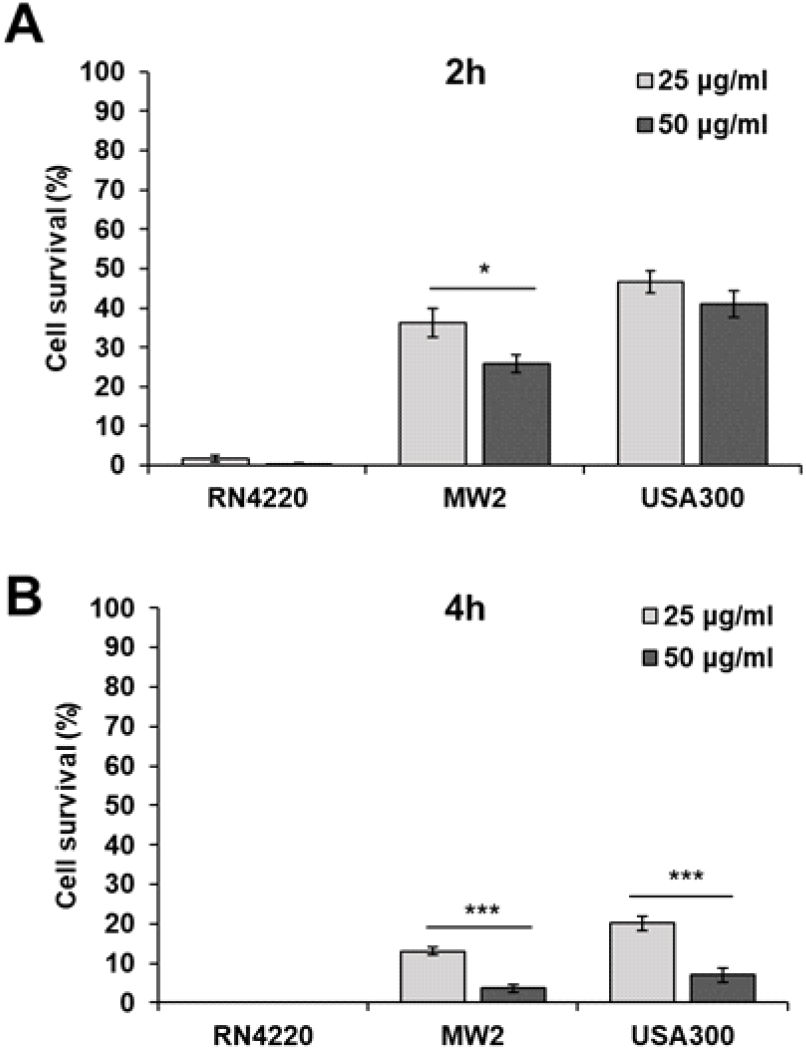
위의 결과를 통해 cpNK펩타이드는 두 개의 MRSA 박테리아 중 S. aureus MW2에서 더 높은 항균효과를 나타내는 것을 알 수 있었다.
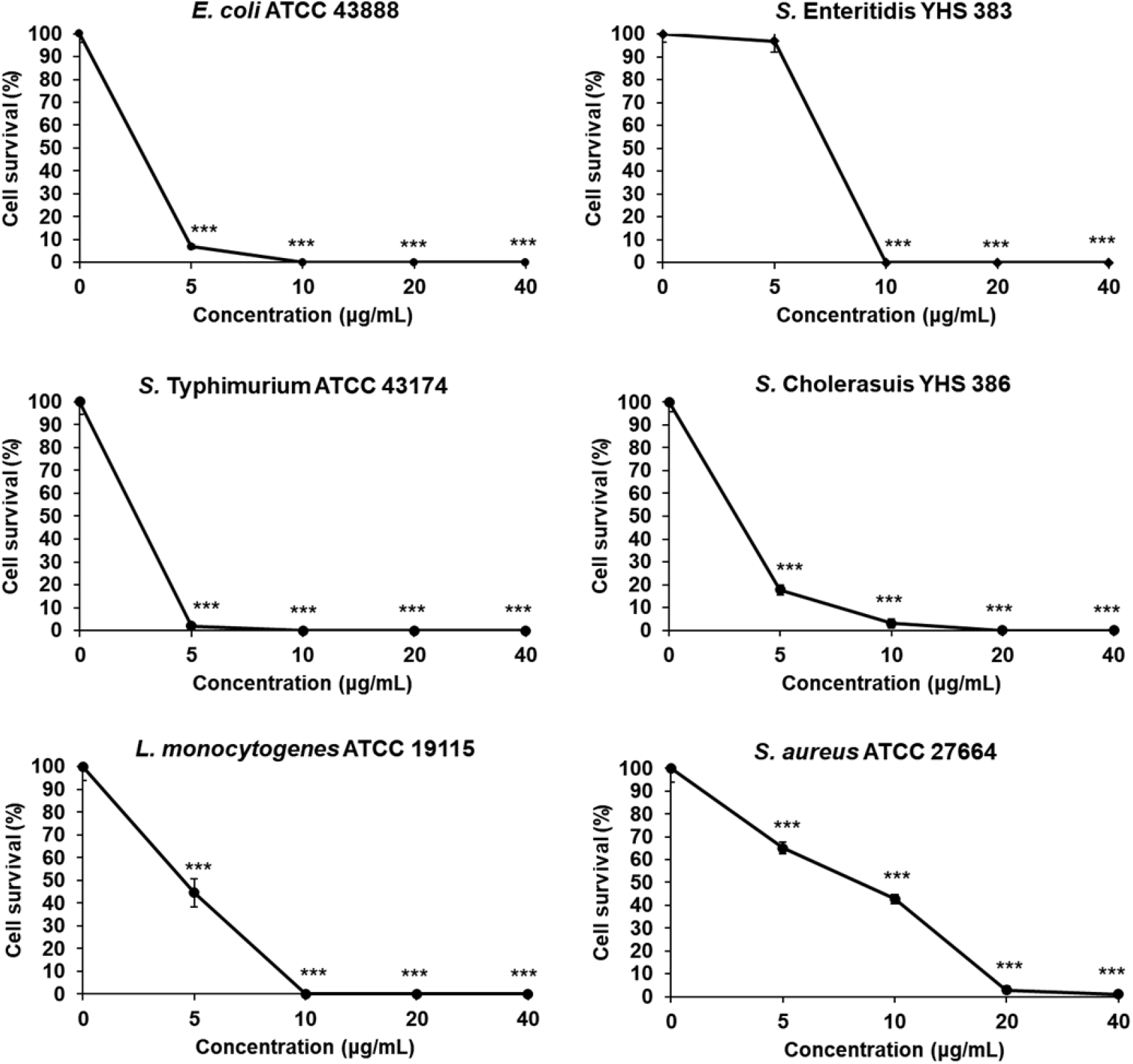
27aa의 cpNK chimeric 펩타이드에서 실제 항균효과를 보이는 core region을 찾기 위해 6aa를 줄인 cpNK-a1 (Fig. 4)와 14aa를 줄인 cpNK-a2 (Fig. 5)의 항균효과를 검증하였다. cpNK-a1를 E. coli에 처리할 경우, 5 μg/mL 부터 유의적으로 생존율이 감소하였으며 10, 20, 40 μg/mL에서 모두 생존율이 0%였다 (Fig. 4). S. Enteritidis는 cpNK-a1에 의해 생존율이 5 μg/mL을 처리했을 때 96.9%의 생존율을 보였지만 10 μg/mL부터는 모두 0%의 생존율을 보였다. S. Typhimurium은 5 μg/mL의 cpNK-a1를 처리하였을 때, 1.9%의 생존율을 보였으며 10 μg/mL부터는 0%로 나타났다. S. Cholerasuis는 5 μg/mL의 cpNK-a1에 의해 17.7%의 생존율을 나타냈으며, 20 μg/mL부터 0%가 나타났다. 그람 양성균인 L. monocytogenes의 경우 5 μg/mL의 cpNK-a1에 의해 생존율이 44.5%로 낮아졌으며 10 μg/mL부터는 0%였다. S. aureus는 5 μg/mL의 cpNK-a1부터 유의적으로 생존율이 감소하였으며, 40 μg/mL에서는 0.9%의 생존율을 보였다.
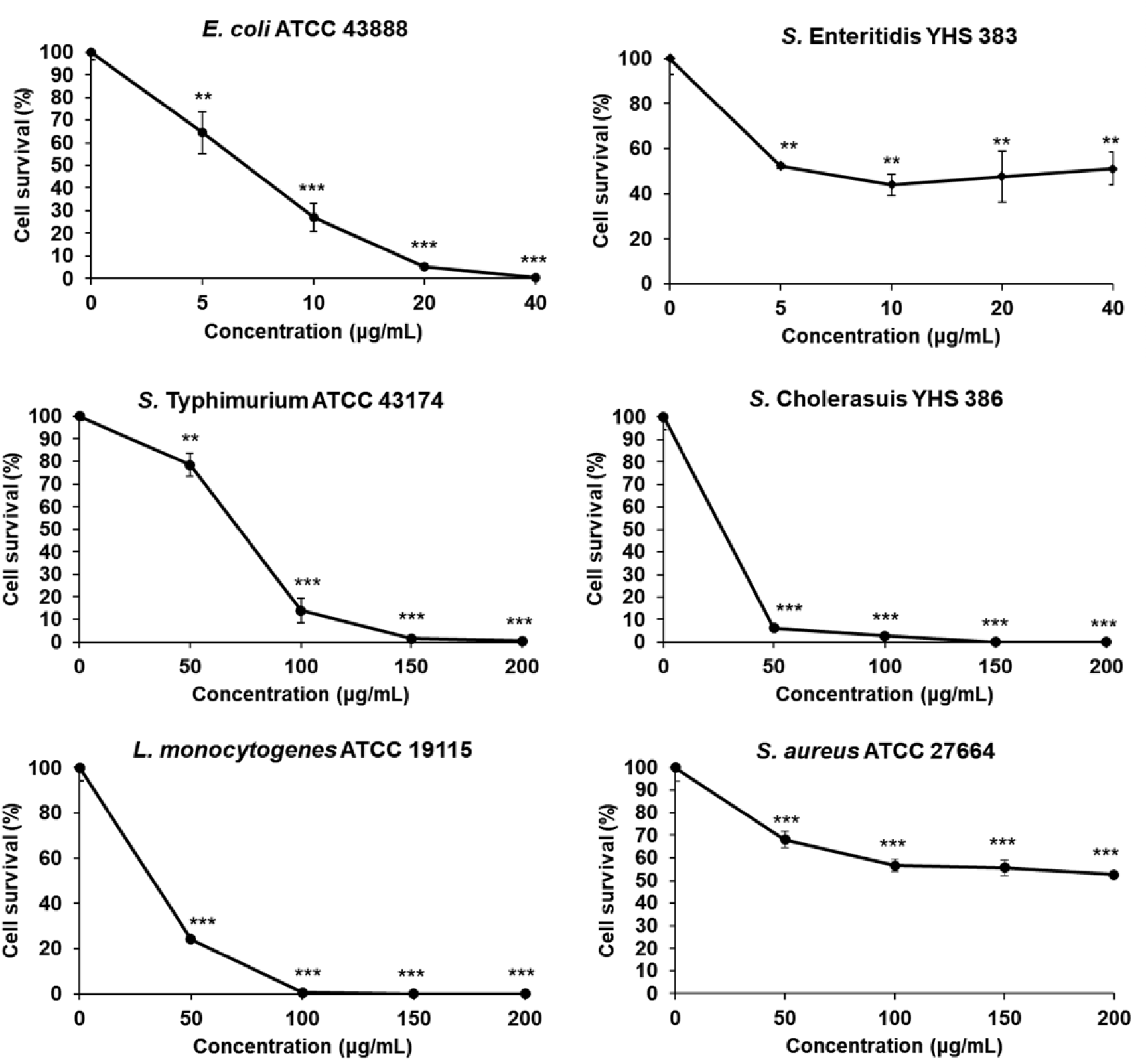
13개의 아미노산으로 구성된 cpNK-a2를 E. coli에 처리시 5 μg/mL부터 생존율이 유의적으로 감소하였으며, 40 μg/mL에는 0.5%의 생존율이 측정되었다 (Fig. 5). S. Enteritidis는 5~40 μg/mL의 cpNK-a2에 의해 44.0에서 52.4% 사이의 생존율을 보였다. cpNK-a2를 S. Typhimurium에 처리시, 50 μg/mL에서 생존율 78.5%로 유의적으로 감소하였으며, 200 μg/mL에서는 0.5%의 생존율로 나타났다. S. Cholerasuis는 50 μg/mL의 cpNK-a2에 의해 생존율이 6.2%로 감소하였으며, 150 μg/mL부터는 0%로 측정되었다. L. monocytogenes는 50 μg/mL의 cpNK-a2에서 생존율이 24.1%였으며, 150 μg/mL부터는 0%였다. S. aureus는 50 μg/mL의 cpNK-a2에 의해 68.0%로 생존율이 감소하였으며, 200 μg/mL에서는 52.6%로 측정되었다.
따라서 27개의 아미노산인 cpNK 펩타이드로부터 변형된 21개의 아미노산의 cpNK-a1는 그람음성균과 양성균에서 모두 좋은 항균효과를 보였으며, 40 μg/mL의 농도에서는 100%에 가까운 항균효과를 보여주었다. 13개의 아미노산으로 구성된 cpNK-a2는 cpNK-a1에 비해 낮은 항균효과를 나타냈으며, 100 μg/mL 이상의 농도에서 높은 항균효과를 나타내었다.
고 찰
항균펩타이드는 선천성 면역에서 중요한 역할을 하는 펩타이드로서 숙주가 병원균에 감염이 되었을 때, 직접적으로 병원균을 사멸시키거나 면역반응을 조절하는 것으로 알려져 있다 (Kang, Kim, Seo and Park, 2017). 본 연구에서는 닭과 돼지의 항균펩타이드 NK-lysin의 한 부분인 NK-2를 조합한 chimeric 펩타이드 (cpNK)의 항균효과를 측정하였다. cpNK는 E. coli, Salmonella spp., L. monocytogenes, S. aureus 와 같은 병원균과 메티실린 항생제 내성균에 대한 항균효과를 보였다.
항균펩타이드는 α-helix와 β-sheets 등의 구조를 갖고 있는데, 특히 α-helix 구조가 항균효과에 큰 영향을 미친다 (Jenssen, Hamill and Hancock, 2006; Kang, Kim, Seo and Park, 2017). α-helices를 갖는 항균펩타이드는 박테리아의 세포막에 잘 결합하여 “Carpet” 또는 “Barrel-Stave” 메커니즘을 통해 세포막을 파괴할 수 있다 (Zelezetsky and Tossi, 2006; Huang et al., 2010). NK-2는 NK-lysin의 5개의 α-helix 구조 중 helix 3에서 5를 포함하는 부분이다 (Lee et al., 2013). 닭과 돼지의 NK-2를 조합한 cpNK chimeric 펩타이드의 구조를 예측한 결과 역시 α-helix 구조를 나타냈으며, 강력한 항균효과를 나타내었다 (Figs. 1 and 2). 또한 펩타이드의 charge값은 양전하 아미노산은 +1을 하고 음전하 아미노산은 −1을 함으로서 계산되었는데, 돼지의 NK-2와 cpNK의 charge 값은 +9로 가장 높게 나타났다. 이를 통해 음전하를 띄는 LPS와 lipoteichoic acids에 대한 항균펩타이드의 결합력이 증가하므로 항균효과 또한 증가할 것으로 예상된다.
본 연구에서 사용된 E. coli ATCC 43888은 E. coli O157:H7로 알려져 있으며, Shiga toxin을 생성하여 사람에서 출혈성대장염 (hemorrhagic colitis)과 용혈성요독증후군 (hemolytic uremic syndrome)을 일으키는 박테리아이다 (Lim et al., 2010). S. Enteriditis는 사람에서 식중독을 일으키는 주요 박테리아이며 S. Enteritidis에 감염된 닭으로부터 사람에게 전달될 수 있다 (Vaz et al., 2020). S. Typhimurium역시 식중독을 일으키는 박테리아로서 살모넬라증 (Salmonellosis)의 99%를 차지한다 (Lamas et al., 2018). S. Choleraesuis는 주로 돼지에서 파리티푸스 (paratyphoid)를 일으키며, 사람에게 감염될 경우 장염 및 폐혈증을 유발할 수 있다 (Chiu et al., 2004). L. monocytogenes는 주로 반추동물에 감염 시 리스테리아증 (listeriosis)을 일으키며 사람에게 감염이 일어날 경우, 패혈증, 뇌수막염 등을 일으킨다 (Lecuit, 2020). S. aureus는 사람에게 감염 시 entrotoxin을 생성하여 식중독을 일으킬 수 있으며, 그 밖에 여러 감염과 연관된 증상을 일으킨다 (Madahi et al., 2014). 위와 같이 사람 및 가금류에서 질병을 일으키는 병원균에 대하여 cpNK 펩타이드는 강력한 항균효과를 보여주었으며, 뿐만 아니라 메티실린 내성균인 S. aureus MW2와 USA300에서도 항균효과를 보여주어 항생제 대체제로서의 활용 가능성을 확인할 수 있었다.
cpNK 펩타이드는 그람 양성균보다 음성균에서 더 높은 항균효과를 보여주었는데, 그람 양성균의 두꺼운 peptidoglycan은 항균펩타이드와 세포막의 결합을 방해할 수도 있다 (Malanovic and Lohner, 2016). 이로 인해서 그람 음성균과 양성균에서 항균효과 차이를 보이는 것으로 생각된다.
강력한 항균효과를 갖는 cpNK 펩타이드의 핵심 부위를 찾고, 펩타이드의 길이를 줄여 합성 비용을 절감하면서 cpNK와 비슷한 항균효과를 나타내는 부분을 찾기 위해 21aa의 cpNK-a1과 13aa의 cpNK-a2의 항균효과를 측정한 결과, cpNK-a1이 cpNK-a2보다 더 좋은 항균효과를 보였으며, cpNK 보다는 낮은 항균효과를 보여주었다. 이전 연구에 의하면 길이가 짧은 항균펩타이드의 경우 세포막의 길이보다 짧아 막을 파괴하기 어렵다는 결과가 있었다 (Gagnon et al., 2017). 이에 따라 cpNK-a1와 a2는 cpNK보다 길이가 짧아 박테리아 세포막을 커버하는 범위가 cpNK보다 적을 것이라고 예상할 수 있으며, 또는 짧은 펩타이드 길이 때문에 α-helix 구조가 잘 형성되지 않았을 것으로 예상된다.
본 연구에서 in vitro 항균효과를 나타낸 cpNK, cpNK-a1, cpNK-a2 펩타이드가 항생제 대체제로서 활용되기 위해선 in vivo 실험이 추후 필요할 것으로 예상된다. In vitro와 다르게 in vivo 실험을 진행할 경우, 이미 숙주의 면역계에 의해 발현되는 다양한 항균펩타이드들의 효과가 동반되기 때문에 cpNK, cpNK-a1, cpNK-a2 펩타이드의 항균활성 농도 범위가 달라질 수 있다. 또한 항균펩타이드를 가축사료첨가제로서 사용할 경우, 가축의 소화기관에서 펩타이드의 안전성을 확보해야 하며, 감염된 목적 기관으로 효율적으로 전달될 수 있어야 하므로 전달 매개체에 대한 연구가 필요하다.
결론적으로, 이번 연구에서는 닭과 돼지의 NK-lysin에서 항균효과를 보이는 부분인 NK-2를 조합한 펩타이드의 항균효과를 확인하였다. 그 결과, cpNK는 E. coli, S. Enteritidis, S. Typhimurium, S. Choleraesuis, L. monocytogenes, S. aureus에 대해 강력한 항균효과를 보여주었으며 그 밖에 메티실린 내성균인 MRSA MW2와 USA300에 대해서도 항균효과를 나타내었다. 이를 통해 cpNK를 항생제 대체제로서 활용할 수 있는 가능성을 확인할 수 있었으며, 효율적인 펩타이드 생산과 효과적인 숙주 내 전달 방법에 대한 추가적인 연구가 필요할 것으로 생각된다.








