Article
토종 종계 부계의 텔로미어 길이와 자식의 생산능력 간의 연관성 분석
김보경1
,
손시환2,†
Association between Paternal Telomere Length and Offspring Production Performance in Korean Native Chickens
Bo Gyeong Kim1
,
Sea Hwan Sohn2,†
Author Information & Copyright ▼
1Graduate Student, Division of Animal Bioscience and Integrated Biotechnology, Gyeongsang National University, Jinju 52725, Republic of Korea
2Professor, Division of Animal Bioscience and Integrated Biotechnology, Gyeongsang National University, Jinju 52725, Republic of Korea
© Copyright 2022, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 30, 2022; Revised: Sep 14, 2022; Accepted: Sep 16, 2022
Published Online: Sep 30, 2022
적요
본 연구는 한국 토종닭을 대상으로 부계의 텔로미어 길이가 수정 능력 및 배아 발생 능력에 미치는 영향을 알아보고, 부계의 텔로미어 길이와 자식의 생산능력 및 자식의 텔로미어 길이와의 연관성을 살펴보고자 하였다. 시험에 공시된 닭은 토종 종계 수컷 22수와 이들로부터 생산된 자식 329수를 대상으로 하였다. 부계의 번식 능력으로는 수정율, 배자발육중지율 및 부화율을 조사하였고, 자손의 생산 능력으로는 생존율, 체중 및 증체량을 분석하였다. 텔로미어 길이는 34주령 부계와 12주령 자식의 백혈구 세포 내 telomeric DNA 함량을 양적 형광접합보인법으로 분석하였다. 분석 결과, 부계의 텔로미어 길이에 따른 수정율, 배자발육중지율 및 부화율의 차이는 없는 것으로 나타났고, 부계의 텔로미어 길이와 수정률 및 배자발육중지율 간에는 낮은 부(−)의 상관을, 부화율과는 낮은 정(+)의 상관을 보이나 이들의 상관계수는 유의하지 않은 것으로 나타났다(P>0.05). 부계의 텔로미어 길이와 자식의 생존율 간의 상관 계수는 0.17로 유의하지 않은 낮은 정의 상관이 추정되었다(P>0.05). 부계의 텔로미어 길이에 따른 자식의 성장 능력 분석에서 부계 텔로미어 길이가 긴 집단의 자식들이 상대적으로 낮은 성장 능력을 보이고 이들 간의 상관은 거의 모든 주령에서 유의한 부의 상관 계수가 추정되었다(P<0.05). 부계의 텔로미어 길이와 자식의 텔로미어 길이 간의 상관 계수는 0.075로 추정되어 부계와 자식 간 텔로미어 길이의 연관성이 없는 것으로 나타났다. 이상의 결과로부터 부계의 텔로미어 길이와 번식 능력, 자식의 초기 생존율 및 자식의 텔로미어 길이 간에는 거의 연관성이 없는 것으로 보여지고, 부계의 텔로미어 길이와 자식의 성장 능력 간에는 부의 상관이 있는 것으로 생각된다. 이는 배아 초기 단계에서 텔로미어의 reprogramming에 의해 발생 시 모든 개체의 텔로미어 길이가 재 신장되고 이후 연령이 증가함에 따라 감축의 정도가 달라지기 때문에 나타난 결과로 사료된다.
ABSTRACT
The effect of paternal telomere length on reproductive performance, relationship between paternal and offspring telomere length, and association between paternal telomere length and offspring production performance were investigated in Korean native chickens. Using 22 paternal chickens and 329 offspring, the paternal reproductive performance such as fertility, embryo mortality, and hatchability, as well as the offspring production performance such as survival rate, body weight, and weight gain were analyzed. Telomere length was analyzed through quantitative fluorescence in situ hybridization using lymphocytes. No significant differences were observed in fertility, embryo mortality, and hatchability between paternal chicken telomere lengths (P<0.05). These results indicate that paternal telomere length had a weak negative correlation with fertility and embryonic death rate but a weak positive correlation with hatchability. The correlation coefficient between paternal telomere length and offspring survival rate was r=0.17 (P>0.05). The group of offspring with long paternal telomeres showed relatively poor growth performance. Moreover, a significant negative correlation was estimated between paternal telomere length and offspring growth performance (P<0.05). The correlation coefficient between paternal and offspring telomere lengths was r=0.075 (P>0.05). In conclusion, there was a weak association between paternal telomere length and reproductive performance, offspring survival rate, and offspring telomere length, respectively. However, paternal telomere length and offspring growth performance showed a negative relationship. Such results could be due to the re-extension of telomere length by telomere reprogramming in the early embryonic stage and the different degree of telomere shortening between individuals with increasing age after birth.
Keywords: 텔로미어 길이; 수정률 및 부화율; 생존율; 산육 능력; 토종닭
Keywords: telomere length; fertility and hatchability; survival rate; growth performance; chicken
서 론
진핵생물의 염색체 말단부를 지칭하는 텔로미어(telomere)는 TTAGGG의 단순 반복 염기서열과 특정 단백질로 구성되어있으며 염색체를 보호하는 역할을 한다(Blackburn, 1991). 그러나 세포 분열시 DNA가 복제되는 과정에서 지연 가닥의 말단이 소실됨으로 세포 분열이 진행될수록 텔로미어 길이는 짧아지고, 일정 길이 이하가 되면 세포 사멸이 일어난다(Levy et al., 1992; Kowald, 1997). 따라서 텔로미어 길이는 노화 및 개체의 생리활성도를 나타내는 직간접적 표지로 이용된다(Harley, 1991; Faragher and Kipling, 1998; Shay, 1999; Sohn et al., 2012).
닭의 텔로미어 기능과 텔로머라제(telomerase)의 활성은 인간과 유사함으로 발생 생물학, 신경 생물학, 비교 생리학 등의 연구에 좋은 표본일 뿐만 아니라 노화 연구의 모델 동물로 이용된다(Taylor and Delany, 2000; Delany et al., 2003; Cho et al., 2005; Jung et al., 2006; Swanberg and Delany, 2010). 닭의 텔로미어 길이는 유전적 요인과 연령 및 여러 환경적 요인에 의해 영향을 받는 것으로 알려져 있다(Beloor et al., 2010; Kim et al., 2011; Sohn and Subramani, 2014; Cho et al., 2022). 동일 연령에서 닭의 텔로미어 길이는 품종 및 계통별 유의한 차이가 있는 것으로 알려져 있는데 로드 종, 레그혼 종 등이 육용종인 코니시 종보다 텔로미어 길이가 상대적으로 길고, 동일 품종내 계통 간에도 차이가 있다고 하였다(Sohn et al., 2014; Cho et al., 2016, 2020, 2022). 또한 품종이나 계통과 관계없이 거의 모든 닭에서 연령이 증가할수록 텔로미어 길이는 짧아진다고 하였다(Kim et al., 2011; Cho et al, 2022). 그러나 텔로미어 길이의 감축 정도는 사육 환경과 밀접한 관련이 있는데 사육밀도가 높을수록, 사료 섭취량이 많을수록 텔로미어 길이의 감축 정도가 컸고(Beloor et al., 2010; Sohn et al., 2012; Sohn and Subramani, 2014), 케이지 사육 개체가 평사 사육 개체에 비해 감축 속도가 빨랐다고 하였다(Sohn et al., 2011; Choi et al., 2020). 한편 개체의 텔로미어 길이와 생산 형질 간의 관계에 있어서 생존율과는 정(positive)의 상관을 보여 생존율이 높은 집단일수록 텔로미어 길이가 상대적으로 길다고 하였다(Cho et al., 2020, 2022; Park et al., 2016). 반면 산란 형질과 텔로미어 길이 간에는 거의 연관성이 없는 것으로 분석되었고 체중과 같은 성장 형질과는 부(negative)의 상관을 보여 체중이 무거울수록 텔로미어 길이가 짧다고 하였다(Cho et al., 2016; Park et al., 2016). 이는 개체의 텔로미어 길이가 강건성과는 정의 관계가 있으나 성장 능력과는 부의 관계가 있다는 것으로 체중이 큰 개체들이 대사 및 환경적 요인에 더욱 민감하게 반응하여 텔로미어 길이의 단축이 촉진됨을 시사하였다. 이처럼 개체의 텔로미어 길이와 생산 형질 간의 관계에 관하여 일부 연구가 진행되긴 하였으나 양친의 텔로미어 길이가 수정 능력이나 자손의 발생 능력에 어떠한 영향을 미치는지, 또한 발생한 자식의 생산 능력에 미치는 영향에 대해서는 아직 밝혀진 바가 없다.
따라서 본 연구에서는 한국 토종닭을 대상으로 부계의 텔로미어 길이가 수정 능력 및 이들 배아의 발생 능력에 미치는 영향을 알아보고 또한 부계의 텔로미어 길이와 자식의 생산능력과 연관성 및 부계와 자식 간 텔로미어 길이의 연관성을 살펴보고자 하였다.
재료 및 방법
1. 공시동물
본 시험은 ㈜한협원종이 생산한 토종닭 종계 수컷 22수와 수컷당 암컷 15수씩을 공시하고 이들로부터 생산된 자식 암수 329수를 대상으로 하였다. 종계의 사양관리는 경상국립대학교 종합농장 내 무창계사로 설비된 종계사에서 군사 케이지 당 수컷 1수당 암컷 7~8수씩 합사(900 cm2/1수)하여 52주간 사육하였고, 사료 급여는 사육단계별로 어린 병아리, 중 병아리, 산란 전기, 산란 초기 및 산란 중기로 나누어 상업용 시판 종계 사료로서 자유 급여하였다. 점등 관리 및 백신 접종은 ㈜한협원종의 종계 사양관리 지침에 따라 실시하였다. 자식들의 사양관리는 12주간 실시하였고 전 기간 강제 환기 및 자동 온도조절 시스템이 완비된 육추사에서 3단 2열 배터리형 케이지에 사육하였다 (580cm2/1수). 사료 급여는 발육 시기에 따라 초이, 육계 전기 및 육계 후기 사료로 나누어 자유 급여하였다. 점등 관리는 전 기간 23L:1D로 하였고, 사양 기별 백신 접종은 한협 토종닭 백신 프로그램에 따라 수행하였다. 그 밖의 사양관리는 경상국립대학교 닭 사육관리지침에 따라 실시하였고, 시험에 관련된 닭의 관리 및 취급은 본 대학 동물실험윤리위원회(IACUC, No. 2020-5)의 승인을 얻은 후 규정에 따라 시행하였다.
2. 번식 및 배아 발생 능력 분석
부화에 공시한 종란은 34주령 때 부계별 20개씩 수집하여 총 440개를 입란하였다. 부화 개시 후 7일째 검란하여 무정란과 초기 배자발육중지란을 판정하였고, 발생좌로 이송하는 18일째 검란하여 후기 배자발육중지란을 판정하였다. 부화 종료 시점에 파각하지 못한 부화란에 대해서는 할란검사를 실시하여 사롱란으로 판정하였다. 수정률은 입란한 전체 종란에서 무정란을 제외한 유정란의 비율로 계산하였다. 배자발육중지율은 유정란 대비 중지란의 발생 비율로 계산하였다. 부화율은 유정란 수 대비 부화한 병아리 수의 비율로 나타내었다.
3. 생산능력 분석
토종닭 종계가 생산한 자식들의 생산능력으로 생존율, 체중 및 증체량을 조사하고 분석하였다. 생존율은 1일령부터 12주령까지 입실 수 대비 종료 시 생존 수수에 대한 백분율로 나타내었다. 체중은 발생 시부터 12주령까지 2주 간격으로 개체별 체중을 조사하였고, 증체량은 동일 시점에서 체중 증가량으로 나타내었다.
4. 양적 형광접합보인법을 이용한 텔로미어 길이 분석
부계 및 자식의 텔로미어 길이는 백혈구 세포 내 telomeric DNA의 상대적 함량으로 제시하였다. 백혈구 표본은 34주령 부계 및 12주령 자식의 익 정맥에서 혈액을 채취한 후 Ficoll(GE Healthcare, Sweden)로서 백혈구만 분리하고 이를 저장, 고정 처리하여 제작하였다. Telomeric DNA의 상대적 함량 분석은 Sohn et al. (2012)이 제시한 양적 형광접합보인법(Quantitative Fluorescence in situ Hybridization)으로 수행하였다. 이를 간략히 소개하면 제작된 백혈구 표본 슬라이드에 hybridization 용액(13μL formamide, 5μL hybridization buffer, 200ng telomeric DNA probe)을 처리하고 85°C에서 5분간 변성, 38°C에서 12시간 이상 접합하였다. 처리가 완료된 표본은 2 × SSC 용액과 PN buffer(0.1% sodium phosphate, 0.1% Nonidet P-40)로 세척하고 anti-digoxigenin-fluorescein(Boehringer Mannheim, Indianapolis, IN, USA)으로 형광 접합 후 propidium iodide solution(Sigma, St. Louis, USA)으로 염색하였다. 텔로미어의 발현 양상은 간기 상태의 핵을 형광현미경(Model AX-70, Olympus, Tokyo, Japan)으로 관찰하고 개체 별 100개 이상의 핵을 대상으로 핵내 telomeric DNA의 분포량을 이미지 분석프로그램(MetaMorph®, UIC, Pennsylvania, USA)으로 분석하였다.
5. 통계처리
부계의 텔로미어 길이와 번식 형질 및 자식의 생산능력과의 연관성은 SAS 통계 패키지(SAS Institute Inc., Cary, NC, USA)의 CORR procedure를 이용하여 상관 계수를 추정하여 분석하였고, 부계의 텔로미어 길이에 따른 자식 생산능력의 비교 분석은 동일 통계 패키지의 ANOVA procedure를 이용하여 처리 간 평균값의 유의성을 검정하였다.
결과 및 고찰
1. 부계의 텔로미어 길이 분석
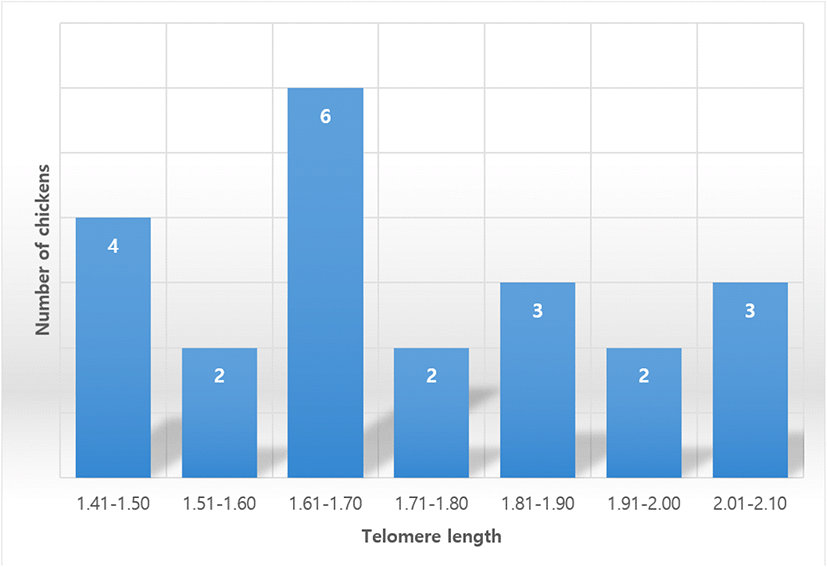
부계의 텔로미어 길이는 34주령 토종 종계 22수를 대상으로 개체별 백혈구 세포의 telomeric DNA 함량으로 분석하였다. 분석 결과, 텔로미어 길이는 1.41에서부터 2.04까지 나타났고 전체 부계의 평균 텔로미어 길이는 1.71±0.20이었다. 대상 집단 내 텔로미어 길이의 분포 양상과 개체 빈도는 Fig. 1과 같다. 닭의 텔로미어 길이에 관한 연구로서 국내 토종닭 12개 품종에 대한 평균 텔로미어 길이를 분석한 결과, 8주령 2.87±0.08, 20주령 2.38±0.12 및 50주령 1.42±0.11로 제시하였고(Cho et al., 2022), 텔로미어 길이에 따른 연령 예측 지표 분석에서 30주령 때 단관백색레그혼 종의 텔로미어 길이는 1.81±0.42, 40주령 때는 1.57±0.23으로 보고하였다(Kim et al., 2011). 또한 닭의 스트레스 반응 정도 비교 연구에서 20주령 토종 종계의 텔로미어 길이는 2.41±0.22(Cho et al., 2016), 12주령 토종실용닭은 2.68±0.13으로 보고하였다(Sohn et al., 2022). 이러한 결과에 따라 닭의 텔로미어 길이는 품종과 무관하게 공히 연령이 증가함에 따라 일정하게 감소하고 연령별 텔로미어 길이는 품종 간 다소의 차이는 있지만 거의 비슷한 경향을 보인다. 본 연구에서 제시한 34주령 토종 종계의 평균 텔로미어 길이 또한 지금까지 보고된 결과와 거의 유사한 값을 나타내고 있다.
2. 부계의 텔로미어 길이가 번식 및 배아 발생 능력에 미치는 영향
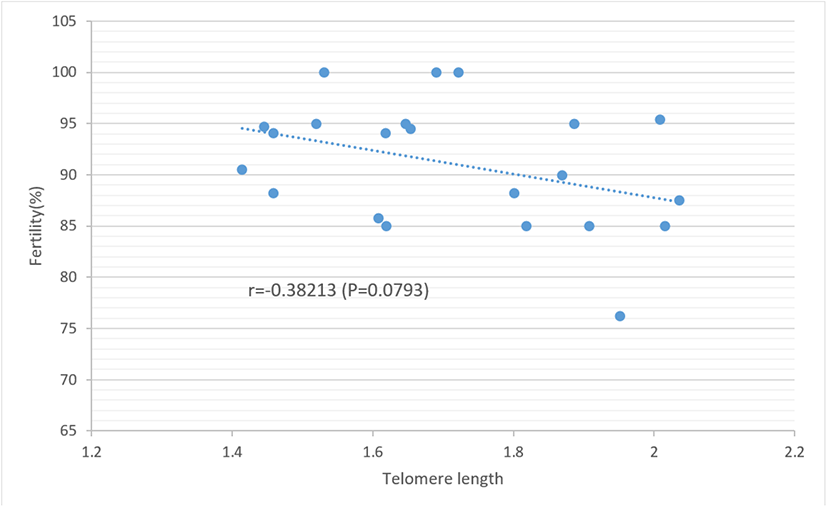
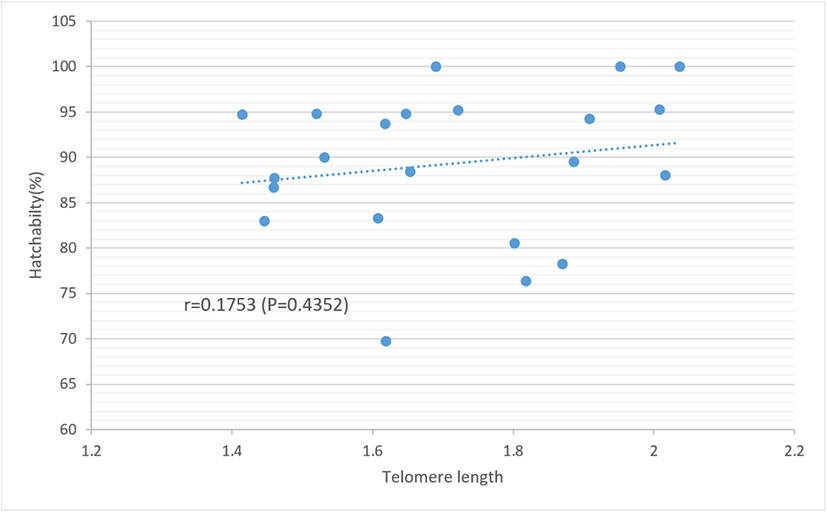
부계의 텔로미어 길이가 번식 및 배아 발생 성적에 미치는 영향을 알아보기 위하여 부계의 텔로미어 길이를 장단에 따라 3개의 군으로 구분하고(1.41-1.60, 1.61-1.80, 1.81-2.04) 이들 길이에 따라 수정률, 초기 배자발육중지율, 후기 배자발육중지율 및 부화율을 조사하여 이의 결과를 Table 1에 제시하였다. 분석 결과, 부계의 텔로미어 길이에 따른 수정율, 배자발육중지율 및 부화율의 차이는 없는 것으로 나타나 부계의 텔로미어 길이가 수정률 및 배아 발생 성적에 거의 영향을 미치지 않는 것으로 보여진다. 부계의 번식 능력과 텔로미어 길이 간의 연관성을 보다 구체적으로 살펴보기 위하여 이들 간의 상관관계를 분석한 바 부계의 텔로미어 길이와 수정률 간에는 낮은 부(−)의 상관(r=−0.38)이 추정되었다(Fig. 2). 또한 부계의 텔로미어 길이와 배자발육중지율 간의 상관관계에서 초기 배자발육중지율과는 r=−0.15, 후기 배자발육중지율과는 r=−0.1로 추정되어 이들 간 역시 낮은 부의 상관을 보이고, 부계의 텔로미어 길이와 부화율 간에는 r= +0.18로서 낮은 정(+)의 상관이 추정되었다(Fig. 3). 부계의 텔로미어 길이와 수정율 및 배자발육중지율 간에는 부의 상관이, 부화율과는 정의 상관이 있지만 이들 모든 항목 간의 상관 계수는 유의하지 않은 것으로 분석되었다(P>0.05). 닭의 수정율과 부화율은 유전적 요인과 환경적 요인이 모두 작용하여 영향을 미치나 유전력이 대부분 0.1 이하로 추정되어 거의 환경적 요인에 의해 좌우되는 형질임을 시사한다(Sapp et al., 2004; Wolc et al., 2019; Mookprom et al., 2021). 배자발육중지율과 부화율은 유전적 요인보다는 종란의 보관 기간, 보관 온도, 모계의 연령, 부화 시 온도, 습도 및 전란 등의 요인이 더욱 큰 영향을 미치는 것으로 보고하고 있다(Reijrink et al., 2009; Hamidu et al., 2011; Gucbilmez et al., 2013; Ishaq et al., 2014; Pokhel et al., 2018; Choi and Sohn, 2020). 그러나 유전적 요인으로 품종에 따른 수정률 및 부화율의 차이도 나타나는데 체중이 낮은 품종이 높은 품종보다 수정률이 높다고 하였다(Witt and Schwalbach, 2004; Malago and Baitilwake, 2009; Wang et al., 2020). 본 실험 결과 부계의 텔로미어 길이와 배아 발생 능력 간에는 연관성이 없는 것으로 나타났는데 이는 배아 초기 단계에서 텔로미어 길이의 reprogramming이 일어나 배자 상태에서 텔로미어 길이가 다시 일정 수준을 유지한다는 이론에 따른 것이 아닌가 생각된다(Lanza et al., 2000; Park and Sohn, 2014).
Table 1.
Effect of paternal telomere length on the hatching performance in Korean native chicken
| Paternal telomere length |
Fertility |
Early embryonic mortality |
Late embryonic mortality |
Hatchability |
| ---------------------------------- % ---------------------------------------- |
| 1.41-1.60 |
92.61±4.80 |
3.02±5.16 |
8.37±5.89 |
88.63±4.85 |
| 1.61-1.80 |
93.83±5.59 |
6.00±5.17 |
5.07±6.31 |
88.95±10.46 |
| 1.81-2.04 |
87.39±6.24 |
2.13±2.94 |
7.71±8.61 |
90.23±9.05 |
| P value |
0.0841 |
0.2495 |
0.6598 |
0.9276 |
Download Excel Table
Fig. 3.
Correlation between paternal telomere length and hatchability in Korean native chicken.
Download Original Figure
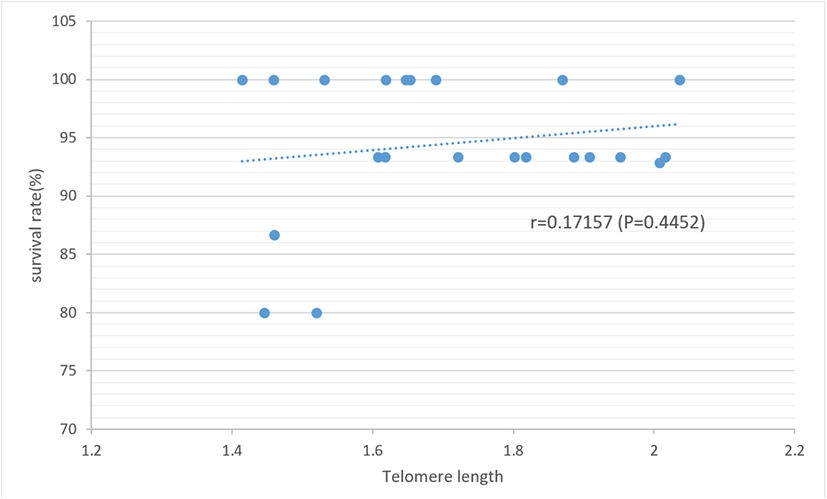
3. 부계의 텔로미어 길이가 자식의 생존율에 미치는 영향
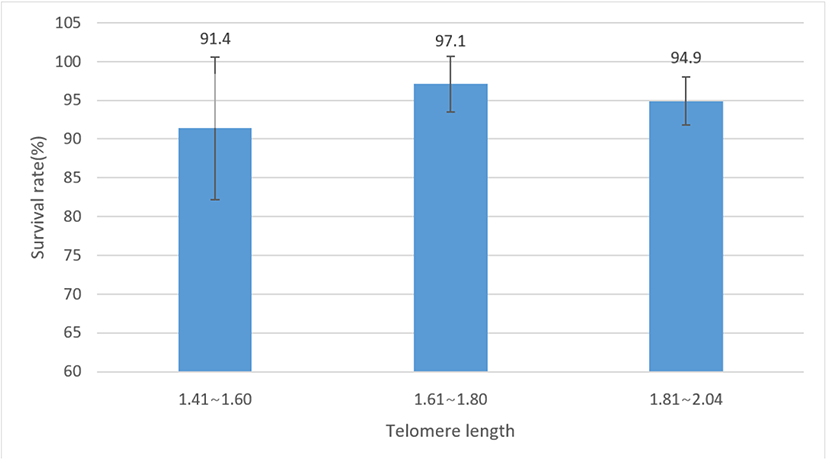
부계 텔로미어 길이에 따른 자식의 생존율 분석 결과를 Fig. 4에 제시하였고, 이들 간의 상관관계를 Fig. 5에 나타내었다. 분석 결과, 부계의 텔로미어 길이가 상대적으로 짧은 군의 자식 생존율은 91.4%, 중간 정도 군은 97.1%, 긴 텔로미어 길이를 가진 군은 94.9%로 부계의 텔로미어 길이에 따른 자식의 생존율 간에는 유의한 차이가 없는 것으로 나타났다(P>0.05). 또한 부계의 텔로미어 길이와 자식의 생존율 간 상관 분석 결과 낮은 정의 상관(r=0.17)을 보이지만 상관 계수 자체는 유의하지 않은 것으로 나타났다(P>0.05). 토종닭 품종별 텔로미어 길이와 생존율 간의 연관성 연구에서 50주령 텔로미어 길이와 평균 생존율 간의 상관 계수는 0.281, 20주령 텔로미어 길이와는 0.157로 추정되어 텔로미어 길이가 길수록 생존 능력이 높아지나 성장 초기보다는 노년의 텔로미어 길이가 생존율에 더 큰 영향을 미친다고 하였다(Cho et al., 2022). 토종 종계의 20주령 텔로미어 함량과 생존율 간의 상관도 추정에서도 r=0.167로 이들 간 유의한 정의 상관을 제시하였다(Cho et al., 2016). 텔로미어 길이와 생존 능력 간의 연관성에 대해 인간의 경우 텔로미어 길이가 짧은 사람들이 상대적으로 성인병 발생률이 높고 생존율이 낮았다고 하였고(Cawthon et al. 2003), 금화조와 같은 조류에서도 생애 초기의 텔로미어 길이가 길수록 수명이 길었으며, 녹색 제비에서도 텔로미어 길이가 긴 개체가 짧은 개체에 비해 상대적으로 생존율이 높았다고 하였다(Haussmann et al., 2005; Heidinger et al., 2012). 이처럼 개체의 텔로미어 길이와 생존 능력 간에는 정의 연관성이 있다는 결과들이 다수 보고되고 있으나 부모의 텔로미어 길이가 자식의 생존 능력에 미치는 영향에 대해서는 거의 알려진 바가 없다. 본 실험 결과, 부계의 텔로미어 길이와 자식의 생존율 간 낮은 정의 상관이 추정되기는 하였으나 자식의 생존율이 12주령까지의 분석 결과로 텔로미어의 생물학적 특성상 초기 생존율과 부계의 텔로미어 길이 간의 연관성을 제시하기에는 다소 어려움이 있다. 따라서 양친의 텔로미어 길이와 자식의 생존율 간의 연관성을 명확히 구명하기 위해서는 보다 높은 연령대에서 자식의 생존율과 연관 관계를 살펴보고 더불어 부모의 텔로미어 길이를 함께 고려하여 분석하는 것이 바람직할 것으로 생각된다.
Fig. 4.
Survival rates of offspring according to paternal telomere length in Korean native chicken (P>0.05).
Download Original Figure
Fig. 5.
Correlation between paternal telomere length and survival rates of offspring in Korean native chicken.
Download Original Figure
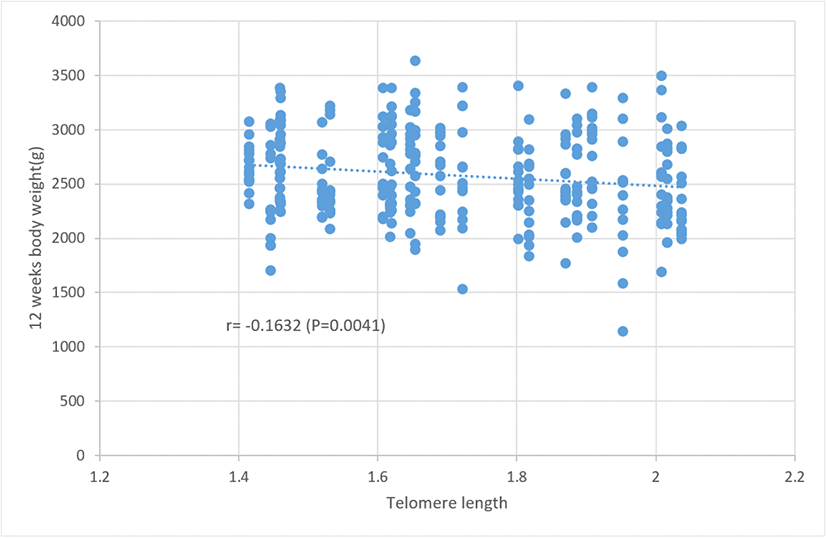
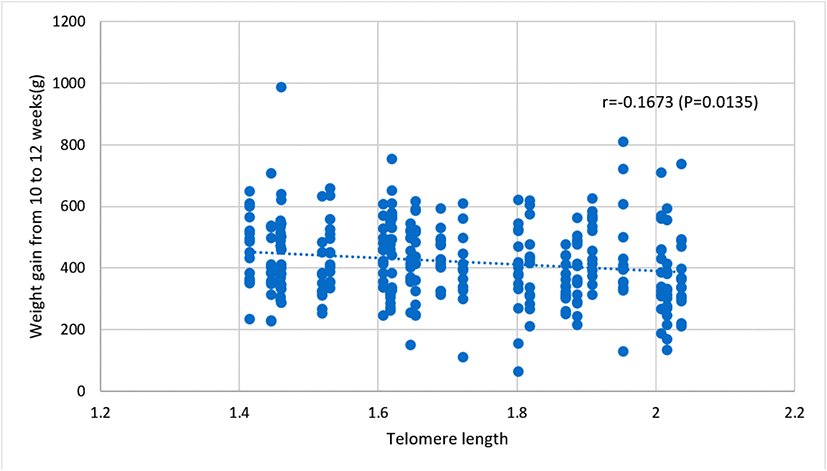
4. 부계의 텔로미어 길이가 자식의 성장 능력에 미치는 영향
부계의 텔로미어 길이가 발생한 자식의 성장 능력에 미치는 영향에 대해 알아보고자 자식의 체중 및 증체량을 조사하여 부계 텔로미어 길이와 연관성을 분석하였다. Table 2는 부계의 텔로미어 길이와 주령별 자식의 체중 및 증체량 간의 상관 계수를 추정하고 이의 결과를 제시한 것이다. 분석 결과, 부계의 텔로미어 길이와 자식의 체중 간에 있어, 2주령 체중을 제외한 전 기간 자식의 체중과 부계의 텔로미어 길이 간에 부의 상관관계를 보이고, 거의 모든 주령에서 유의한 상관 계수를 나타내었다(P<0.05). 부계의 텔로미어 길이와 자식의 증체량 간의 상관 또한 체중과 동일하게 4주령 이후 모두 부의 상관을 나타내고 있다. Fig. 6은 부계의 텔로미어 길이와 자식의 12주령 체중 간, Fig. 7은 부계의 텔로미어 길이와 자식의 10~12주령 증체량 간의 상관관계를 제시한 것이다. 이는 자식들의 성장 능력과 부계의 텔로미어 길이 간에 연관성이 있음을 시사하는 것으로 부계의 텔로미어 길이가 길수록 자식의 성장 능력이 낮은 경향을 나타내고 있다. 이러한 사실은 Table 3에서 부계의 텔로미어 길이에 따른 자식의 체중을 분석한 결과에서도 잘 나타나는데 6주령 이후부터 부계 텔로미어 길이가 긴 집단의 자식들이 상대적으로 낮은 체중을 보이고 있다. 닭의 텔로미어 길이와 체중 간의 연관성 연구에서 토종 종계를 대상으로 저 체중 닭들이 고 체중 닭보다 상대적으로 높은 텔로미어 함유율을 보이고, 텔로미어의 감축률 또한 고 체중 닭이 높다고 하였다(Cho et al., 2016). 또한 토종 종계의 20주령 및 40주령 체중과 동일 시점에서 개체의 텔로미어 함량 간 상관 계수 추정에서 각각 −0.18과 −0.24로 유의한 부의 상관을 보고하고 연령이 증가할수록 상관 계수가 높아진다고 하였다(Park et al., 2016). 한편 토종닭 5품종 간 텔로미어 길이 비교 분석 결과, 가장 대형종인 한국형 코니시 갈색종이 다른 품종에 비하여 상대적으로 짧은 텔로미어 길이와 가장 높은 단축률을 보인다고 하였다(Cho et al., 2022). 이러한 결과는 성장 속도가 빠른 계종들이 상대적으로 텔로미어 길이의 감축이 크다는 것으로 고 체중 닭들이 상대적으로 체 유지를 위한 대사 소모가 많고 생리적 활성도가 낮다는 것이다(Sohn and Subramani, 2014). 본 연구에서는 양친의 텔로미어 길이가 자식의 체중에 미치는 영향을 살펴본 것으로 부계의 텔로미어 길이가 길수록 자식의 체중이 낮다는 결과는 상기 연구에서 개체의 텔로미어 길이와 체중 간의 연관성 보고와 유사한 양상으로 매우 흥미로운 결과로 사료된다.
Table 2.
Correlation coefficients of paternal telomere length on offspring body weight and weight gain
| Age |
Body weight |
Weight gain |
| Correlation coefficient |
P value |
Correlation coefficient |
P value |
| Bitrth |
−0.105 |
0.0610 |
|
|
| 2 weeks |
0.001 |
0.9962 |
0.011 |
0.8384 |
| 4 weeks |
−0.101 |
0.0709 |
−0.134* |
0.0167 |
| 6 weeks |
−0.132* |
0.0188 |
−0.118* |
0.0350 |
| 8 weeks |
−0.142* |
0.0114 |
−0.111* |
0.0350 |
| 10 weeks |
−0.128* |
0.0224 |
−0.052 |
0.3548 |
| 12 weeks |
−0.163** |
0.0041 |
−0.141* |
0.0135 |
Download Excel Table
Fig. 6.
Correlation between body weight and paternal telomere length in 12-week-old offspring of Korean native chickens.
Download Original Figure
Fig. 7.
Correlation between paternal telomere length and offspring weight gain from 10 to 12 weeks in Korean native chickens.
Download Original Figure
Table 3.
Body weights of offspring according to paternal telomere length
| Age of offspring |
Paternal telomere length |
P value |
| 1.41-1.60 |
1.61-1.80 |
1.81-2.04 |
|
| -------------------- g -------------------- |
| Bitrth |
43.51±2.71 |
43.06±3.07 |
42.74±3.30 |
0.1802 |
| 2 weeks |
230.54±29.78 |
230.42±27.80 |
228.97±30.87 |
0.9091 |
| 4 weeks |
656.68±74.90 |
646.60±76.45 |
633.05±91.68 |
0.1063 |
| 6 weeks |
1196.03±162.02a |
1195.88±151.59a |
1144.77±172.23b |
0.0268 |
| 8 weeks |
1713.63±228.60ab |
1730.53±227.94a |
1639.59±266.13b |
0.0129 |
| 10 weeks |
2182.70±304.61 |
2184.80±325.92 |
2090.50±351.28 |
0.0531 |
| 12 weeks |
2626.94±364.94a |
2632.98±403.37a |
2488.07±420.29b |
0.0111 |
Download Excel Table
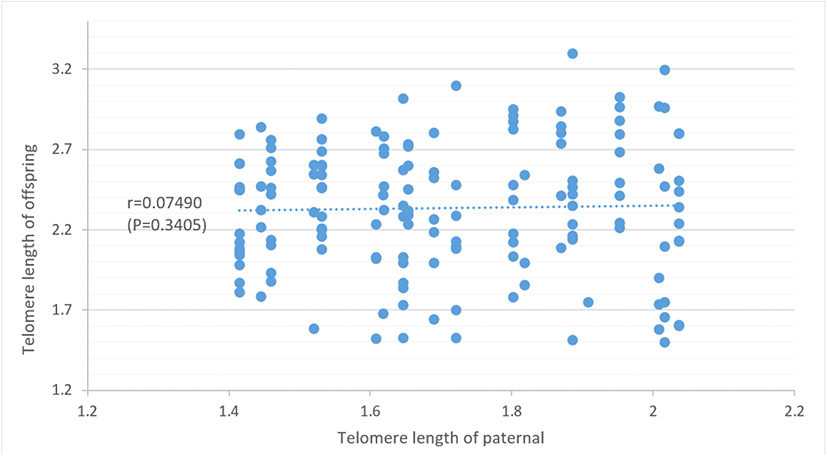
5. 부계와 자식 간 텔로미어 길이의 연관성 분석
닭 텔로미어 길이의 유전 전이 양상을 살펴보고자 부계의 텔로미어 길이와 자식의 12주령 텔로미어 길이를 측정하고 이들 간의 상관관계를 분석하였다. 분석 결과, 34주령 부계 22수의 평균 텔로미어 길이는 1.71±0.20이었고, 이들 자식 총 165수의 12주령 평균 텔로미어 길이는 2.34±0.41이었다. 이들 간의 상관 양상은 Fig. 8과 같고 상관 분석 결과 부계의 텔로미어 길이와 자식의 텔로미어 길이 간에는 거의 0에 가까운 상관 계수(r=0.075)가 추정되었다. 이는 부의 텔로미어 길이와 자식의 텔로미어 길이 간에는 거의 연관성이 없음을 시사한다. 텔로미어의 유전 전이 양상에 대해서는 다양한 이론들이 존재하는데 인간에서 텔로미어 길이는 X 염색체 연관 유전 양상을 가진다는 이론(Nawrot et al., 2004)과 자식의 텔로미어 길이는 부로부터 더 큰 영향을 받는다는 상이한 결과가 보고된 바 있다(Njajou et al., 2007; Nordfjall et al., 2010). 한편, 조류 중 야생 앵무새의 경우 자식의 텔로미어 길이는 모의 텔로미어 길이와 연관성이 크다는 보고가 있지만(Horn et al., 2011), 닭의 텔로미어 길이는 부모 중 어느 한쪽으로부터 일방적인 영향을 받지 않고 부모의 텔로미어 길이 모두가 자식의 텔로미어 길이와 정의 상관을 가진다고 하였다(Park and Sohn, 2014). 본 실험 결과 토종닭 부계의 텔로미어 길이와 12주령 자식의 텔로미어 길이 간에는 거의 상관관계가 없는 것으로 나타났는데 이는 텔로미어의 생물학적 역동성(dynamics)에 기인한 결과로 사료된다. 닭은 배아 초기 단계에서 텔로미어의 reprogramming에 의해 발생 시 모든 개체의 텔로미어 길이가 재 신장되고(Lanza et al., 2000; Park and Sohn, 2014) 이후 연령이 증가하면서 이의 길이가 점진적으로 짧아지게 되는데 감축의 정도는 유전적 및 여러 환경적 요인에 의해 큰 차이가 나타나게 된다고 한다(Sohn et al., 2008, 2011, 2014, 2015; Kim et al., 2011; Sohn and Subramani. 2014. Cho et al., 2020, 2022). 따라서 12주령 정도의 초기 연령대 개체들의 텔로미어 길이는 감축의 정도와 변이가 크지 않음으로 부계 텔로미어 길이와 거의 상관관계가 없는 것으로 추정될 수밖에 없다고 생각된다.
Fig. 8.
Correlation of telomere length between paternal and offspring in Korean native chicken.
Download Original Figure
사사
본 논문은 농촌진흥청 가축유전자원 관리기관 지정 운영 2022 사업(PJ016554)의 지원으로 수행되었음.
REFERENCES
Beloor J, Kang HK, Kim YJ, Subramani VK, Jang IS, Sohn SH, Moon YS 2010 The effect of stocking density on stress related genes and telomeric length in broiler chickens. Asian-Australas J Anim Sci 23(4):437-443.


Cawthon RM, Smith KR, O’Brien E, Sivatchenko A, Kerber RA 2003 Association between telomere length in blood and mortality in people aged 60 years or older. Lancet 361(9355):393-395.


Cho EJ, Choi ES, Jeong HC, Kim BK, Sohn SH 2020. Production traits and stress responses of five Korean native chicken breeds. Korean J Poult Sci 47(2):95-105.


Cho EJ, Choi ES, Sohn SH 2005 The amount of telomeres and telomerase activity on chicken embryonic cells during developmental stages. J Anim Sci Technol 47(2):187-194.


Cho EJ, Kim BG, Sohn SH 2022 Comparison of telomere length and vitality among Korean native chicken breeds. Korean J Poult Sci 49(1):15-23.


Cho EJ, Park JA, Choi ES, Sohn SH 2016 Comparison of stress response in diallel crossed Korean domestic chicken breeds. Korean J Poult Sci 43(2):77-88.


Choi ES, Cho EJ, Jeong HC, Kim BK, Sohn SH 2020 Comparison of production performance and stress response of White Leghorns kept in conventional cages and floor pens. Korean J Poult Sci 47(3):189-197.


Choi ES, Sohn SH 2020 The effects of breed, laying age and egg storage period on the hatchability of Korean native chickens. Korean J Poult Sci 47(4):237-245.


Faragher RG, Kipling D 1998 How might replicative senescence contribute to human ageing? Bioessays 20(12):985-991.


Harley CB 1991 Telomere loss: mitotic clock or genetic time bomb? Mutat Res 256(2):271-282.


Ishaq HM, Akram M, Baber ME, Jatoi AS, Sahota AW, Javed K, Mehmood S, Hussain J, Husnain F 2014 Embryonic mortality in cobb broiler breeder strain with three egg weight and storage periods at four production phases. J Anim Plant Sci 24(6):1623-1628.

Jung GS, Cho EJ, Choi DS, Lee MJ, Park C, Jeon IS, Sohn SH 2006 Analysis of telomere length and telomerase activity of tissues in Korean native chicken. Korean Poult Sci 33(2):97-103.

Kim YJ, Subramani VK, Sohn SH 2011 Age prediction in the chickens using telomere quantity by quantitative Fluorescence
in situ hybridization technique. Asian-Australas J Anim Sci 24(5): 603-609.


Levy MZ, Allsopp RC, Futcher AB, Greider CW, Harley CB 1992 Telomere end-replication problem and cell aging. J Mol Bio 225(4): 951-960.


Malago JJ, Baitilwake MA 2009 Egg traits, fertility, hatchability and chick survivability of Rhode Island Red, local and crossbred chickens. Tanzania Vet J 26(1):24-36.


Nawrot TS, Staessen JA, Gardner JP, Aviv A 2004 Telomere length and possible link to X chromosome. Lancet 363:507-510.


Park DB, Sohn SH 2014 Inheritance and heritability of telomere length in chicken. Korean J Poult Sci 41(3):217-225.


Park JA, Cho EJ, Choi ES, Hong YH, Choi YH, Sohn SH 2016 The relationship of the expressions of stress-related markers and their production performances in Korean domestic chicken breed. Korean J Poult Sci 43(3):177-189.


Sohn SH, Cho EJ, Kim KG, Shin KB, Lee SG 2022 Comparison of growth performance and stress response between male and female Korean native commercial chickens. Korean J Poult Sci 49(2):89-98.


Sohn SH, Cho EJ, Park DB, Jang IS, Moon YS 2014 Comparison of stress response between Korean Native Chickens and Single Comb White Leghorns subjected to a high stocking density. Korean J Poult Sci 41(2): 115-125.


Sohn SH, Cho EJ, Park JA, Hong YH, Kim CD 2015 Analysis of stress response of domestic chicken breeds for the development of a new synthetic parent stock. Korean J Poult Sci 42(2):157-167.


Sohn SH, Jang IS, Moon YS, Kim YJ, Lee SH, Ko YH, Kang SY, Kang HK 2008 Effect of dietary Siberian ginseng and eucommia on broiler performance, serum biochemical profiles and telomere length. Korean J Poult Sci 35(3):283-290.


Sohn SH, Jang IS, Son BR 2011 Effect of housing systems of cage and floor on the production performance and stress response in layer. Korean J Poult Sci 38(4):305-313.


Sohn SH, Subramani VK 2014 Dynamics of telomere length in the chicken. World’s Poult Sci J 70(4):721-735.


Taylor HA, Delany ME 2000 Ontogeny of telomerase in chicken: impact of downregulation on preand postnatal telomere length
in vivo. Dev Growth Differ 42(6):613-621.



Wang P, Sun Y, Fan J, Zong Y, Li Y, Shi L, Isa AM, Wang Y, Ni A, Ge P, Jiang L, Bian S, Ma H, Jiang R, Liu X, Chen J 2020 Effects of monochromatic green light stimulation during embryogenesis on hatching and posthatch performance of four strains of layer breeder. Poult Sci 99(11):5501-5508.




Witt F, Schwalbach LMJ 2004 The effect of egg weight on the hatchability and growth performance of New Hampshire and Rhode Island Red Chicks. S Afr J Anim Sci 34(2):62-64.