서 론
현재 우리 주변에서 사육되고 있는 닭의 기원은 BC 5,400년에서 BC 8,000년까지 여러 시점이 있으며, 장소 또한 인도와 파키스탄의 인더스강 유역, 중국 북부 황하유역, 동남아 지역 등 다양한 곳에서 가축화된 것으로 추정된다(Zeuner, 1963; Crawford, 1990; Fitzpatrick and Ahmed, 2000; Peters et al., 2016). 찰스 다윈은 가축화된 닭의 가장 가까운 조상은 아시아 열대 우림에 서식하는 적색야계(red jungle fowl: Gallus gallus)라고 하였다(Darwin, 1896). 이러한 다윈의 주장은 후에 조류 미토콘드리아 L-chain의 조절영역 DNA 염기서열의 제한효소절편다형(RFLP) 분석으로 모든 축화된 닭은 적색야계에서 유래되었음이 검증되었다(Fumihito, 1994). 조류인 닭은 진화적으로 포유류와 척추동물 사이의 진화적 간격을 연결해 주는 모델 동물로 연구되기도 한다(ICGSC, 2004). 조류는 백악기 대멸종에서 살아남았으며, 그중 닭은 가축 중에서 최초로 유전체 분석이 완료된 동물로서 39쌍의 염색체, 약 10억 개의 염기와 20,000-23,000개 유전자를 가지고 있다(ICGSC, 2004). 공룡 대멸종은 약 6천6백만 년 전 중생대 백악기와 신생대 팔레오기(Cretaceous-Paleogene: K-Pg)의 경계에 발생했다(Hull et al., 2020). 대멸종은 화산폭발에 의한 화산가스의 대규모 분출이 원인으로 주장되기도 한다(Sprain et al., 2019). 그러나 최근 연구에 의하면 멕시코 유카탄반도 부근 바다에 떨어지며 지름 200 km의 Chicxulub 충돌구를 만든 소행성 충돌의 여파로 급격한 환경 변화가 공룡 대멸종의 주된 원인으로 지목된다(Hull et al., 2020). 공룡 대멸종 사건 이전에도 조류가 번창하고 있었지만 대멸종기에 비조류 공룡들과 대부분의 조류도 멸종하였으며, 이때 살아남은 일부 현생 조류는 그 이후에 급격하게 진화하기 시작하였다(Claramint and Cracraft, 2015). 그러면 K-Pg 대멸종기에 공룡은 모두 멸종하였는가? 현재 살아 있는 공룡은 있는가? 등에 대한 궁금증은 남는다. 1990년대 중반 이후 풍부한 공룡화석 발견과 화석 분류군에 대한 광범위한 계통 발생학적 분석, 진화연구, 유전체학 연구 결과들은 조류는 살아있는 수각류 공룡임을 보여준다(Holtz, 1998; Sereno, 1999; Witmer, 2002; ICGSC, 2004; Xu et al., 2010; Romanov et al., 2014; Brusatte et al., 2015; Griffin et al., 2020). 미국국립의학도서관에서 제공하는 논문검색 PubMed에 의하면 2022년 9월 기준 새(birds)와 공룡(dinosaurs)을 키워드로 검색하면 780여 편의 논문이 있으며, 닭(chickens)과 공룡(dinosaurs)을 검색하면 60여 편이 된다. 이에 닭을 포함한 조류가 공룡임을 밝히는 최근까지의 연구들을 소개하고자 한다.
본 론
영국의 생물학자이면서 고생물학자인 Richard Owen은 Plymouth에서 파충류 화석을 대중에게 설명한 것을 정리한 후 발표하면서 1842년 ‘공룡(dinosaur)’이란 단어를 처음 사용하였다(Langer et al., 2010). Owen은 19세기 초부터 영국 남부 지역에서 발굴된 거대한 멸종 동물들의 화석골격을 연구하면서 이들 화석을 ‘무섭다(fearfully)’라는 뜻의 그리스어 ‘데이노스(deinos)’와 ‘큰 도마뱀(great lizard)’이라는 뜻의 ‘사우로스(sauros)’를 합쳐 무서운 큰 도마뱀(fearfully great lizard)인 ‘다이노사우르(dinosaur)’라는 ‘공룡’ 이름을 붙였다(Owen, 1842; Delair and Sarjeant, 1975). 약 3억 2천 5백만 년 전 양막류(Amniotes)는 단궁류(Synapsids: 포유류계의 조상)와 이궁류(Diapsids: 파충류계와 조류계의 조상)로 분리되었고, 현존하는 이궁류는 약 17,500종이며, 이 중 약 10,500종은 새이다(Griffin et al., 2020). 공룡, 익룡, 악어, 거북이, 새는 2억 7천 5백만 년 전 모두 공통 조상인 이궁류를 공유하고 있다(Shedlock and Edwards, 2009; Hedges et al., 2015). 거북이가 2억 5천 5백만 년 전에 먼저 분기되어 나왔으며, 2억 5천 2백만 년 전에는 악어, 2억 4천 5백만 년 전에는 익룡, 그리고 약 2억 4천만 년 전 공룡이 처음 지구상에 출현하였다(Shedlock and Edwards, 2009; Langer et al., 2010; Hedges et al., 2015; Baron et al., 2017; Griffin et al., 2020). 공룡에 대한 정의는 학자들에 따라 조금씩 차이는 있으나 계통 분류학적 분류법(phylogenetic systematics; cladistics)에 따른 공룡의 정의는 다음과 같다. “공룡은 트라이세라탑스(Triceratops; 초식성 각룡류 공룡, 비조류 공룡), Passer Domesticus(House sparrow, 집참새)를 포함하는 이들 공통 조상의 후손”을 공룡이라 정의 하였다(Padian and May, 1993). 그러나 Baron et al.(2017)은 최근 연구들을 기반으로 “최소한 Passer domesticus(Theropod; 수각류), Triceratops horridus (Ornithischian:조반목), 그리고 Diplodocus carnegii(Sauropodomorph; 용각목)를 포함하는 분기군”을 공룡이라 재정의 하였다. 공룡에 대한 두 정의 모두 기본적으로 Passer Domesticus를 포함하는 공통 조상이 들어 있는 것으로 보아 현존하는 새는 공룡에 포함됨을 알 수 있다. 공룡 진화의 초기 약 3천만 년 동안은 공룡 종(species)의 수가 많지 않았다. 그러나 쥐라기 후기 기간에 종의 수, 지리적 확산, 몸의 크기 등이 모두 많이 증가하였다(Benton et al., 2014). 이후 약 1억 3천 5백만 년은 공룡이 지배적인 척추동물이었던 시기뿐만 아니라 종의 다양성이 매우 높은 시기였다. 공룡은 트리아식(Triassic)기 후기에 대량멸종기(2억 1백만 년 전)를 포함하여 여러 멸종 사건에 살아남았으나 K-Pg 대 멸종기에 조류 공룡을 제외한 공룡들은 모두 멸종하였다(Griffin et al., 2020). 화석 기록에는 지금까지 약 1,000종 이상의 공룡이 발견되었으며 매년 약 30여 종이 새롭게 등장하고 있다(Weishampel, 2004). 영국에서 처음 공룡화석이 발견된 이후 지난 2세기 동안 거의 11,000개의 화석이 전 세계적으로 발견되었으며, 그중 약 70%가 북미와 유력지역에 분포한다. 최근에는 동아시아와 남미에서도 많은 공룡 화석이 발견되고 있다. 계통분류학자들은 지금까지 약 1,000여 종의 공룡을 분류하였다(Peek, 2021). 공룡은 일반적으로 골반 거들(pelvic girdle: 골반을 구성하는 뼈들)과 팔다리의 해부학적 형태로 분류한다(Langer et al., 2010). 지금까지 가장 고전적 공룡의 분류는 해부학적 골반 구조에 따라 새의 골반을 닮은 조반목(Ornithischia)과 도마뱀의 골반과 닮은 용반목(Saurischia)이라는 두 개의 분기군으로 나눈다(Seeley, 1887; Ezcurra, 2010; Baron et al., 2017). 지구상에 공룡이 처음 출현한 약 2억 3천 6백만 년 전, 후기 트리아식기(Late Triassic)의 공룡은 주요 3그룹인 조반목, 용각아목, 수각아목으로 나눈다(Ezcurra, 2010; Langer et al., 2010; Marsicano et al., 2016; Baron et al., 2017). 조반목은 초식동물의 공룡이 주가 되며, 용반목은 다시 용각아목(Sauropodomorpha)과 수각아목(Theropoda)으로 분류되고, 목이 긴 초식공룡의 무리가 용각아목에 속하며, 이족 보행을 하는 거의 모든 육식공룡이 수각아목에 속한다(Langer et al., 2009; Ezcurra, 2010; Baron et al., 2017). 후기 트리아식기에 조반목보다는 용반목 공룡계가 더욱 번성하고 초식공룡인 이들은 지리적으로 세계 각지로 많이 분포하게 되어 번성(2억 6백 만 년-1억 8천 만 년 전; 초기 쥐라기) 하였다(Langer et al., 2010). 수각아목 그룹은 초식 및 잡식성 공룡으로 진화하지만, 초기 쥐라기부터 약 6천6백만 년 전까지 가장 큰 지상 육식 동물로 번성하였다(Fig. 1). 쥐라기에서 수각류 공룡의 하위그룹인 코엘로사우리아(Coelurosauria), 마니랍토라(Maniraptora), 파라베스(Paraves)를 거처 현생 조류(Aves: Avialae: Crown aves: Neornithes)로 진화하였다(Langer et al., 2010; Brusatte et al., 2015).
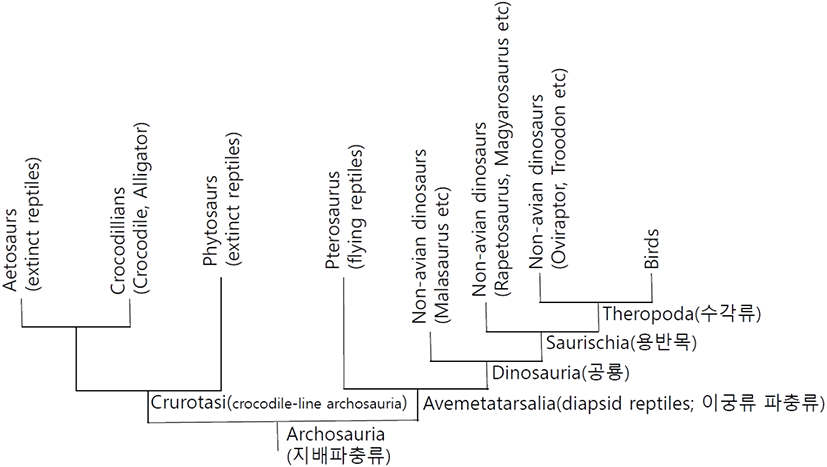
처음 조류의 등장은 약 1억 년 전 Neognathae(신악류, 현존하는 조류 분류군)에서 Paleognathae(고악류: Ratites 주금류; 타조 에뮤, 키위등과 Tinamous: 도요타조)가 분기된 시점이며, 약 8천만 년 전 Galloanseres(닭기러기류)와 Neoaves(신조류)가 Neognatae에서 분기되었다(Griffin et al., 2020)(Fig. 2). Galloanseres는 K-Pg 대 멸종기 무렵에 Galliformes(육지새; 닭 등)와 Anseriformes(물새; 오리 등)로 분기되었다. Neoaves에서 Columbea(비둘기 등)와 Passarea(참새 등)으로의 대규모 분기는 K-Pg 경계(6천 7백-6천 9백만 년) 이전에 일어났다(Griffin et al., 2020). 조류가 화석 기록에 처음 등장한 시기는 쥐라기 중기 즉 약 1억 6천 5백만 년-1억 5천 만 년 전(시조새, 샤오팅기아, 안키오르니스의 시대)이다(Brusatte et al., 2015). 1990년대까지 축적된 자료에 의하여 대부분 고생물학자들은 공룡과 새의 연관성을 인정하였지만, 조류학자들은 회의적이었다. 1996년 중국 북동부 지방에서 깃털을 가진 원시 공룡인 시노사우롭테릭스(Sinosauropteryx; ‘pteryx’는 라틴어로 ‘wing’을 뜻함) 화석 발견을 시작으로 1990년대 후반 중국에서 깃털로 덮인 수천 마리 공룡 화석의 추가적인 발견은 공룡과 조류의 연결에 대한 가장 결정적 증거를 제공하였다(Ji and Ji, 1996; Chen et al., 1998; Norell and Xu, 2005). 최근에는 수각목 공룡뿐 아니라 초식공룡인 조반목 공룡들에게도 원시적인 섬유형 깃털이 발견되어 공룡에서 깃털은 보편적 특징이 되었다(Brusatte et al., 2015). 이러한 증거는 조류학자들도 새가 공룡에서 진화했다는 사실을 받아들이는 계기가 되었다. 중국에서 발견된 비조류 공룡 화석들도 깃털을 가지고 있었다. 앞에서도 기술하였지만 새는 수각류 공룡으로서 수각류 하위 그룹인 Coelurosauria, Maniraptoria 및 Paraves에 속한다(Brusatte et al., 2015). Paraves에서 분기된 드로마에오사우르스과와 트로오돈과의 화석(예, Velociraptor)들은 대부분 몸집이 작고 깃털이 달린 큰 뇌를 지닌 것을 볼 수 있다(Norell and Malkovicky, 2004). 시조새는 여전히 최초의 새로 널리 알려져 있지만, 원시 드로마에오사루스(dromaeosaurids)과 또는 토로오돈(troodontids)과일 수 있다는 제안도 있다(Xu et al., 2011; Godefroit et al., 2013; Brusatte et al., 2015). Anchiornis와 Xiaotingia와 같은 작은 깃털 수각류가 시조새보다 더 원시적인 최초의 새로 주장하기도 한다(Godefroit et al., 2013; Foth et al., 2014). 새는 백악기 초기에 다양화되어 다양한 해부학 및 생태학의 그룹으로 진화했다. 이러한 다양화는 1억 3천 7십만 년에서 1억 2천만 년 전의 중국 북동부 제홀 생물군 화석 기록에서 확인할 수가 있다(Zhou et al., 2003; Zhou, 2014). 이들은 시조새 이후 가장 오래된 조류화석이다. 제홀 생물군 화석은 조류의 초기 진화에 대한 중요한 변화가 백악기 초기에 확립되어 있음을 보여준다(Wang et al., 2015). 이 화석(예: Jeholornithiformes)들은 시조새보다 약간 더 진화된 미단골(pygostyle: 척추의 마지막 몇 개의 꼬리뼈가 단일 골화에 융합되어 꼬리 깃털과 근육을 지지하는 골격구조)을 가지고 있다. 이후 부리가 있는 Confuciusornithiformes와 주요 초기 조류그룹인 Enantiornithes 및 Ornithuromopha 분기군으로 나누어진다(Zhou and Zhang 2006). 앞의 분기군에서 파생된 Ornithothoraces 분기군은 흉골(sternum; 가슴뼈: 조류의 가슴에 있는 날개를 움직이는 근육이 붙어 있음), 좁은 차골(furcula; wishbone: 쇄골이 하나로 결합된 V자 형태의 뼈로서 비행에 반드시 필요함)등과 같은 비행에 필요한 형태로 변화된 것을 볼 수 있다(O’Connor et al., 2011)(Fig. 3). Neornithes에 속하는 현대 조류는 대부분 백악기 이후에 등장한 방사 진화의 결과이다(Hope, 2002). 최근 연구에 의하면 지금까지 알려진 10,500여 종의 새의 수는 과소평가 되었으며 분자적 생태학적 분석법에 따른 평가에서 약 18,043종이 확인되었다(Barrowclough et al., 2016).
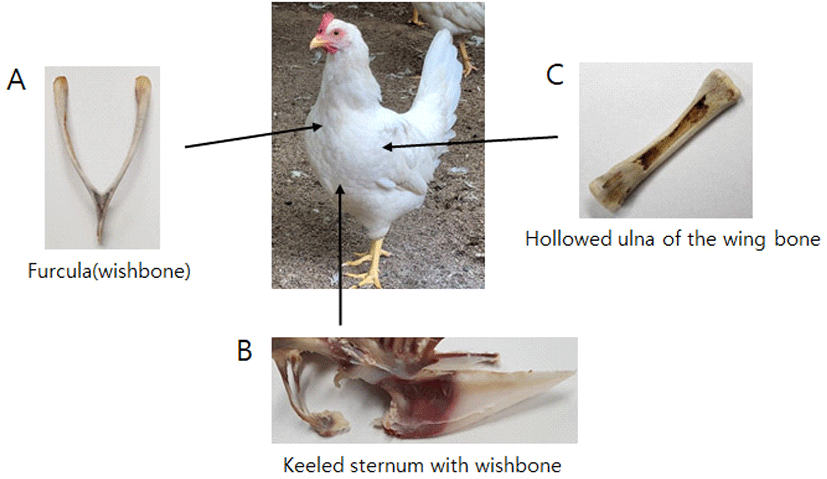
공룡과 조류의 골격 구조의 공통점을 확인하는 것은 조류와 공룡의 연결고리를 찾는 중요한 요소라 할 수 있다. 조류의 공통 조상에서 진화하여 살아있는 동물 중 새에서만 있는 특징은 깃털, 알 품기, 비행 등이 있다(Brusatte et al., 2015). 이외에도 빠른 성장, 차골(furcula), 용골 흉골(keeled sternum), pygostyle, 부리(beak)와 같은 특징은 초기 조류에는 없으며 백악기 동안 여러 번 진화를 거듭하면서 파생된 새에서 볼 수 있다. 즉 현재 새의 모습은 짧은 기간 단번에 일어난 것이 아니고 수천만 년 동안 점진적 진화를 거쳐 이루어진 결과이다(Brusatte et al., 2015). 살아있는 새는 대부분 작고 비행에 적합한 매우 독특한 골격 구조를 하고 있다. 작은 몸집은 먼 친척인 Maniraptoran 수각류에서 시작하여 5천만 년 이상 진행된 진화의 결과이다(Turner et al., 2007; Benson et al., 2014). 두 다리(이족) 보행자세, 경첩같은 발목, 속이 빈 뼈, 새의 긴 S자형 목은 초기 공룡 조상에게 물려 받았으며, 새의 furcula와 세 손가락형의 손(앞발)은 원시 수각류에서 처음 나타났고, 팔뚝을 몸에 대고 접는 능력은 조류와 밀접하게 관련된 파라비안(paravians)에서 나타났다(Padian and Chiappe, 1998; Brusatte et al., 2010; Nesbitt, 2011; Xu et al., 2014). 길쭉한 앞발은 새의 날개로, 뒷다리는 움직이는 활동의 대부분이 골반 관절보다 무릎관절에서 발생하는 기이한 구부린 뒷다리 자세로 진화한다(Middleton and Gatesy, 2000; Allen et al., 2013). 새의 앞발 변화가 중요한데 맨 처음 5개의 손가락뼈가 있었지만 다섯 번째, 네 번째가 차례로 퇴화되고 3개의 손가락만 남게 되면서 두 번째 손가락이 길어지게 되어 닭발과 비슷한 형태가 되었다(Vargas and Fallon, 2005). 조류의 손목(날개)과 발목의 골격 구조는 수각류 공룡과 같다(Vargas et al., 2017). 덴마크 조류학자 Gerhard Heilmann(1927)은 ‘새의 기원’에서 차골은 새의 비행에 반드시 필요하며 거의 모든 수각류 공룡에서 발견된다고 하였다. 다른 전형적인 조류의 특징, 즉 비행 근육을 지지해주는 용골 흉골, 매우 축소된 꼬리뼈(tail vertebrae) 등은 새의 기원 이후에 진화하였는데 이는 초기의 새가 이러한 특징이 없었다는 점에서 초기의 새는 공룡처럼 보였다는 것을 의미한다(Brusatte et al., 2015). 비대한 용골 흉골은 모든 살아있는 새의 특징이며, 날아다니는 척추동물(Ornithodira: 익룡)에도 존재한다(Parker, 1867)(Fig. 3). 그러나 가장 원시적인 새라고 여겨지는 시조새의 흉골의 존재 여부는 명확하지 않다(Zheng et al., 2014). 백악기 초기 조류인 Sapeornis는 골화된 흉골이 없으며 꼬리가 짧은 미단골(pygostyle)을 갖춘 가장 원시적인 조류 중 하나이다(Zhou and Zhang, 2003). 살아 있는 새의 흉골은 두 개의 가장 중요한 비행 근육인 가슴근육(pectoralis muscle)과 상지요충(supracoracoideus muscle) 근육의 부착을 위한 넓은 표면적을 제공한다(Gill, 2007). 화석 새에서 골화된 흉골이 없는 경우 흉골이 없거나 연골성인 것으로 추측할 수 있으며 새의 비행 능력이 심각하게 제한될 수 있음을 보여준다(Zhou and Zhang, 2003). 조류와 밀접한 관련이 있는 것으로 여겨지는 공룡 군집인 Troodontidae에도 흉골은 없다(Xu et al., 2011). 이러한 흉골의 부재는 새의 초기 진화 당시 다양한 조류의 상태를 나타낼 수 있으며 진화 초기 조류의 복잡성을 보여 준다. 두개골(skull)은 다른 골격에 비하여 조류에서 비교적 느리게 진화하여 두개골의 다양성은 달성하지 못한 것으로 보인다(Fellice et al., 2020). 반면 조류 다리의 진화 속도는 비조류 공룡보다 현저하게 높다. 사지의 높은 진화율은 두개골의 낮은 진화율을 압도하여 조류의 급속한 외형적 형태 변화를 유도하였다(Fellice et al., 2020). 다른 공룡들에 비하여 조류의 날개, 다리, 골격 등은 높은 차이를 이루고, 두개골의 다양성은 급격히 감소하면서 조류의 형태와 차이는 더 가속화되어 골격 부위별 진화 차이에 따른 모자이크식 진화로 이어졌다(James, 2009; Bohmer et al., 2015; Zhang and Wang, 2019). 공룡의 입은 1억 5천만 년 전에 새로 진화하면서 부리로 변하였고, 조류는 공룡의 공통 조상에서 진화의 초기 단계에서 공룡과 파충류의 주둥이를 형성한 쌍둥이 뼈(premaxilla)는 더 길어지고 함께 결합되어 단일구조의 융합된 현재의 부리가 되었다(Field et al., 2020). 연구자들에 의하면, 닭의 배발생 단계에서 얼굴 발달을 조율하는 두 가지 단백질(FGF, Wnt) 유전자 발현을 억제하면 상악전구골(상악전치부)의 변화를 유도하여 닭(새)의 부리가 시조새와 악어의 상악전구골(좌우 주둥이 뼈가 양분된 형태)로 발달함을 확인하였다(Field et al., 2020). 닭의 경우 이들 두 단백질은 배 발달 단계에서 강하게 발현되어 부리를 형성하는 것으로 보아 FGF와 Wnt의 발현이 새 부리의 진화에 기여한 것으로 본다(Field et al., 2020). 골격구조에 대한 내용을 종합해 보면, 공룡은 새와 같이 뒷다리의 곧게 뻗은 직립으로 앞발을 사용할 수 있어 악어와 같이 원시적 파충류와 차이가 있고, 새의 골격 특징이 공룡이 처음 출현했을 때 공룡의 골격 특징, 그 중에서 수각류 공룡과 같음을 알 수 있다.
깃털의 진화는 초기 공룡에서 시작된 것으로 보인다(Xu and Guo, 2009). 깃털 진화의 가장 초기 단계로 간주되는 원시 깃털(protofeathers)은 단순하고 머리카락과 같은 필라멘트 형태로 원시 수각류(Dilong, Yutyrannus)와 초식성 조류공룡(Yianyulong, Kulindadromeus) 등의 화석에서 확인되었다(Xu and Guo, 2009; Zheng et al., 2009; Godefroit et al., 2014). 마니랍토란(Maniraptor) 수각류 공룡에는 현대 조류에서 볼 수 있는 더 복잡하고 가지가 갈라지고 날개가 있는 깃털로 구조가 정교화 되었다(Xu and Guo, 2009). Microraptor와 같은 일부 비조류 공룡은 기본적으로 살아 있는 새의 깃털과 구별할 수 없는 깃털을 가지고 있다(Ji et al., 1998; Norell et al., 2002; Xu et al., 2003). 깃털 진화에 대한 위의 근거들을 보면 가장 초기의 깃털은 전시 및 체온조절을 목적으로 날지 않는 공룡에서 진화했으며, 이후 초기 새와 가장 가까운 공룡 친척의 비행 구조에 채택된 것으로 보인다(Brusatte et al., 2015). 많은 비 조류(non-avian) 공룡에서 날개에 달린 깃털은 날개를 형성하고, 경우에 따라 다리와 꼬리에 형성되기도 하였다. 이것은 깃털이 새의 유일한 특징이 아니라 이미 공룡의 출현과 함께 존재했었고 깃털을 비행에 이용하기 전, 공룡들은 체온을 조절하거나 짝을 유혹하기 위해, 혹은 먹이를 잡기 위해 다양한 용도로 사용했음을 보여준다. 비 조류 공룡도 날개를 사용하여 날았을 것으로 보이나 살아 있는 새의 근육 구동식 비행은 불가능하고 활공 형태의 비행만 가능했을 것으로 보인다(Dyke et al., 2013). 앞에서도 언급한 것처럼 가장 초기의 새는 현대 새의 효율적인 동력 비행에 필요한 주요 핵심 기능(흉골과 큰 비행 근육, 파고스타일의 축소된 꼬리 등)이 없었다. 현대적인 조류 비행 스타일은 시조새와 제홀로니스보다 훨씬 더 이후 1억 3천만 년 전 파생된 원시 새(Ornithuromorpha: 그리스어로 ‘진짜 새’라는 뜻)의 기원과 함께 나타나기 시작하였다(Brusatte et al., 2015).
척추동물이 진화하는 5억 년이 넘는 기간 동안 동물 외피에 중요한 진화가 일어나고 있었다(Raff, 1996). 파충류가 육지에 살 수 있도록 몸을 보호하기 위한 비늘의 출현과 순환 재생을 위한 줄기세포가 좋은 예이다. 모두 이러한 전환은 새로운 유전자 또는 발달 경로의 새로운 배치가 필요하였고, 진화 과정 중 전환기에 있었던 일부 동물은 위의 두 가지 모두를 가지고 있었다. 그만큼 파충류에서 조류의 진화는 잘 날 수 있는 조건을 위한 외피에 대한 재설계가 많이 요구되었다. 파충류의 외피는 주로 비늘로 이루어져 있다(Landmann, 1986). 새의 경우 발에 비늘이 있고, 몸의 나머지 부분에 깃털이 있다(Lucas and Sttetenheim, 1972). 깃털은 진화하여 조류를 독특하게 만드는 단열(체온유지), 표현(의사교환), 성성숙기에 암수가 서로 다른 특징을 보이기 위한 깃털 생성, 비행 등과 같은 새로운 기능을 제공해 주었다(Feduccia, 1996; Chatterjee, 1997; Pardian and Chiappe, 1998). 시조새의 발견과 다른 화석자료들의 발견은 “새는 공룡에서 진화되었다”라는 공룡과 조류를 서로 연결하는 강력한 가설이 되었다(Ostrom, 1974). 골격 구조의 차이가 있어 공룡과 새를 연결하는데 이의를 제기하기도 하지만 많은 고생물 학자들은 새와 공룡은 고대 파충류인 지배파충류를 공통 조상으로 공유를 하거나, 나중에 수렴 진화하여 후기 공룡에서 깃털이 생성된 것으로 본다(Feduccia, 1996; Chatterjee, 1997). 어떤 경우이든, 모두 깃털이 파충류 외피로부터 진화되었으며 단순한 외피의 비늘에서 깃털로의 점진적 변형이 있었던 것으로 본다(Choung, 1993; Prum, 1999). 깃털 형태 형성에서 몇 가지 주요 분자 신호 전달 경로가 밝혀졌다. 그 한 예로 조류 레트로바이러스 벡터인 RCAS에 의해 형질 도입된 활성 β-catenin을 지속적으로 발현시키면 조류 비늘 표피를 깃털로 변형할 수 있다(Widelitz et al., 2000). 또 다른 예로 비늘 조직에서 델타 경로의 활성화와 BMP 경로를 억제하게 되면 깃털 같은 비늘을 유도할 수 있다(Zou and Niswander, 1996). 이러한 분자생물학적 경로는 비늘에서 깃털로의 화생(변성) 동안 협력하여 작동할 수 있음을 보여 준다. 이와 같은 과정이 동일하지 않지만 평행하게 1억 5천만 년-1억 7천 5백만 년 이후에 조류 진화 과정에서 일어나 깃털 조상(원시깃털)의 형성을 유도한 것으로 추정된다(Chuong et al., 2001). 또 다른 조류 깃털에 대한 분자 신호 모듈의 진화적 연구에서 유전자 Shh와 Bmp2는 깃털 형태를 결정하는 메커니즘의 기본 구성 요소이고, 깃털의 모형적 진화에서 원시적 지배파충류 비늘로부터 관형 깃털 모세포의 발달 과정에 성장과 분화를 조절하는 수단으로 공동 발현하여 다양한 형태의 깃털 형성에 관여함을 보여 주었다(Harris et al., 2002).
공룡화석의 다양한 형태학적 부속물 중의 하나인 깃털은 조류 비행의 기원을 확인하는 데 중요하지만, 조류와 공룡 사이의 진화적 연결고리에 대한 중요한 소재가 된다. 이러한 측면에서 화석으로부터 직접적 증거인 깃털의 분자적 진화 확인은 매우 중요하다고 할 수 있다. 연구자들은 쥐라기 비조류 공룡 Anchiornis 깃털이 β-keratin(케라틴)과 α-케라틴으로 구성되어 있음을 분자적 구조적 수준에서 확인하였다(Pan et al., 2019). 케라틴은 분자적 구조 때문에 다른 단백질보다 보존 가능성이 높다(Yin et al., 2013). 현존하는 새의 성숙한 날개 깃털은 β-케라틴이 주를 이룬다는 점에서 중요한 의미가 있다. 현존 새의 깃털은 새와 파충류에서만 발견되는 β-케라틴 계열이 주를 이룬다(Alibardi, 2017). 그러나 α-케라틴은 기본적 단백질 계열로서 모든 척추동물에서 발견된다(Alibardi and Toni, 2008; Wu et al., 2015). 현존하는 새의 배아 깃털에서 α-keratin과 β-keratin이 같이 발현되고, 모든 조류와 파충류의 각질 조직에서 α-케라틴이 발현된다(Alibard and Toni, 2008; Wu et al., 2015; Alibardi, 2017). 여러 게놈 연구에 따르면 깃털 β-케라틴 유전자가 깃털이 출현하기 이전에 비늘이 있는 아르코사우루스류(archosaurian)와 레피도사우루스류(lepidosaur)의 표피에서 발현되었을 가능성이 있으며 유전체에 존재했을 것으로 추측하고 있다(Sawyer et al., 2003; Sawyer et al., 2005; Alibardi et al., 2006). Greenwold et al.(2014)는 새의 케라틴 유전자 수를 조사하였는데, 포유류와 파충류(29~62개)와 비교하여 새의 유전체에서 α-케라틴 유전자의 수는 26~38개로 수의 감소를 확인하였다. 그러나 β-케라틴 유전자의 수는 외양간 올빼미(barn owl)는 6개, 금화조(zebra finch)의 경우 무려 149개, 분석한 새의 평균은 33.8개로서 새의 종에 따라 수적 변이가 무척 큼을 알 수 있다. 비둘기는 81개, 미시시피 악어(american alligator)는 20개, 푸른바다거북(green sea turtle)은 26개의 β-keratin 유전자의 수가 확인되었다. 닭의 β-keratin은 염색체 1, 6, 7, 10, 25, 27 등 여러 곳에 산재해 있으면서 발현된다(Greenwold et al., 2014; Kowata et al., 2014; Ng et al., 2014). 이러한 β-keratin의 종별 유전자 수의 차이는 선발과 육종을 포함한 가축화와 관련이 있을 것으로 추측된다. 새의 α-케라틴 유전자 변이는 2개로 알려져 있는데, 이에 반하여 β-케라틴의 경우 분석한 48종의 새에서 평균 약 34개의 β-케라틴 유전자 수를 나타내고 새 종에 따라서도 유전자 수는 차이가 많다. 가축화된 새 중에 북경오리와 칠면조와 같은 종은 β-keratin 유전자 수가 평균 보다 많은 46개이며, 닭의 경우 유전체에 약 240개의 케라틴 유전자 수가 있다(Kemp, 1975; Greenwold et al., 2014). 유전자 복제와 돌연변이가 깃털 진화와 관련 있으며 조류가 생태학적으로 다른 곳에서 적응할 수 있음을 보여 준다(Greenwold et al., 2014; Ng et al., 2014). 종합해 보면, 한때 새의 고유한 것으로 생각되었던 깃털은 새가 파생되기 훨씬 이전에 공룡에서 진화가 시작되었으며, 깃털 형성을 유도하는 유전자의 발현 조절, 새와 파충류에서 유일하게 발견되는 β-케라틴, 그리고 새 종에 따른 다양한 β-케라틴 유전자 수는 환경에 빠르게 진화하는 새의 한 단면을 볼 수 있다.
현대 조류의 호흡기 시스템과 관련된 독특한 해부학적 특징 또한 공룡 조상에서 진화하였다. 초기 트리아식 지구의 산소는 급격하게 감소한 다음 후기 트리아식까지 유지한 후 점진적으로 회복되었는데, 지구상에 공룡이 처음 출현한 후기 트리아식기의 산소 농도는 현재보다 낮은 시기였다(Berner, 2003; Tanner et al., 2004; Krause et al., 2018). 대기중 산소가 낮은 조건에서 공룡들은 산소를 더 효과적으로 흡입하기 위해 뼈속에 기공을 발달시켰으며, 이러한 특징은 후에 조류로 진화하며 기낭이라는 매우 독특한 호흡 시스템으로 발전하였다(O’Connor and Claessens, 2005). 닭을 포함한 대부분의 새는 포유동물이나 다른 척추동물에 비하여 상대적으로 작은 폐와 9개의 기낭(air sac)을 가지고 있다(Fedde, 1998). 기낭은 폐를 통한 공기의 흐름을 한 방향으로 진행하게 한다. 즉 새의 폐를 통해 이동하는 공기는 대부분 신선한 공기이고 산소함량이 높다. 이에 반해 포유동물에서 폐의 공기 흐름은 양방향으로서, 들어오는 공기와 나가는 공기가 혼합되어 상대적으로 산소함량이 적다. 따라서 새의 폐에서는 더 많은 산소가 혈액으로 확산될 수 있다(Duncker, 1971). 새는 공기가 들어오는 곳과 나가는 통로가 따로 되어 있어서 들어온 공기가 허파를 통과하여 나가기 때문에 허파 효율은 95% 이상으로, 사람을 포함한 포유동물의 허파 효율 약 30%에 비하면 매우 높다(Piiper and Scheid, 1975; Fedde, 1998). 또한 동일한 체질량 지수일 경우 조류 폐의 모세혈관의 혈액량은 포유동물에 비하여 2.5-3배 높다(Weibel, 1963; Maina, 2006). 포유류의 폐는 횡경막의 수축과 이완에 의해 동물이 숨을 쉬면서 확장하고 수축하는 폐포라고 불리는 수백만 개의 작은 풍선과 같은 허파꽈리로 구성되어 있지만, 새의 폐는 신축성이 없어 새가 숨을 쉴 때 크기가 변하지 않는다. 폐를 중심으로 앞과 뒤에 위치한 기낭들이 공기를 조절하는 풀무와 같은 주름상자 역할을 하면서 폐에 공기의 유입과 배출을 유도한다(Fedde, 1998). 공기주머니가 뼈로 확장되어 뼈의 구멍이 적어도 부분적으로 공기 낭으로 채워지면 공기가 채워진 뼈가 된다(Fig. 3). 날아다니는 새들은 공기가 채워진 뼈를 포함하여 더 광범위한 공기낭 시스템을 가지고 있다. 새가 비행을 위해 이륙하면 날개의 과장된 움직임은 뼈 안에 있는 것을 포함하여 공기주머니를 채우고 새가 날 만큼 몸을 충분히 가볍게 만든다(Duncker, 1971; Fedde, 1998). 포유동물은 밀도가 높고 촘촘한 뼈를 갖고 있는 반면, 조류의 경우 뼈의 가운데가 비어 있는 구조이다(동물 종류별 뼈 밀도 비교 review; Fabbri et al., 2022). 새의 기낭 호흡법은 고도가 높은 곳과 같은 낮은 산소 환경에서 좀 더 효율적으로 산소 확보를 하기 위해 만들어진 기능적 측면도 있다. 철새가 수천에서 수만 km를 쉬지 않고 날 수 있는 것도 바로 효율적인 허파를 가지고 있기 때문이다. 이러한 폐 시스템은 파충류에서 처음 진화를 하였지만, 현존하는 악어와 도마뱀은 단(한)방향 호흡이지만 복잡한 기낭 시스템은 없다(Farmer and Sanders, 2010). 대부분의 수각류 공룡은 새와 같은 폐를 가지고 있었다(O’connor and Claessens, 2005; Brusatte et al., 2015).
생물정보학과 분자세포유전학의 조합을 사용하여 조류의 공통 조상과 그 조상의 핵형(karyotype)을 재현하려는 연구들이 시도되고 있다. 진핵생물 세포의 핵 안에는 크고 작은 염색체가 존재하며, 생물의 종에 따라 염색체의 수와 형태는 일정하다. 사람을 포함한 대부분의 포유동물은 상동염색체로 짝을 지울 수 있는 대형염색체(macrochromosome)와 중형염색체(intermediate chromosome)로 구성되어 있고 염색체의 크기는 3-6μm으로 현미경으로 쉽게 관찰할 수 있다(Waters et al., 2021). Microchromosome(소형염색체)는 크기가 0.5 μm 이하로 매우 작지만 유전자가 풍부하고, 조류와 파충류에서 높게 보존되어 있고, 모든 조류 종과 많은 파충류 핵형의 보편적인 특성이다(Janke and Arnason, 1977; Waters et al., 2021). 전형적인 조류 핵형은 염색체의 약 40쌍 중에서 일반적으로 소형염색체는 30쌍이다(Burt, 2002; Waters et al., 2021). 한국 재래닭을 포함한 닭의 핵형은 8쌍의 대형염색체와 31쌍의 소형염색체(2n=78)로 구성되어 있다(Ladjali-Mohammedi et al., 1999; Sohn and Cho, 2010). 이러한 조류의 핵형은 약 1억-2억 5천만 년 전에 진화한 것으로 추정된다(Burt, 2002). 소형염색체는 유전체의 단지 25%(닭의 경우 18-23%)를 차지하지만, 유전자의 50%는 소형염색체에 존재하여 유전자 밀도가 대형염색체에 비하여 2-3배 높다(Smith et al., 2000). 조류는 육상 척추동물과 비교하여 가장 작은 유전체를 가지고 있다(Tierch and Wachtel, 1991). 조류에 대한 조상 유전체는 아마도 작은 유전체를 가지고 있었고, 반복이 적고 소형염색체가 있는 핵형을 추측할 수 있다(Tierch and Wachtel, 1991; Burt, 2002). 작은 유전체를 소유한 조류는 비행에 필요한 최소한의 에너지를 사용하는 방향으로 진화하는 적응 진화의 한 예가 될 수 있다(Hughes, 1999). 즉 척추동물에서 세포의 크기와 유전체의 크기는 서로 상관관계가 있으며, 작은 유전체를 지닌 조류의 세포는 일반적으로 포유류보다 더 작은 세포를 가지고 있고, 작은 세포는 산화적 대사율이 높다는 것이다(Szarski, 1983). 진화적 과정에 거북이, 뱀, 도마뱀에서 많은 소형염색체는 강하게 서로 작용하여 소형염색체 사이의 융합 또는 더 큰 염색체와 융합하여 독립적 염색체 기능은 소실되어 조류에 비하여 소형염색체의 수가 상대적으로 감소하였다(Waters et al., 2021). 조류의 DNA 함량의 최소화는 반복 염기서열의 반복 횟수 감소와 소형염색체의 재조합 속도의 극대화를 통한 진화 과정의 산물일 가능성이 높다(Burt, 2002). 이 과정을 통해 소형염색체 및 대형염색체의 특성(DNA 및 반복 함량, 유전자 밀도 및 재조합 속도)은 뚜렷한 염색체 유형을 만들면서 현생 조류의 특이적 핵형으로 진화한 것으로 보인다.
현존하는 새는 매우 빠르게 자라며 일반적으로 몇 주 또는 몇 달 안에 새끼에서 어른으로 성숙하며 흡열(온혈) 신진대사를 한다. 비조류 공룡은 파충류와 현생 조류의 중간 속도로 역시 빠르게 성장한다(Erickson et al., 2001). 시조새와 같은 가장 오래된 새와 에난티오르니틴(enantiornithines)과 같은 중생대 조류 그룹은 파생된 비조류 공룡과 유사한 성장률을 보이며, 현대 조류의 빠른 성장과 성숙은 중생대 시기에 더 진화된 오르니티투라(Ornithurae)에서 진화한 것으로 추정된다(Chinsamy, 2002; Erickson et al., 2009). 공룡이 항온(endothermy)동물이었는지 변온(ectothermy)동물이었는지를 화석으로 밝히기는 쉽지 않다. 그럼에도 불구하고, 뼈조직 연구를 통해 공룡들은 항온성과 변온성을 복합적으로 갖고 있다는 사실이 밝혀졌으며 신진대사에 기초해 공룡은 냉혈과 온혈의 중간인 중온열(Mesothermy)의 생리를 제시하기도 한다(Grady et al., 2014). 새는 공기에서 산소를 추출하는 효율적인 방법 덕분에 신진대사 속도가 매우 빠르다. 조류의 대사율은 포유동물보다 80-90%, 도마뱀보다 약 6배 높다(Dawson and Hubert, 1970; Nagy et al., 1999). 새(평균 체온 40°C)와 포유류(평균 체온 38°C)는 흡열을 수반하는 온혈성의 항온동물이다(Aschoff and Pohl, 1970; Hillenius and Ruben, 2004). 항온동물의 높은 대사 강도는 같은 조건에서 변온동물에 비하여 높은 산소 소비가 요구된다(White, 1978). 조류는 다른 척추동물에 비하여 일상의 물리적 활동 강도가 높기 때문에 동일한 체질량 기준으로 새는 포유류에 비하여 약 74% 이상 에너지를 더 소비한다(Powell, 1983). 이와 같이 대부분의 공룡은 현재 살아있는 파충류보다 새와 더 유사한 신진대사를 가진 것으로 보인다(Padian et al., 2001).








