서 론
최근 닭은 고도화된 육종개량으로 육량과 산란율 등과 같은 생산성 및 사료 효율이 현저히 개선되었다. 이러한 육종개량과 더불어 닭은 사육과정에서 고밀도 사육, 열 스트레스, 환경 및 사료 오염 등과 같은 다양한 외적 환경 스트레스 요인에 노출되어 체내 항상성 유지의 실패로 질병 발생이 급증하고 있는 것이 현재의 실정이다(Mishra and Jha, 2019; Surai et al., 2019). 농장에서 사육 과정 중 발생하는 많은 스트레스 요인을 모두 제어하는 것은 불가능하여 닭의 체 조직에서 과도한 활성산소(Reactive oxygen species, ROS) 생성에 따른 산화적 스트레스 발생은 매우 높다(Surai, 2003).
이러한 현실적 문제와 더불어 사료 첨가용 항생제 사용이 금지된 시대적 흐름에 따라 체내 항상성과 면역력을 증가시키는 식물성 항산화 물질에 관한 다양한 연구가 진행되고 있다(Jang et al., 2007a; Pashtetsky et al., 2019; Rafiei and Khajali, 2021). 항산화제는 지방산의 산패 방지로 사료 품질을 보호하는 기능뿐만 아니라 체 조직의 항산화, 면역 증진, 번식 능력 등과 같은 생리적 작용에도 큰 영향을 미친다(Fotina et al., 2013). 현재 사용되는 천연 항산화제로서 비타민 E, 합성 항산화제로서 BHT(butylated hydroxytoluene), BHA(butylated hydroxyanisole), exthoxyquin 등이 있다(Baszczyk et al., 2013). 닭 사료에서 BHT와 BHA는 150 mg(사료 kg당) 허용되고 있으며(FEEDAP, 2018), 비타민 E는 10-15 IU가 최소 요구량이다(KFSP, 2018). 비타민 E는 천연 항산화제로서 우수하지만, 경제적 측면에서 합성 항산화제가 널리 사용되고 있다. 페놀계 합성 항산화제인 BHT, BHA 및 ethoxyquin 등은 항산화 효과가 우수하지만 발암성 등과 같은 안전성 문제가 제기되고 있다 (Xu et al., 2021).
닭의 생산과정에서 식품 안전성, 기능성 및 동물 복지에 입각한 건강 지향적인 친환경 사육 방법은 소비자들이 가장 많은 주목하고 있는 부분이다. 닭 사육농가에서도 소비자들의 축산물에 대한 건강 지향적인 요구에 부응하면서 생산성에도 긍정적 영향을 미치는 식물성 항산화제(phytochemicals) 개발과 사용에 관심이 매우 높다. 따라서 본 고찰에서는 닭의 체 조직에서 발생하는 산화적 스트레스와 항산화 방어 기전에 대해 살펴보고 사료첨가제로 사용할 수 있는 식물성 항산화 물질들 중 flavonoid 계열을 중심으로 이들의 항산화 효과를 조사하였다. 본 고찰을 통해 닭 사육 농가에서 이용할 수 있는 식물성 flavonoid 항산화 사료첨가제에 관한 연구 정보를 제공함으로 친환경 닭고기 및 계란의 생산을 촉진하고자 한다.
본 론
닭은 생물학적 대사 작용, 사육 환경, 영양관리 등에 따라 체 조직의 항상성 유지에 부정적인 영향을 미치는 다양한 종류의 내외적 스트레스에 직면하게 된다(Table 1). 닭의 생산과정에서 발생하는 산화적 스트레스 요인을 상세하게 살펴보면 먼저 내적 요인으로 닭은 성장과 산란 능력 위주로 육종개량 되어 대사율이 현저히 높다. 따라서 대사 작용에 따른 체내 산소 요구량 증가로 superoxide anion, hydrogen peroxide 등과 활성산소(ROS)의 생성이 과도하게 발생한다(Julian, 2005). 특히 급격한 성장이 이루어지는 부화 전후와 육성기에서 대사 작용의 증가로 과도한 ROS가 생성되어 심각한 산화적 스트레스를 유발하며(Surai et al., 1999), 이러한 스트레스에 대응하기 위해 이 시기에 항산화 방어 체계도 급격하게 발달한다(Circu and Aw, 2012). 닭은 부화 전후 항산화 효소가 간 등 모든 장기 조직에서 발현하며 항상성 작용에 중요한 역할을 담당한다(Kim et al., 2021). Tang et al.(2019)의 연구에 의하면 병아리는 체 조직이 급격하게 발달하는 시기에 활성산소를 다량 생산하기 때문에 특히 간 조직에서 매우 높은 superoxide dismutase(SOD)와 glutathione peroxidase(GPX) 수준을 유지하는 것으로 보고하였다. 또한 닭의 간 조직에서 합성되는 비타민 C는 ROS와 반응하고 환원형 glutathione의 재생 작용에도 관여하는데(Laudicina and Marnett, 1990) 현저히 증가한 근육에서 과도한 ROS 생성으로 체내 생성되는 비타민 C는 부족하게 된다(Khan et al., 2012).
1 Adapted from Surai and Fisinin (2016).
다음으로 닭의 사육과정에서 발생하는 외적 산화적 스트레스 요인을 살펴보면 먼저 사육밀도 증가와 고온 스트레스가 닭에서 급격하게 산화적 스트레스 지표인 Heat shock protein(HSP) 발현을 증가시키는 것으로 보고되었다(Najafi et al., 2015). 고온 환경에 의해 ROS가 증가하고(Mishra and Jha, 2019), 간 조직에서 항산화 효소 SOD와 지질과산화물이 증가하는 것으로 보고되었다(Tan et al., 2010). 특히 고온 스트레스에서 과도하게 발생된 ROS는 소장 흡수세포의 손상을 유발하는 염증 발생률을 높여 영양소 흡수 기능을 저하시킴으로 생산성을 저하시킨다(Mishra and Jha, 2019). 고온 스트레스에 의해 생성된 ROS는 소장 흡수세포에서 면역 신경계의 이상을 유발하여 점막조직으로 병원성 미생물의 침투를 유발하여 면역 작용을 저하시키는 것으로도 보고되었다(Zhao et al., 2017).
병원성 미생물 등에 의한 감염 역시 닭의 체 조직에서 심각한 산화 스트레스를 발생시키는 것으로, 병원성 미생물과 원충(Eimeria acervulina) 감염 닭의 소화기에서 지질과산화에 따른 산화적 스트레스로 항산화 불균형으로 면역 저하를 초래한다(Mishra and Jha, 2019; Naidoo et al., 2008). 육계에 장내 유익균(L. plantarum, Bifidobacterium, L. spp, Saccharomyces cerevisiae) 급여 시 간 조직에서 SOD와 GPX 발현이 증가하고 지질과산화물이 감소하여 산화 스트레스가 완화되고 친염증 사이토카인 발현이 감소하는 것으로 나타났다(Mohammed et al., 2019; Ogbuagu et al., 2018).
또한 사육 환경에서 필연적으로 발생하는 먼지, 암모니아, 에어졸 성분이 닭의 체 조직에서 산화적 스트레스를 유발하는 요인으로 작용한다. Zhang et al.(2015)은 과도한 암모니아를 흡입한 닭에서 혈장 SOD 활성도가 감소하여 산화적 스트레스가 증가하여 소장 점막세포의 세포사가 초래된다고 보고하였다. 또한 닭 사육 시 사료 섭취량을 증가시켜 증체와 산란율을 높이기 위해 광원을 16시간 이상으로 증가하는데 이러한 환경에서도 근육의 산화적 스트레스를 유발한다(Ozkan et al., 2012; Tuell et al., 2020).
특히 사료에 오염된 곰팡이 독소와 유해 물질은 소화기관에 치명적인 독성을 초래할 수 있다. 오염된 사료에 존재하는 aflatoxin, fumonisin, ochratoxin, zearalenone, T-2 toxin 등의 곰팡이 독소는 소장점막에서 지질과산화를 증가시켜 소장 흡수세포에서 영양소 흡수 및 면역 작용에 치명적인 손상을 일으킬 수 있다(Mishra and Jha, 2019; Surai, 2020). 사료나 음수와 환경에 존재하는 비소, 구리 등과 같은 중금속 역시 지질과산화를 초래하여 체 조직에서 항산화력을 감소시키고 염증과 세포사를 유발하는 인자로 보고되었다(Wang et al., 2018).
일반적으로 닭의 사육과정에서 발생하는 스트레스는 오랜 기간 진행되며 이러한 요인들이 닭의 증체, 건강, 번식, 부화율 등과 같은 생산능력에 직간접적인 영향을 미친다. 다양한 요인에 의해 발생하는 과도한 산화적 스트레스는 닭의 항상성과 면역 저하로 생산성과 동물복지 등에 문제를 유발하며 궁극적으로 사육 농장에 막대한 경제적 손실을 초래한다.
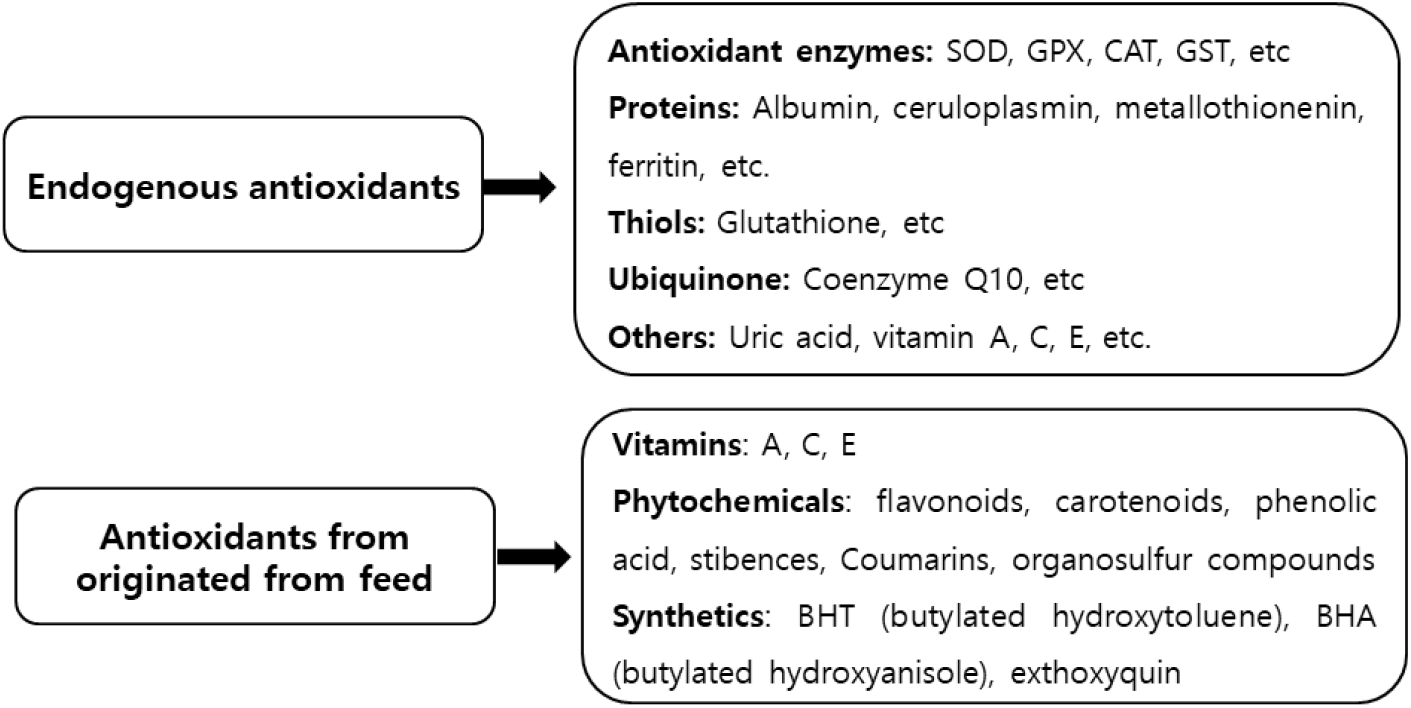
닭 사육과정에서 발생되는 산화적 스트레스는 조직(세포)에서 단백질 질산화(protein nitration), DNA 손상, 세포사(apoptosis) 등을 유발한다. 체 조직에서 생성되는 superoxide anion, H2O2, hydroxyl radicals 등과 같은 활성산소(ROS)와 활성질소(reactive nitrogen species) 및 지질과산화 등이 산화적 스트레스 요인들에 속한다(Estevez, 2015). 따라서 닭은 다양한 내외적 산화적 스트레스 요인에 따라 면역, 건강 등의 항상성 유지를 위해 세포의 손상을 초래하는 산화물질을 제거하는 항산화 방어기전을 가지게 된다(Circu and Aw, 2012; Naidoo et al., 2008). 항산화 방어 기전은 동물의 연령, 품종, 활성산소 종류, 질병 등에 따라 영향(Nijhoff and Peters, 1992)을 받는데 과도한 산화 스트레스가 발생하면 항산화 효소와 비효소적 항산화 물질에 의해 활성산소를 제거하는 방어체계가 작동된다(Suari, 2003). 닭 생산과정에서 체내 생성 또는 사료를 통해 공급될 수 있는 항산화 방어 물질은 Fig. 1에서 나타낸 바와 같다.
항산화 작용에 관여하는 효소들은 SOD, GPX, catalase 및 GST(glutathione S-transferase) 등으로 먼저 SOD는 체 조직에 널리 분포하며 O2−를 H2O2로 전환하여 지질과산화를 제거하는 작용을 개시한다(Suari, 2003). GPX는 H2O2를 H2O로 전환하는 효소로서 지질과산화물을 무독화하는 역할을 한다(Tappel et al., 1978). Catalase는 탈수소반응을 유도하여 활성산소를 제거하여 산화적 손상을 방지하는 효소로서 한 분자는 초당 수백만 개의 과산화수소 분자를 H2O와 O2로 전환하는 높은 활성도를 띤다(Aebi, 1984).
비효소적 방법으로서 산화물과 ROS를 소거하는 항산화 방어 작용은 먼저 혈액에 존재하는 여러 종류의 단백질 및 비타민 등의 상호작용으로 작동한다. 혈장 protein, albumin 및 uric acid와 같은 질소화합물이 총 항산화력의 약 70%를 담당하는 중요한 역할을 한다(Park and Kweon, 2013). 금속결합 단백질로서 albumin은 구리 이온에 의한 지질 과산화 작용과 수산기 형성을 억제하여 항산화 작용을 한다(Halliwell and Gutteridge, 1990). 그 외 ceruoplasmin, metallothionenin, ferritin 등과 같은 금속결합 단백질도 항산화 기능을 나타낸다(Pashtesky et al., 2019). GSH는 활성산소, 과산화물, 지질 과산화물 등으로부터 세포 손상을 방지하는 펩타이드이다(Wu et al., 2004). 체 조직에 존재하는 비타민 A, E, C 등 항산화 비타민 역시 직간접적으로 ROS와 반응하여 자신은 안정한 유리기가 되어 다른 화합물이 유리 산소기가 되는 연쇄반응을 억제한다(Wayner et al., 1987; Rafiei and Khajali, 2021). Coenzyme Q10(CoQ10)은 미토콘드리아 내막에 존재하는 물질로서, ROS를 소거하여 지질과산화 작용을 억제하는 항산화 작용에 관여한다(James et al., 2004; Acosta et al., 2016). 산란계에 CoQ10을 급여 시 혈액, 간, 근육에서 CoQ10이 증가하고 항산화 효과(Krizman et al., 2013; Moon and Jang, 2022)를 나타내며, 육계에서는 복수증 발생이 감소되는 것으로 보고되었다(Geng et al., 2004). 이는 CoQ10이 심장과 폐 조직의 미토콘드리아 세포호흡에서 ROS를 억제 또는 소거함으로 복수증을 예방하기 때문이다(Geng et al., 2004).
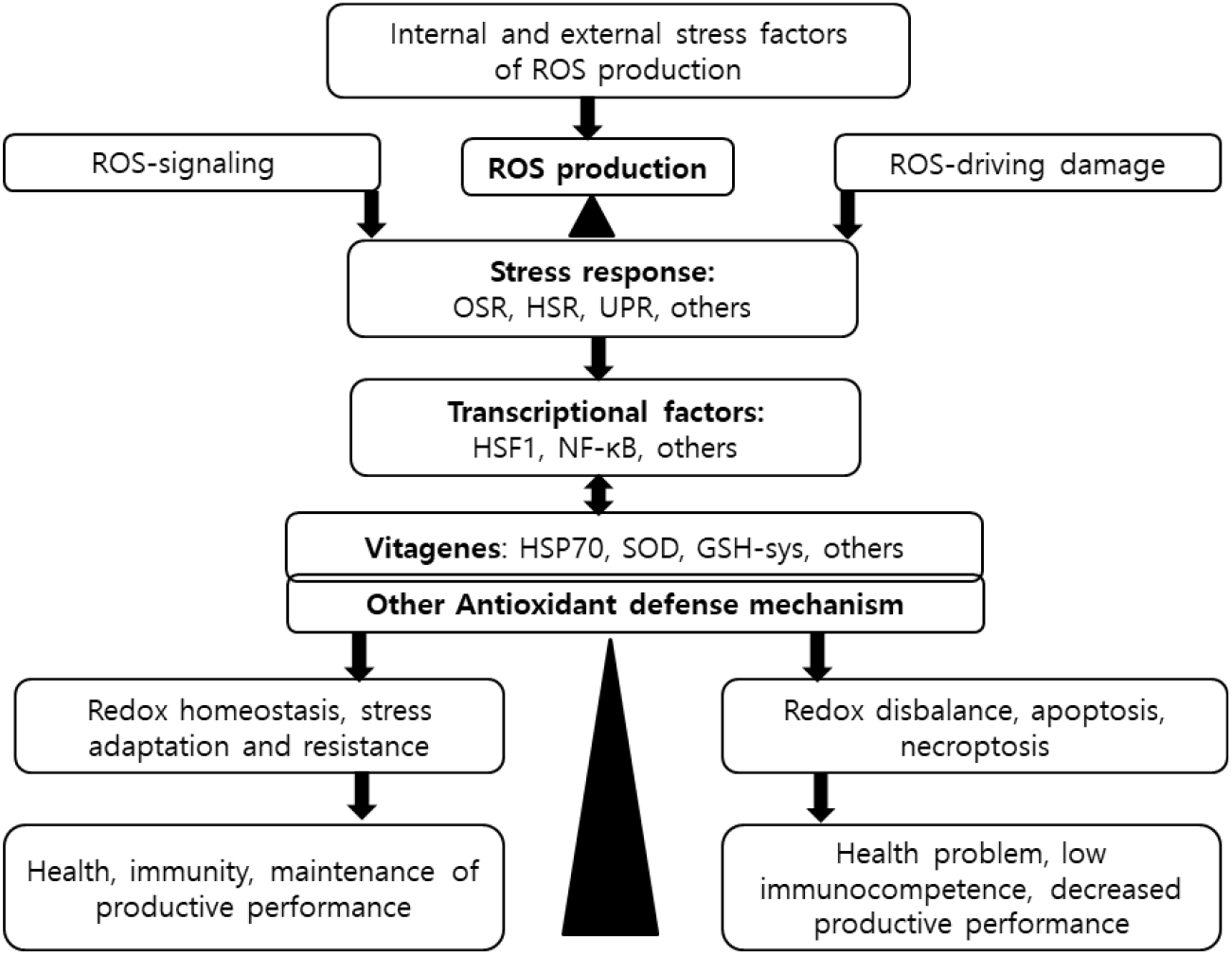
Fig. 2는 닭의 체 조직(세포) 수준에서 발생하는 항산화 방어시스템을 체계적으로 정리한 그림이다(Surai et al., 2019). 내외적 스트레스에 노출되면 미토콘드리아와 식세포에서 ROS가 생성되어 신호 전달 작용을 하지만 과도하게 발생되면(산화 스트레스, OSR) 지질과산화, DNA/RNA 손상을 유발하여 닭의 건강 및 생산성에 부정적 영향을 미친다. 항산화 방어 작용에 관련된 전사인자 및 유전자들의 발현 현상은 복잡한 요인들이 관여하는 바, 그 발생 기전을 보면 HSR, UPR 등과 같은 스트레스 반응 프로그램에 의해 다양한 전사인자들(HSF1, Nrf2, Nf-kb 등)을 발현시키고 이에 따른 스트레스 반응 유전자(vitagenes, HSP70, SOD, GSH-sys 등)의 발현을 유도한다. 만약 산화-환원 불균형(redox imbalance)으로 과도한 조직의 손상이 발생하면 닭에서 질병 발생으로 경제적 손실이 초래된다(Surai and Fisinin, 2016).
닭의 사육과정에서 다양한 내외적 산화적 스트레스 발생은 필연적으로 최근 영양학적인 방법으로 항산화 방어체계를 유지하는 전략이 매우 중요한 닭의 사육 관리 방법으로 인식되고 있다. 현재까지 항산화 비타민과 광물질 등 영양소를 이용한 항산화 방어 작용 연구가 많이 진행되었다(Surai, 2019; Surai, 2020). 최근에는 항산화 영양소와 더불어 닭 생산 농가와 영양학자들은 천연 식물성 성분으로 항산화 방어 작용 효과가 우수한 phytochemical(flavonoids)의 개발에 주목하고 있다.
식물유래 천연물은 구성 성분인 flavonoid를 포함하는 다양한 polyphenolic 계열의 항산화 성분을 함유하고 있으며 오래전부터 인체 연구를 통해 그 효능이 널리 밝혀져 있다. 천연물질(phytobiotics)의 polyphenol 화합물은 항산화 기능이 우수하며 합성 페놀 항산화제와 유사한 활성을 보인다고 보고되었다(Pashtetsky et al., 2019). 이러한 연구를 근거로 닭의 체 항상성 유지에 사용할 수 있는 항산화 사료첨가제의 소재로서 식물성 화학물질(phytochemicals) 등에 관한 많은 연구가 진행되고 있으며 친환경 생리활성 물질로서 관심도가 매우 높다. Polyhenol 화합물이 다량 함유된 녹차, 베리류, 포도, 오미자, 허브 등 다양한 종류의 녹황색 식물이 닭에서 항산화 기능과 면역을 증가시키는 것으로 많이 보고되었다(Surai, 2003; Ko et al., 2012; Fotina et al., 2013). 특히 polyphenol 성분에서 가장 많은 주목을 받는 항산화물질은 flavonoids 계열로서 화학 구조에 따라 flavonols, flavones, isoflavones, anthocyanidins, flavanones, flavanols, and chalcones 등 7종류(Table 2)로 분류된다(Shen et al., 2022).
Flavonoid는 식물 및 과일에 풍부하게 존재하며 flavonoids의 구조화합물이 활성산소와 결합하여 안정화할 수 있는 구조로서 직접 ROS를 소거한다(Zuo et al., 2018). 일부 flavonoids 성분은 항산화 효소의 발현을 촉진하여 ROS를 제거하는 작용, 금속 이온과 결합하는 킬레이트화 작용, α-tocopherol radical과 결합하여 안정화 작용, 산화효소 및 NO 생성 억제 및 항산화물질인 uric acid 생성 촉진 작용 등 다양한 항산화 작용이 보고되고 있다(Shen et al., 2022).
Flavanol 계열로서 catechin, epiballocatechin(ECG), epicathechin-3 gallate(EGC) 등과 같은 flavonoid 화합물을 다량 함유한 대표적 식물은 녹차로서 국내외에서도 많은 연구가 진행되어 항산화 기능이 높다는 사실이 증명되었다(Farahat et al., 2016; Kim et al., 2010). Flavonols, anthocyanin 등과 같은 flavonoid 화합물을 함유한 포도 씨앗도 천연 식물성 항산화제로서 중요한 위치를 차지하고 있다(Sano, 2017). 포도 씨에는 proanthocyanidin 성분이 함유된 대표적 식물로서 농산부산물로서 대량 생산이 가능하다. Shi et al.(2003)은 polyphenol 계열의 proanthocyanidin은 체 조직에서 비타민 E 및 C와 비교 시 각각 20배 및 50배 이상의 항산화력을 보인다고 하였다. 포도 씨앗 추출물(proanthocyanidin)을 닭에게 급여 시 환경 스트레스에 의해 발생하는 ROS를 소거하여 소화기관과 근육조직에서 지질과산도를 감소시키는 연구 결과가 발표되었다(Bonilla and Sorbal, 2016; Farahat et al., 2016). 본 연구팀에서도 육계에서 항산화제로서 포도 씨앗 1% 분말 급여 시 혈장 total antioxidant status가 대조구에 비해 유의적으로 증가(26%) 하여 항산화 사료첨가제로 사용될 수 있는 가능성을 증명하였다(Jang et al., 2007b). 다양한 종류의 베리류(blue berry, blackberry) 역시 최근에 닭 농장에서 anthocyanin과 flavonoid 등을 함유한 천연 항산화 사료첨가제로서 많은 주목을 받고 있다(Pashtesky et al., 2019). Anthocyanin과 flavonoid가 다량 함유된 석류껍질 또는 추출물을 육계에게 급여 시 항산화 기능에 따라 생산성, 위장관의 건강과 근육의 지질과산화도를 감소시키고 닭고기의 저장기간을 증가시켜 매우 유용한 천연 항산화제로 사용할 수 있다는 연구들이 보고되었다(Sarıca and Urkmez, 2016; Sharifiana et al., 2019; Ghosh et al., 2020).
또한 flavonol의 일종인 quercetin을 닭에게 급여하였을 때 생산성과 지질과산화도를 방지하여 닭고기의 저장성이 향상되어 항산화 사료첨가제로서 가능성이 보고되었다(Goliomytis et al., 2014). Isofalvone 계열인 genistein을 육계에게 급여 시 가슴근육에서 HSP70 mRNA 발현 감소(Kamboh et al., 2013), 지질과산화도 감소와 혈장의 전체 항산화력 및 SOD 활성도가 증가하는 것으로 항산화제 소재로써 이용 가치가 높다(Jiang et al., 2007).
Oregano 역시 flavonoid, thymol 등을 포함하는 다양한 항산화 화합물을 함유한 생리활성 오일은 천연물로서 육계에게 급여 시 성장, 항산화 작용, 근육 지질 과산화 억제 작용 등 다양한 효능이 보고되고 있다(Jang et al., 2007a; Muller et al., 2012; Kirkpinar et al., 2014; Zhang et al., 2021).
또한 국내에서는 그 효능이 증명된 flavonoid 함유 한방생약 소재가 항산화 작용이 우수한 것으로 사료 첨가제로써 활용 가치가 주목된다(Hong et al., 2001; Ko et al., 2012; Kim et al., 2015). 항산화 물질 함유한 농산제조 부산물(포도 씨앗, 베리류 등) 역시 flavonoid 계열의 성분 많아 경제적으로 천연 항산화제로 개발할 수 있는 것으로 보고되었다(Jang et al., 2007b).
지금까지 30여 년 동안 flavonoid 함유 항산화 사료첨가제로서 천연물에 관한 다양한 연구가 진행되어 효능이 입증되었고 일부는 상업적 사료첨가제로서 개발되어 사용되고 있다. 그러나 이러한 효능에도 불구하고 천연 항산화제로서 실질적으로 닭 사육농장에서 널리 사용되기 위해서는 여러 가지 문제점이 있다. 식물유래 flavonoid 성분은 생물학적 in vivo 상태에서 흡수율과 첨가 용량 등의 문제로서 직접적인 항산화 능력보다는 간접적인 항산화 능력을 나타내는 경우가 많은 것으로 보고되었다(Surai, 2020). 이러한 이유로서 flavonoid 화합물은 용해도가 낮아 소장 흡수세포에서 흡수율이 매우 낮기 때문이다(Surai, 2020). 이러한 문제를 해결하기 위하여 flavonoid 흡수를 높일 수 있는 기술의 개발이 필요한데, 리포좀 형태로 제조하면 효과적으로 생체 내로 흡수될 수 있는 가능성이 높다(Ulit’ko et al., 2017). 특히 리포좀 형태로 급여하면 간 조직의 이물질 해독과정에서 2차 대사산물로 전환되는 것을 예방할 수 있어 효과적인 항산화제로 작용할 수 있다(Ulit’ko et al., 2017). 다음으로 닭의 사료첨가제로서 항산화 기능을 나타내는 용량 및 농도의 결정에 어려움이 있다. 이는 flavonoid의 체내 흡수율과 밀접한 관련이 있는 것으로 in vitro에서는 그 효과가 우수하지만, 사료첨가제로서 급여 시 생체에서 항산화 효과를 기대하기가 쉽지 않다. 이러한 문제점을 극복하는 방안의 하나로서 사료 섭취 시 천연 항산화 물질의 농도가 가장 높은 위장관에서 항산화 효과가 나타나는 용량을 조사하여 첨가 수준을 결정하는 것이다(Hu et al., 2019). 위의 문제 해결과 함께 닭에서 가장 효율적으로 flavonoid의 항산화 효과가 나타낼 수 있는 종류별 작용 기전에 관한 면밀한 연구가 요구된다. 즉 각종 flavonoid가 Nrf-2와 Nf-kB 등과 같은 전사 인사의 발현 과정과 viatgenes을 통해 효율적인 항산화 효과를 나타낼 방법 등에 관한 연구가 필요하다(Surai, 2020).
가금 생산과정에서 육종개량 및 사육 환경 요인에 따라 필연적으로 발생하는 산화적 스트레스는 면역 및 생산성 저하로 경제적 손실뿐만 아니라 동물복지 측면에서도 심각한 문제를 유발함으로 flavonoid와 같은 식물유래 천연 항산화제는 개발과 적용은 가금 산업에서 매우 중요한 분야가 될 것으로 향후 전망된다.