Article
Simvastatin이 메추리 근육 세포에 미치는 영향
박정웅1
,
최유승2
,
최사랑3
,
이상인4
,
신상수4,†
Simvastatin Induces Avian Muscle Protein Degradation through Muscle Atrophy Signaling
JeongWoong Park1
,
Yu-Seung Choi2
,
Sarang Choi3
,
Sang In Lee4
,
Sangsu Shin4,†
Author Information & Copyright ▼
1Post-Doctor, Department of Animal Science and Biotechnology, Kyungpook National University, Sangju 37224, Republic of Korea
2Undergraduated Student, Department of Animal Science and Biotechnology, Graduate School, Kyungpook National University, Sangju 37224, Republic of Korea
3Graduate Student, Department of Animal Science and Biotechnology, Graduate School, Kyungpook National University, Sangju 37224, Republic of Korea
4Professor, Department of Animal Biotechnology, Kyungpook National University, Sangju 37224, Republic of Korea
© Copyright 2022, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Nov 29, 2022; Revised: Dec 19, 2022; Accepted: Dec 19, 2022
Published Online: Dec 31, 2022
ABSTRACT
Many studies on poultry have been conducted in the poultry industry to improve their important economic traits, such as egg production, meat quality, and carcass yield. Environmental changes affect the poultry’s economic traits, including muscle growth. The purpose of this study is to investigate the mechanisms by which simvastatin causes muscle injury in quail muscle cells. Following treatment with various doses of simvastatin, LD50 in the quail myoblast cells was determined using a cell viability test; cell death was caused by apoptosis and/or necrosis. Thereafter, the expression patterns of the atrophy marker genes were examined via quantitative reverse-transcription polymerase chain reaction (qRT-PCR). The results showed that the transcriptional levels of the muscle atrophy marker genes (Atrogin-1, TRIM63) and the upstream genes in their signaling cascade were increased by simvastatin treatment. This indicated that simvastatin induced myogenic cell death and muscle injury via protein degradation through muscle atrophy signaling. Further studies should focus on identifying the mechanism by which simvastatin induces the protein degradation signaling pathway in quail muscle..
Keywords: 메추리 근육세포; Simvastatin; 근육손상; 발현 패턴 분석; qRT-PCR
Keywords: quail muscle cell; simvastatin; muscle injury; expression pattern; qRT-PCR
서 론
가금 산업에 있어서 산란율과 도체량은 중요한 형질 중 하나이다. 그러기에 많은 연구들을 통해 계란 생산량과 도체량을 늘리기 위하여 많은 노력을 기울여왔다(Van et al., 1999). 그러나 최근에 이르러서는 지구 온난화을 비롯한 기후 변화와 외부 환경 스트레스로 인해 가금 생산에 많은 위험성이 대두되고 있으며, 이들의 영향을 저감하기 위한 많은 연구들이 진행되고 있다(Pan et al., 2019; Chen et al., 2021; Behboodi et al., 2021). 이러한 외부 환경의 변화는 가금의 산란율과 젖소의 우유 생산량과 같은 축산물 생산 감소뿐 아니라(Sejian et al., 2018; Mehaisen et al., 2019), 근육 손상 등으로 인해 도체량에도 부정적 영향을 끼친다(Baziz et al., 1996; Zhang et al., 2011a).
근육의 성장과 분화, 재생은 가금을 포함한 다양한 척추동물에서 복잡한 과정에 의해 조절이 된다. 이러한 근육에 대한 세포생물학적 이해를 위하여 다양한 종에서 근육 세포들이 확립되었으며(Yaffe and Saxel, 1977; Antin and Ordahl, 1991), 가금에서는 메추리의 근아세포(Myoblast)에서 파생된 QM7 세포주가 사용되고 있다(Kim et al., 2016; Kim et al., 2017). 일반적으로는 근육 세포의 증식과 분화에는 MRF(myogenic regulatory factors)라고 하는 근형성 인자들에 의해서 일어난다(Hernández-Hernández et al., 2017). MRF는 4개의 단백질(MyoD, Myf5, Myogenin, MRF4)로 구성이 되어 있으며(Miner and Wold, 1990; Buckingham and Rigby, 2014), 근육 특이적인 유전자의 발현을 조절하여 근육의 분화를 조절한다(Buckingham and Rigby, 2014).
Simvastatin은 statin 계열의 약물로, 지질 수치의 감소를 위해, 운동, 식이조절, 체중 감량과 더불어 사용된다. 또한, 산화 스트레스, 염증 및 섬유증을 감소시키는 콜레스테롤 독립적인 메커니즘이나 다면발현효과(pleiotropic effect) 메커니즘을 통해 심혈관 계통을 개선한다(Antonopoulos et al., 2012; Tanaka et al., 2013). 이러한 이유로 일반적으로는 주로 심혈관 합병증의 위험이 증가하는 환자의 콜레스테롤 합성을 조절하는 데 사용된다(Lansberg et al., 1995). 또한 이 외에도 Simvastatin은 사이토카인의 생성을 억제하고, 일산화질소의 생성을 감소시켜 항염증의 기능을 한다고 알려져 있다(Miller et al., 2013; Silveira et al., 2013). 다양한 선행 연구에 따르면 Simvastatin은 만성 혈액 투석 모델, 폐와 간 손상 모델, 그리고 천식 모델에서 각 조직의 손상을 저감한다고 보고되었다(Kirmizis et al., 2010; Zhang et al., 2011b; Xu et al., 2012; La et al., 2013). 하지만 조직 손상에 있어 긍정적인 기능에도 불구하고, 일부 다른 조직에서는 심각한 부작용을 초래한다고 알려져 있다. 가장 잘 알려진 부작용으로는 변비, 두통, 메스꺼움 등이 있으며, 심각한 부작용으로는 근육 붕괴, 간 질환, 혈당 증가 등이 있다(Beard and Edward, 2001). 이런 부작용을 가지고 있음에도 불구하고, Simvastatin은 일부 근육 세포의 연구를 수행하는 실험에서 근육 손상 모델을 유도하기 위하여 많이 사용하고 있다(Otrocka-Domagała et al., 2018; Sanvee et al., 2019). 본 연구는 메추리 근아세포(myoblast)인 QM7 세포에 Simvastatin 처리를 수행하고, 이를 통하여 근육 세포의 손상을 유도하였다. 이 후, 손상된 QM7 세포를 활용하여 분자생물학적 검증을 수행하고, 어떤 신호 전달 경로를 통하여 근육의 손상이 유도되는 지를 검증하고자 하였다.
재료 및 방법
1. 세포 배양 및 물질처리
QM7세포(Quail muscle cell; American Type Culture Collection, Manassas, VA, USA)는 10% fetal bovine serum(FBS; Invitrogen, Carlsbad, CA, USA), 1% chicken serum(Sigma-Aldrich, St. Louis, MO, USA), 1% antibiotic-antimycotic(Invitrogen)를 포함한 Medium199(Sigma- Aldrich) 배양액을 이용해, 37°C, 5% CO2 조건에서 배양되었다. Simvastatin은 Sigma-Aldrich에서 구매하였으며, 제조사에서 제시한 방법에 따라 냉장고에 보관하여 실험을 수행하였다. QM7세포는 다양한 농도의 Simvastatin으로 처리가 되었으며, Simvastatin 처리가 수행되는 동안 배지의 조성은 기존의 성장 배지로 유지가 되었다.
2. Annexin-V / Pi Staining
QM7세포는 세포의 괴사(Necrosis)와 사멸(Apoptosis)을 확인하기 위하여 Annexin-V / Pi staining을 수행하였다. QM7세포는 PBS로 세척하였으며, 1 × Annexin binding buffer를 처리하였다. 이 후, 5 μL의 Alexa Fluor 488 Annexin-V(Thermo Fisher Scientific, Wilmington, DE, USA)와 1 μL의 100 mg/mL PI 시약을 첨가하였다. 그 후, 세포들은 실온에서 15분 동안 어두운 곳에서 배양되었으며, 형광현미경(한국 경기도 성남시 한국랩텍)으로 촬영하였다.
3. RNA 추출 및 cDNA 합성
QM7세포에서의 RNA 추출은 RNAiso Plus kit(Takara, Japan)을 사용하여 진행되었다. RNA 추출은 6 well 기준 200 uL의 RNAiso Plus reagent를 넣고 PIpetting을 통하여 완전히 풀어준 다음 상온에 5분간 정치시켰다. 그 다음 100 μL의 chloroform을 넣고 15초간 섞어준 후 상온에서 10분간 정치시켰다. 그 다음 4°C에서 15분간 12,000 rpm으로 원심분리하여 상층액을 새 1.5 mL 튜브에 옮기고, 250 μL의 isopropanol을 넣고 여러 번 흔들어 주었다. 그 후 다시 4°C에서 10분간 12,000 rpm으로 원심분리를 실시하여 상층액을 버리고, 75%의 ethanol(DEPC-ethanol)을 500 μL를 넣고 다시 4°C에서 5분간 12,000 rpm으로 원심 분리를 하였다. 마지막 원심분리 후, 상층액을 버리고 pellet을 상온에서 잠시 건조시킨 후, RNase-free water 20 μL를 넣어서 녹이고, NanoDrop ND-1000 Spectrophotometer(Thermo Scientific, Wilmington, DE, USA)를 사용하여 농도와 순도를 확인한 다음–80°C에 보관하였다.
cDNA의 합성은 1st strand cDNA Synthesis Kit(Takara, Japan)를 사용하였으며 제조사 프로토콜을 따라 합성을 진행하였다. 먼저 RNA를 1 ug 넣은 후 oligo dT primer 1 μL, dNTP 1 μL 그리고 나머지는 DEPC-treated water를 사용하여 전체 10 μL를 만들었다(Mixture 1 − 전체 10 μL). Mixture 1를 65°C에서 5분간 정치 후 ice에 옮겨 두었다. 그 다음 5 × Buffer 4 μL, RNase inhibitor 0.5 μL, RTase 1 μL, 나머지 DEPC-treated water를 넣어주었다(Mixture 2 − 전체 20 μL). 30°C에서 10분간 정치시킨 후, 50°C에서 60분간 처리하여 최종적으로 cDNA를 획득하였다.
4. Polymerase Chain Reaction(PCR) 및 전기 영동
PCR 반응액은 각 cDNA 1 μL, primer(F+R) 2 μL, 10 × buffer 2.5 μL, dNTP 2 μL, Taq 0.3 μL 그리고 D.W 17.2 μL로 총 25 μL을 사용하여 진행하였다. PCR 조건은 우선 94°C에서 10분간 변성시키고, 94°C에서 30초, 각각의 annealing 온도에서 30초, 그리고 72°C에서 30초로 이루어진 cycle을 38회 반복하였고, 최종적으로 72°C에서 5분간 신장하여 완료하였다. PCR 결과물들은 1.5% agarose gel을 이용하여, 90V에서 50분간 전기영동을 실시하였으며, UV transilluminator를 통해서 각 샘플들의 유전자 발현차이를 조사하였다.
5. Quantitative Real-Time PCR(qRT-PCR)
유전자들의 상대적 발현량을 확인하기 위해서 BioRad CFX-96(BioRad, Hercules, CA, USA)을 사용하여 real-time PCR을 수행하였다. 실험에 사용되었던 primer의 서열은 Table 1에서 보는 바와 같다. PCR 반응물은 각 시료의 cDNA 2 μL, primer(5pmol/μL, F+R) 2 μL, 10 × buffer 2.5 μL, dNTP 1 μL, Taq 0.2 μL, SYBR Green(Bio-Rad, Hercules, CA, USA) 1 μL에 D.W 16.3 μL를 추가하여 총 25 μL를 사용하였다. Real-time PCR 조건은, 우선 94°C에서 10분간 변성시키고, 94°C에서 30초, 각 primer 별 annealing 온도에서 30초, 그리고 72°C에서 30초간의 40 cycle을 반복하고, 마지막으로 65°C에서 95°C까지 5초당 0.5°C씩 총 5분간 melting curve를 확인하였다. 모든 측정은 시료 당 3회 반복하였고, 2−ΔΔCt 방법[ΔΔCt = 처리구(타켓 유전자의 Ct 값 – GAPDH 유전자의 Ct 값) – 대조구(타켓 유전자의 Ct 값 – GAPDH 유전자의 Ct 값)]을 이용하여 유전자의 상대적 발현량을 계산하였다(Livak, 2001). 유전자의 상대적 발현량을 계산하기 위해 glyceraldehyde-3-phosphate dehydrogenase (GAPDH)를 참조 유전자로 이용하였다.
Table 1.
Primer sets used in this study
| Primer name |
Primer sequence (5′ to 3′) |
Tm (°C) |
Product size (bp) |
| TRIM63-F |
GAT TTT TGG GGT GCA GAG AA |
58 |
201 |
| TRIM63-R |
CTG GGG AGT CAG GAT GAA AA |
- |
- |
| FBXO32-F |
GGC TGC TGT GGA AGA AAC TC |
58 |
188 |
| FBXO32-R |
CCA AGA GAG GAT GTG GCA AT |
- |
- |
| SMAD2-F |
CAG AAA CGC AAC AGT GGA GA |
58 |
174 |
| SMAD2-R |
GGT GGG ATT TTG CAG ACA GT |
- |
- |
| SMAD3-F |
TGG CTC AGT CTG TGA ACC AG |
60 |
190 |
| SMAD3-R |
CCC ATC TGT GTG AGG ACC TT |
- |
- |
| FOXO1-F |
AAG CCC CAG CTC TCA CAG TA |
60 |
203 |
| FOXO1-R |
TCT CTG AAA GGC TGG GAA GA |
- |
- |
| GAPDH-F |
GGA CAC TTC AAG GGC ACT GT |
60 |
160 |
| GAPDH-R |
TCT CCA TGG TGG TGA AGA CA |
- |
- |
Download Excel Table
결과 및 고찰
1. 근육 손상 유도를 위한 Simvastatin 처리 수준 검증
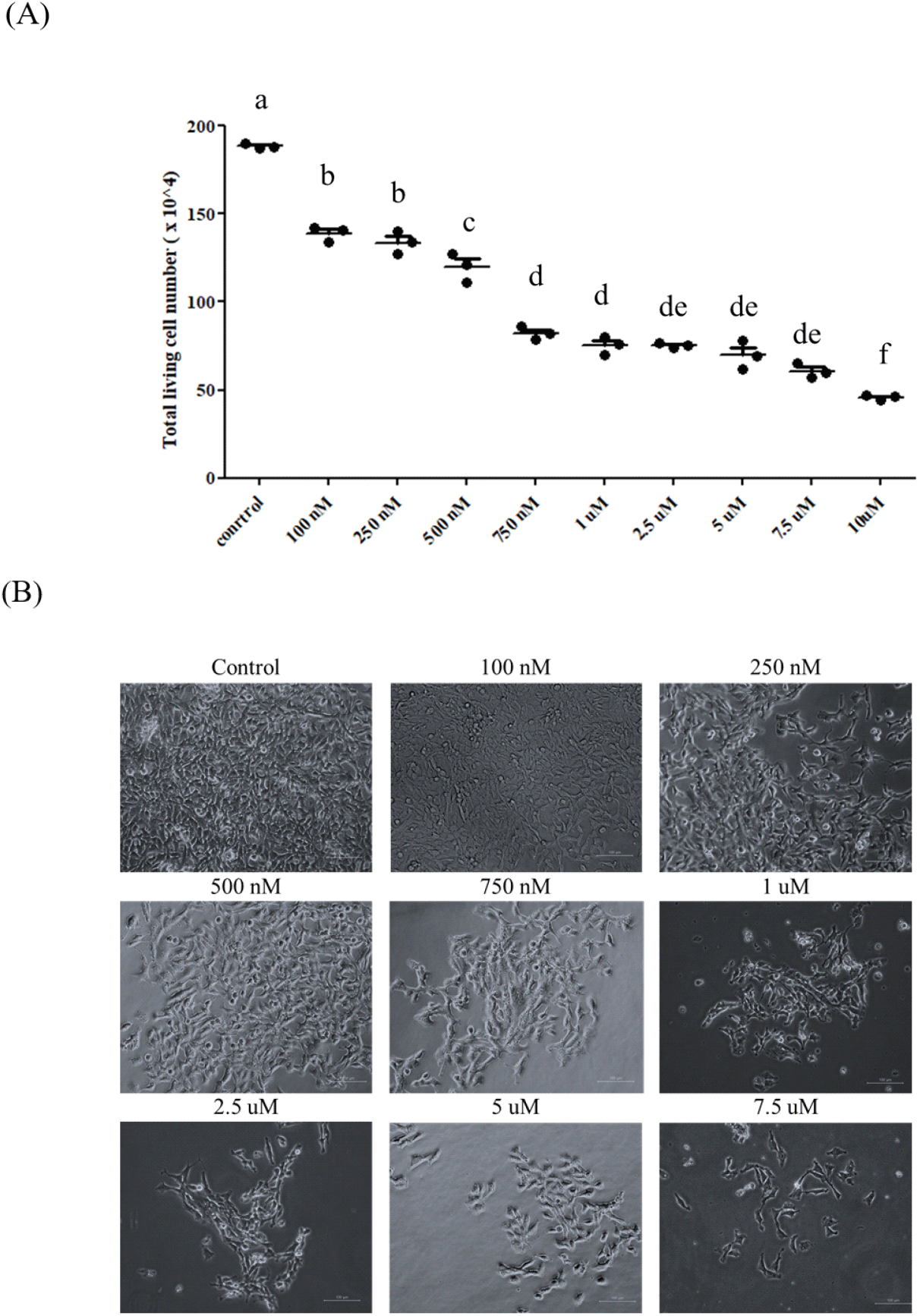
근육 세포의 손상 조건을 확립하기 위하여 QM7(Quail Muscle Cell)에 Simvastatin을 처리하였다. 처리의 수준은 기존에 수행되었던 다른 축종의 선행 연구를 참고로 하되(Ogura et al., 2007; Baba et al., 2008; Essid et al., 2019), QM7 세포에서 손상을 줄 수 있는 적정 농도를 측정하기 위하여 다양한 농도(100 nM, 250 nM, 500 nM, 750 nM, 1 uM, 2.5 uM, 5 uM, 7.5 uM, 10 uM)로 Simvastatin을 처리하였다(Fig. 1). 그 결과, Simvastatin의 처리 농도가 증가함에 따라 생존한 전체 QM7 세포의 수는 감소하는 경향을 보였다(Fig. 1A). 그러나 750 nM의 Simvastatin을 기준으로 처리 농도가 증가하였음에도 불구하고 세포의 사멸이 유의적으로 증가하지 않는 것을 확인하였다. 또한 세포의 형태학적인 변화를 살펴보았을 때도, 250 nM의 Simvastatin에서부터 세포의 손상이 일어나는 것을 확인하였으며, 750 nM의 Simvastatin을 처리하였을 때 세포의 손상이 급격히 일어나는 것을 확인할 수 있었다(Fig. 1B). 이를 통하여 750 mM의 Simvastatin이 QM7 세포의 손상을 유도하는데 적합하다고 판단하여, 이후의 실험을 진행하였다. 앞서 소개한 선행 연구들은 용량 의존적 분석은 수행되지 않았으나, 마우스(C2C12) 와 랫(L6) 근육 세포에서 1uM의 Simvastatin의 처리에 따라서 근육의 손상이 일어나는 것을 확인하였다(Ogura et al., 2007; Essid et al., 2019).
Fig. 1.
Myotoxicity test in QM7 cells by Simvastatin stimulation. (A) Proliferation analysis of Simvastatin-treated QM7 myoblast cells depending on various dose. (B) Morphology of QM7 cells treated with various concentration of Simvastatin. Scale bar: 100 μm. Data are expressed as mean±SD (n=3). Statistical significance was measured using one-way ANOVA. a, b, c, d, de, f -the result of statistical analysis (one-way ANOVA Duncan test), values followed by the same letter in a Duncan grouping are not significantly different, the subscript number and letter color are corresponding to the chart legend.
Download Original Figure
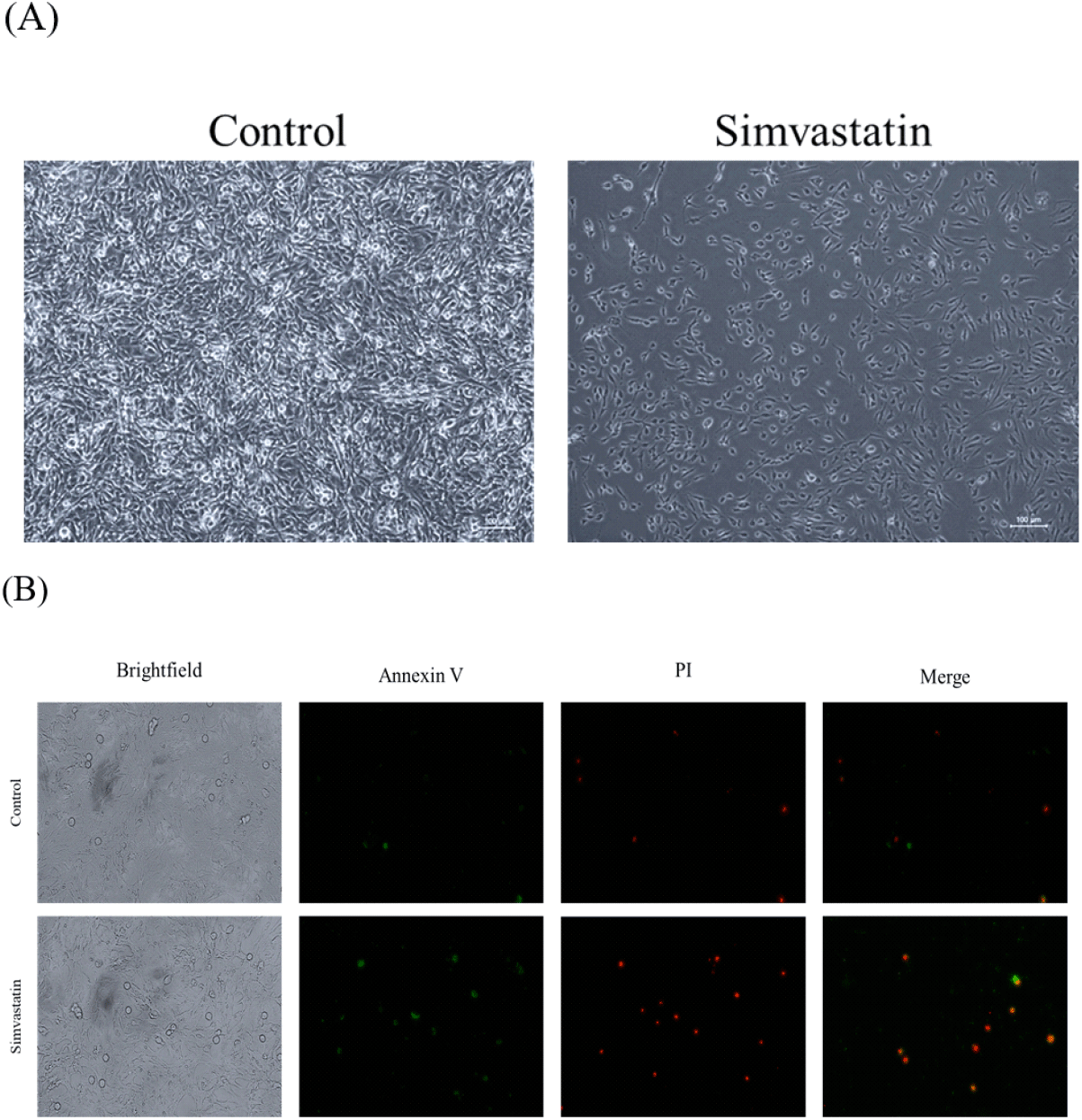
2. Simvastatin 처리를 통한 세포 사멸(Apoptosis) 및 괴사(Necrosis) 검증
앞선 실험을 통하여 근육 손상의 조건을 확립하기 위하여 다양한 농도의 Simvastatin을 처리하였다(Fig. 1). 그리고 이를 통하여 최종적으로는 750 nM의 Simvastatin이 적절한 농도임을 확인하였다(Fig. 2A). 이 후 실질적으로 Simvastatin의 처리가 세포 사멸과 괴사를 일으키는지 확인하기 위하여 Annexin V와 PI staining을 수행하였다(Fig. 2B). 그 결과, 대조군에 비해서 Simvastatin을 처리한 그룹에서 Annexin V와 PI 모두 2–fold change 이상 발현이 증가한 것을 확인할 수 있었다. 이러한 결과는 Simvastatin 처리가 실질적으로 세포의 사멸과 괴사를 유도하는 것임을 나타낸다. Statin 계열의 약물이 근육의 괴사와 사멸을 유도한다는 것은 이미 많은 다른 연구를 통하여 잘 알려져 있다(Westwood et al., 2005). Simvastatin의 경우에는 대부분 종양세포의 괴사에 대한 연구들이 진행되어 왔으나(Cho et al., 2008; Oliveira et al., 2008), 일부의 연구들은 Simvastatin의 부작용으로 인한 근육의 손상 및 괴사에 대한 연구들도 수행되어 왔다(Levy et al., 1992; PIerno et al., 1995; Evans and Rees, 2002).
Fig. 2.
Simvastatin provoked myotoxicity on QM7 myoblast cells. (A) Morphology of QM7 cells after Simvastatin treatment. Scale bar: 100 μm. (B) QM7 cells stained with Annexin V-FITC and PI after Simvastatin treatment.
Download Original Figure
3. Simvastatin 처리를 통한 근위축증(Muscle Atrophy) 신호 전달 체계 검증
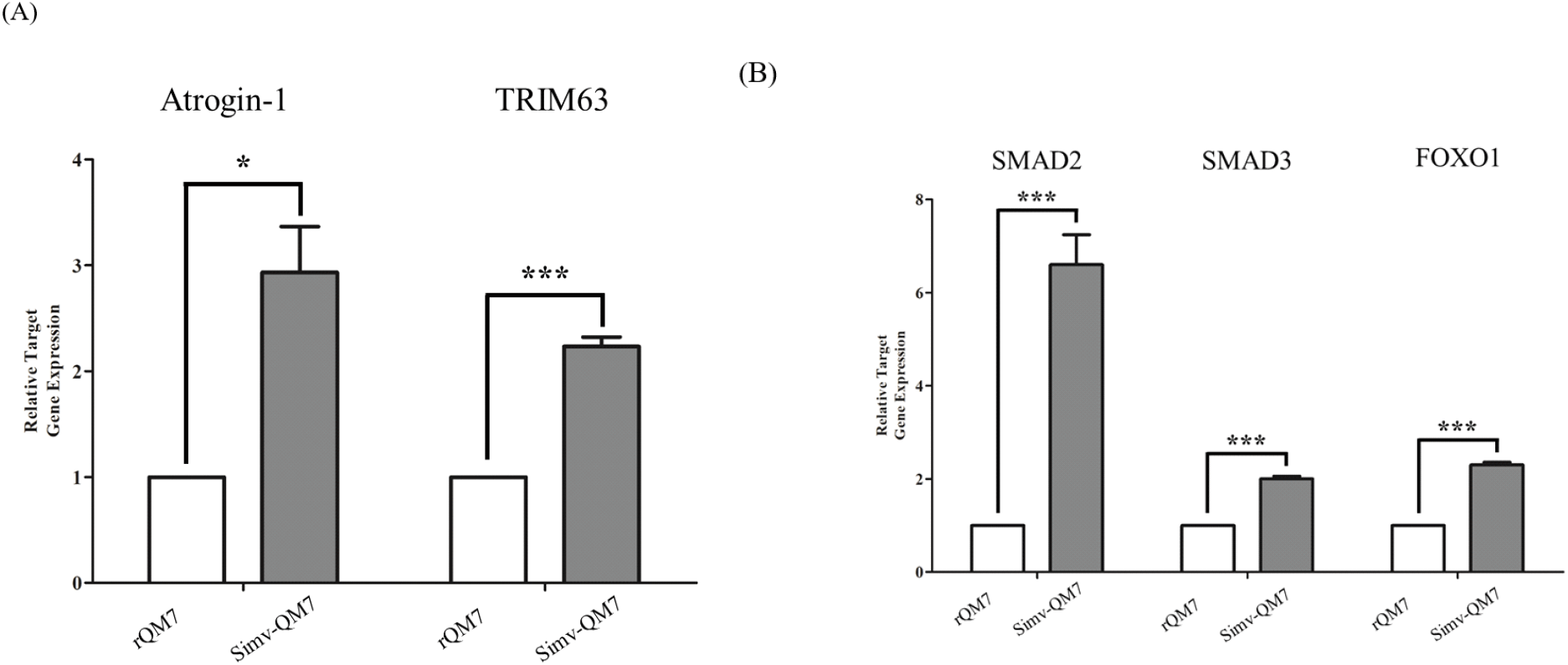
Simvastatin 처리를 통한 근육의 손상이 근위축증이라고 하는 근육 내 단백질의 붕괴에 의해서 일어나는지를 확인하기 위하여, Simvastatin을 처리한 QM7 세포를 활용하여 qRT-PCR을 수행하였다(Fig. 3). qRT-PCR은 근위축증 마커 유전자인 Atrogin-1(FBXO32, F-Box Protein 32)과 TRIM63 (MURF1, Tripartite Motif Containing 63)에 대하여 양적 분석을 수행하였다(Fig. 3A). 그 결과, Simvastatin 처리에 따라서 Atrogin-1 유전자의 경우에는 약 3.5배 정도 증가하는 것을 확인하였으며, TRIM63의 경우에는 약 2배의 증가량을 보이며 근위축증 현상이 일어나는 것을 확인하였다. 근육은 인체에 있어 가장 큰 단백질의 저장소이며, 근육 단백질의 손실은 질병이나 노화 등 다양한 원인에 의해 일어나는데, 그 중에서도 근위축증은 근육 단백질의 손상을 일으키는 주요 원인 중 하나이다(Kandarian and Jackman, 2006). 근위축증은 다양한 경로를 통하여 일어나게 되는데, 일반적으로는 Glucocorticoid, Myostatin, Free fatty acids(FFAs), 그리고 Inflammation cytokines를 통하여 근위축증이 유도된다. 일단 Glucocorticoid, Myostatin, Free fatty acids(FFAs), 그리고 Inflammation cytokines를 통하여 근위축증 신호전달 경로가 유도되면 각각 Glucocorticoid 수용체, SMAD2/3, NF-kB를 조절하게 되고 이를 통하여 Atrogin-1, MURF1가 유도되어 근원섬유가 분해되어 근위축증이 일어나게 된다(Wang et al., 2001). 본 연구팀은 QM7 세포에 Simvastatin을 처리하여 Simvastatin이 근육 내 단백질의 붕괴를 일으켜 근육의 손상을 유도한다는 것을 알 수 있었다. 추가적으로 이러한 근위축증이 어떠한 신호전달 경로를 통하여 일어나는 가를 확인하기 위하여 근위축증 신호전달 경로의 상위에 있는 유전자인 SMAD2/3, FOXO1 유전자에 대하여 양적 발현분석을 수행하였다(Fig 3B). 그 결과, Simvastatin 처리에 따라 SMAD2가 7배 이상의 발현량 증가를 보이는 것을 확인하였으며, SMAD3과 FOXO1의 경우에는 약 2배의 발현량 증가를 보이는 것을 확인하였다. SMAD2와 SMAD3의 경우에는 SMAD4와 결합하여 SMAD 복합체를 구성하여 단백질의 합성을 저하시키는 한편, Atrogin-1과 MURF1의 전사를 촉진시켜 단백질의 붕괴를 일으킨다고 알려져 있다(Goodman and Hornberger, 2014). 또한 SMAD는 그 자체로 위성 세포의 분화를 억제시켜 근육의 재생을 억제하는 것으로 알려져 있다(Aloysius et al., 2018; Farhang-Sardroodi and Wilkie, 2020). 이를 통하여 Simvastatin의 처리가 FOXO1의 발현 조절을 통한 근육 세포 내 단백질의 붕괴를 초래하기도 하지만, SMAD 신호절달 경로를 통한 위성 세포의 정지(satellite cell quiescence) 및 근위축증 연관 유전자의 발현을 촉진시켜 근육의 재생을 억제하여 근육의 손상을 초래할 것이라는 잠정적 결론을 얻을 수 있었다. 본 연구는 Simvastatin의 처리를 통한 근육 손상의 메커니즘을 구명하기 위한 연구이며, 차후 각 신호전달체계의 조절에 대한 연구가 더 필요할 것으로 보인다. 이는 향후 근육의 손상 메커니즘을 이해하고, 이들을 유도하는 신호전달 체계를 이해하는데 기초적인 정보를 제공할 수 있을 것으로 사료된다.
Fig. 3.
Transcriptional analysis of Atrogin-1, TRIM63 and their upstream signaling genes in QM7 cells after Simvastatin stimulation. (A) The mRNA expression pattern of muscle atrophy marker genes (Atrogin-1, TRIM63), and (B) upstream genes of atrophy signaling cascade (SMAD2, SMAD3, FOXO1). The mRNA expression levels were measured by real-time PCR. mRNA fold-change was normalized to GAPDH mRNA. *P<0.05, **P<0.01, ***P<0.001, ****P<0.0001. by unpaired two-tailed student’s t-test.
Download Original Figure
사사
이 논문은 2022년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No. 2022R1I1A1A01066235).
REFERENCES
Aloysius A, DasGupta R, Dhawan J 2018 The transcription factor Lef1 switches partners from β-catenin to Smad3 during muscle stem cell quiescence. Sci Signal 11(540):eaan3000.

,


Antin PB, Ordahl CP 1991 Isolation and characterization of an avian myogenic cell line. Dev Biol 143(1):111-121.

,


Antonopoulos AS, Margaritis M, Shirodaria C, Antoniades C 2012 Translating the effects of statins: from redox regulation to suppression of vascular wall inflammation. Thromb Haemostasis 108(11):840-848.

,


Baba TT, Nemoto TK, Miyazaki T, Oida S 2008 Simvastatin suppresses the differentiation of C2C12 myoblast cells via a Rac pathway. J Muscle Res Cell M 29(2):127-134.

,


Baziz HA, Geraert P, Padilha J, Guillaumin S 1996 Chronic heat exposure enhances fat deposition and modifies muscle and fat partition in broiler carcasses. Poultry Sci 75(4):505-513.

,


Beard EL Jr 2001 The American society of health system pharmacists. Jonas Healthc Law Ethics Regul 3(3):78-79.

,


Behboodi HR, Sedaghat A, Baradaran A, Nazarpak HH 2021 The effects of the mixture of betaine, vitamin C, St John’s wort (
Hypericum perforatum L.), lavender, and Melissa officinalis on performance and some physiological parameters in broiler chickens exposed to heat stress. Poultry Sci 100(9):101344.

,

,


Buckingham M, Rigby PW 2014 Gene regulatory networks and transcriptional mechanisms that control myogenesis. Dev Cell 28(3):225-238.

,


Chen S, Yong Y, Ju X 2021 Effect of heat stress on growth and production performance of livestock and poultry: mechanism to prevention. J Therm Biol 99:103019.

,


Cho SJ, Kim JS, Kim JM, Lee JY, Jung HC, Song IS 2008 Simvastatin induces apoptosis in human colon cancer cells and in tumor xenografts, and attenuates colitis associated colon cancer in mice. Int J Cancer 123(4):951-957.

,


Essid SM, Bevington A, Brunskill NJ 2019 Proinsulin C-peptide enhances cell survival and protects against Simvastatin-induced myotoxicity in L6 rat myoblasts. Int J Mol Sci 20(7):1654.

,

,


Evans M, Rees A 2002 Effects of HMG-CoA reductase inhibitors on skeletal muscle. Drug Safety 25(9):649-663.

,


Farhang-Sardroodi S, Wilkie KP 2020 Mathematical model of muscle wasting in cancer cachexia. J Clin Med 9(7):2029.

,

,


Goodman CA, Hornberger TA 2014 New Roles for Smad Signaling and Phosphatidic Acid in the Regulation of Skeletal Muscle Mass. F1000 Med Rep 6.

,

,


Hernández-Hernández JM, García-González EG, Brun CE, Rudnicki MA 2017 The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration. Pages 10-18. In: Semin Cell Dev Biol.

,

,


Kandarian SC, Jackman RW 2006 Intracellular signaling during skeletal muscle atrophy. Muscle Nerve 33(2):155-165.

,


Kim SW, Lee JH, Park BC, Park TS 2017 Myotube differentiation in clustered regularly interspaced short palindromic repeat/Cas9-mediated MyoD knockout quail myoblast cells. Asian Austral J Anim 30(7):1029.

,

,


Kim SW, Lee JH, Park TS 2016 Functional analysis of SH3 domain containing ring finger 2 during the myogenic differentiation of quail myoblast cells. Asian Austral J Anim 30(8):1183-1189.

,

,


Kirmizis D, Papagianni A, Dogrammatzi F, Skoura L, Belechri A-M, Alexopoulos E, Efstratiadis G, Memmos D 2010 Effects of Simvastatin on markers of inflammation, oxidative stress and endothelial cell apoptosis in patients on chronic hemodialysis. J Atheroscler Thromb 100924 0286-1009240286.

,


La Mura V, Pasarín M, Meireles CZ, Miquel R, Rodríguez Vilarrupla A, Hide D, Gracia Sancho J, García Pagán JC, Bosch J, Abraldes JG 2013 Effects of Simvastatin administration on rodents with lipopolysaccharide induced liver microvascular dysfunction. Hepatology 57(3):1172-1181.

,


Lansberg P, Mitchel Y, ShaPIro D, Kastelein J, Altman R, Jerums G, Bolzano K, Giannini S, Davignon J, Dewailly P 1995 Long-term efficacy and tolerability of Simvastatin in a large cohort of elderly hypercholesterolemic patients. Atherosclerosis 116(2):153-162.

,


Levy Y, Leibowitz R, Aviram M, Brook J, Cogan U 1992 Reduction of plasma cholesterol by lovastatin normalizes erythrocyte membrane fluidity in patients with severe hypercholesterolaemia. Brit J Clin Pharmaco 34(5):427.

Livak KJ, Schmittgen TD 2001 Analysis of relative gene expression data using real-time quantitative PCR and the 2
−ΔΔCT method. Methods 25(4):402-408.

,


Mehaisen GM, Desoky AA, Sakr OG, Sallam W, Abass AO 2019 Propolis alleviates the negative effects of heat stress on egg production, egg quality, physiological and immunological aspects of laying Japanese quail. PLOS ONE 14(4):e0214839.

,

,


Miller M, DiNicolantonio JJ, Can M, Grice R, Damoulakis A, Serebruany VL 2013 The effects of ezetimibe/Simvastatin versus Simvastatin monotherapy on platelet and inflammatory biomarkers in patients with metabolic syndrome. Cardiology 125(2):74-77.

,


Miner JH, Wold B 1990 Herculin, a fourth member of the MyoD family of myogenic regulatory genes. P Natl Acad Sci USA 87(3):1089-1093.

,

,


Ogura T, Tanaka Y, Nakata T, Namikawa T, Kataoka H, Ohtsubo Y 2007 Simvastatin reduces insulin-like growth factor-1 signaling in differentiating C2C12 mouse myoblast cells in an HMG-CoA reductase inhibition-independent manner. Toxicol Sci 32(1):57-67.

,


Oliveira KA, Zecchin KG, Alberici LC, Castilho RF, Vercesi AE 2008 Simvastatin inducing PC3 prostate cancer cell necrosis mediated by calcineurin and mitochondrial dysfunction. J Bioenerg Biomembr 40(4):307-314.

,


Otrocka-Domagała I, Paździor-Czapula K, Maślanka T 2018 Simvastatin impairs the inflammatory and repair phases of the postinjury skeletal muscle regeneration. Biomed Res Int 2018.

,

,


Pan L, Ma X, Zhao P, PIao X 2019 WeePIng forsythia extract alleviates dexamethasone-induced oxidative injury of breast muscles in broilers. Animal 13(11):2660-2668.

,


PIerno S, De Luca A, Tricarico D, Roselli A, Natuzzi F, Ferrannini E, Laico M, Camerino DC 1995 Potential risk of myopathy by HMG-CoA reductase inhibitors: a comparison of pravastatin and Simvastatin effects on membrane electrical properties of rat skeletal muscle fibers. J Pharmacol Exp Ther 275(3):1490-1496.

Sanvee GM, Panajatovic MV, Bouitbir J, Krähenbühl S 2019 Mechanisms of insulin resistance by Simvastatin in C2C12 myotubes and in mouse skeletal muscle. Biochem Pharmacol 164:23-33.

,


Sejian V, Bhatta R, Gaughan J, Dunshea F, Lacetera N 2018 Adaptation of animals to heat stress. Animal 12(s2): s431-s444.

,


Silveira AAA, Dominical VM, Lazarini M, Costa FF, Conran N 2013 Simvastatin abrogates inflamed neutrophil adhesive properties, in association with the inhibition of Mac-1 integrin expression and modulation of Rho kinase activity. Inflamm Res 62(2):127-132.

,


Tanaka S-i, Fukumoto Y, Nochioka K, Minami T, Kudo S, Shiba N, Takai Y, Williams CL, Liao JK, Shimokawa H 2013 Statins exert the pleiotroPIc effects through small GTP-binding protein dissociation stimulator upregulation with a resultant Rac1 degradation. Arterioscle. Thromb Vasc Biol 33(7):1591-1600.

,

,


Van Kaam J, Groenen M, Bovenhuis H, Veenendaal A, Vereijken A, Van Arendonk J 1999 Whole genome scan in chickens for quantitative trait loci affecting growth and feed efficiency. Poultry Sci 78(1):15-23.

,


Wang Y, Liu Q, Quan H, Kang SG, Huang K, Tong T 2021 Nutraceuticals in the prevention and treatment of the muscle atrophy. Nutrients 13(6):1914.

,

,


Westwood FR, Bigley A, Randall K, Marsden AM, Scott RC 2005 Statin-induced muscle necrosis in the rat: distribution, development, and fibre selectivity. Toxicol Pathol 33(2): 246-257.

,


Xu L, Dong XW, Shen LL, LI FF, Jiang JX, Cao R, Yao HY, Shen HJ, Sun Y, Xie QM 2012 Simvastatin delivery via inhalation attenuates airway inflammation in a murine model of asthma. Int Immunopharmacol 12(4):556-564.

,


Yaffe D, Saxel O 1977 Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature 270(5639):725-727.

,


Zhang S, Rahman M, Zhang S, Qi Z, Herwald H, Thorlacius H 2011b Simvastatin regulates CXC chemokine formation in streptococcal M1 protein-induced neutrophil infiltration in the lung. Am J Physiol Lung Cell Mol Physiol 300(6):L930-L939.

,


Zhang W, Gao F, Zhu Q, Li C, Jiang Y, Dai S, Zhou G 2011a Dietary sodium butyrate alleviates the oxidative stress induced by corticosterone exposure and improves meat quality in broiler chickens. Poultry Sci 90(11):2592-2599.

,