서 론
동물과 사람 간에 전파되는 병원체에 의하여 발생하는 감염병을 인수공통감염병이라고 하며, 현재까지 알려진 감염병의 약 60%가 동물 유래이다(Taylor et al., 2001). 세계보건기구(World Health Organization, WHO)에서는 인수공통감염병 중에서 사람에게 가장 위협이 되는 병원체 중 하나로 동물인플루엔자(Animal Influenza) 바이러스를 지목하고 있으며(Widdowson et al., 2017), 조류인플루엔자(Avian Influenza, AI) 바이러스는 그 중 가장 대표적 병원체로 알려져 있다. 질병관리청의 정의에 따르면, AI 인체감염증이란 고병원성AI 및 이에 준하여 조치되는 AI로 주로 H5형 및 H7형 AI바이러스의 인체감염에 의한 급성 호흡기 감염병이다. 질병관리청의 통계에 따르면 현재까지 우리나라는 AI 인체감염증의 발생사례가 없지만, 전세계적으로 H5N1형의 경우‘03년부터 ‘20년까지 동남아 중동 등 17개국에서 환자 862명(사망 455명, 치명률 52.8%), H7N9형은 ’13년부터 ’19년까지 중국 등에서 환자 1,568명(사망 616명, 치명률 39.3%)이 발생, H9N2형은 ’98년부터 ’20년까지 중국 등에서 환자 총 68명(사망 1명)이 발생하였다.
해외 AI인체감염증의 주요 감염사례는, 병들거나 폐사한 가금을 섭취한 후 7일 이내 AI 인체감염증 임상증상이 나타났거나(Pham et al., 2006), 살아있는 가금류를 판매하는 시장을 방문하였거나 방역이 취약한 가정 뒷마당에서 키우는 가금 또는 가금의 사체와 접촉한 이후 AI인체감염증이 발생하였다(Zhou et al., 2009). 이러한 인체 감염 주요 감염 경로에 따라 중국과 인도네시아에서 가금농장의 고병원성AI 발생이 AI인체감염증의 위험요인이라고 제시된 바 있다(Yupiana et al., 2010; Wu et al., 2015). 살아있는 가금류를 직접 도축·판매하는 시장이 거의 없고 도계장이나 도압장에서 도축된 가금육이 주로 유통되는 국내 유통 구조를 고려할 때, 중국이나 동남아시아와 같이 살아있는 가금류를 판매하는 시장에서 AI에 감염된 가금과 접촉하거나 AI에 감염된 가금육 섭취를 통한 인체감염증 발생 가능성은 낮을 것으로 판단된다. 다만, 2003년 이후 지속적으로 발생하는 국내 가금농장의 고병원성AI 상황을 볼 때 AI인체감염증의 발생 위험은 상존하기 때문에(Ryu et al., 2018), 국내에서 AI 인체감염증이 발생한다면 가금농장의 고병원성AI 발생과 연관성이 높을 것으로 예측된다(Koopmans et al., 2004).
농림축산검역본부의 고병원성 조류인플루엔자(Highly Pathogenic Avian Influenza, HPAI) 역학조사분석보고서에 따르면, 국내 가금농장의 HPAI는 2003년 이후 2018년까지 17개 시·도 93개 시·군·구에서 총 7차례 1,055건이 발생하였다. 2014년 이후 국내에서 유행하고 있는 H5Nx 바이러스는 인체감염 위험성 증가와 관련된 주요 변이가 없으며 동물실험을 통해 병원성 및 전파력이 낮은 것으로 분석되었으나(Kim, 2018), 국내에서 HPAI가 근절되지 않고 야생조류와 가금류 간에 순환감염이 지속적으로 일어난다면 새로운 변이형이 출현할 가능성이 있다고 보고 있다(Beerens et al., 2019). AI인체감염증의 사전 예방을 위해서는 가금농장의 HPAI와 연계한 AI 인체감염증 발생 위험에 대한 다양한 평가가 시급하지만, 아직까지 국내에서 이와 관련된 연구 사례가 없다. AI 인체감염에 영향을 줄 수 있는 위험요인을 파악하고 발생 위험지역을 평가할 수 있다면 정부의 방역정책 수립 및 관리에 큰 도움이 될 수 있을 것이다. WHO에 따르면, 위험 평가는 위험의 정도를 측정하기 위하여 정보를 수집 및 평가하는 일련의 과정으로, 공중보건 위기상황에 대하여 관리하고 부정적 결과를 줄이는데 필요한 기초적인 정보를 제공한다. 이번 연구에서는 위험 평가(risk assessment) 방법 중 널리 활용되는 위험 매트릭스(risk matrix) 분석방법을 이용하여 시·군·구 단위로 AI인체감염증의 발생 위험도를 평가해 보고자 한다. 공중보건 분야에서 위험 매트릭스 분석은 전자담배에 대한 위험 평가(Saitta et al., 2017), 벡터 매개체 전염병(Vector-Borne Diseases)의 위험 평가(Yang et al., 2017) 등에서 활용된 바 있다. 위험매트릭스는 ISO/DIS 2009에서 위험을 정량적으로 평가하여 위험관리의 측면에서 위험을 예상하고 분석하여 위험을 줄이는 방법을 제공할 수 있다고 말하며, 세계보건기구(WHO)에서도 긴급한 공중보건 사건이 발생할 경우 위험 매트릭스를 위험 평가에 활용하도록 제안하고 있다. AI인체감염증은 인수공통감염병으로 사람과 동물 모두에게 감염되어 사회·경제적 피해를 입힐 수 있기 때문에 사람, 동물, 환경 간 연계를 통한 다학제적 접근이 필요하다(Anderson et al., 2010). 위험 매트릭스를 활용하여 시·군·구별 가금농장의 HPAI와 연관된 AI인체감염증 발생 위험도를 평가한다면 선제적 방역으로 사회·경제적 비용을 감소시킬 수 있을 뿐만 아니라, 원헬스(One Health)적 관점에서 공중보건의 향상을 위해 보건복지부, 농림축산식품부, 환경부 등 관련 부처 간 상호 소통·협력하는 프로그램, 정책, 법률, 연구 등을 설계하고 구현할 수 있는 과학적 토대 제공이 가능할 것으로 판단된다.
재료 및 방법
본 연구에서 지역별 HPAI 발생 위험도 분석 및 예측을 위하여 사용된 데이터는 Table 1 및 Table 2와 같다. 가금류 및 야생조류의 연도별 HPAI 발생 건수는 농림축산검역본부에서 발간한 역학조사보고서를 참고하였다. 또한 가금류의 저병원성 AI 발생건수와 축산차량 등록건수는 농림축산검역본부의 동물질병통합시스템(Korea Animal Health Integrated System, KAHIS)을 통해 확인하였다. 강과 농경지 밀도는 통계청의 국가통계정보서비스(Korean Statistical Information Service, KOSIS)에서 추출하였고, 가금류(오리, 닭)의 밀도는 KAHIS의 가금수와 KOSIS의 면적데이터를 활용하였다. 위험 매트릭스에 활용된 축산관계 시설의 수는 KAHIS에 등록된 현황을 참고하였다(Table 3).
APQA, Animal and Plant Quarantine Agency; HPAI, Highly Pathogenic Avian Influenza; KAHIS, Korea Animal Health Integrated System; KOSIS, Korean Statistics Information Service; LPAI, Low Pathogenic Avian Influenza.
HPAI, Highly Pathogenic Avian Influenza; LPAI, Low Pathogenic Avian Influenza; Std.Dev, Standard Deviation.
The explanatory variables were collected in 229 municipalities, South Korea.
The number of poultry production related facilities were investigated in 229 municipalities, South Korea.
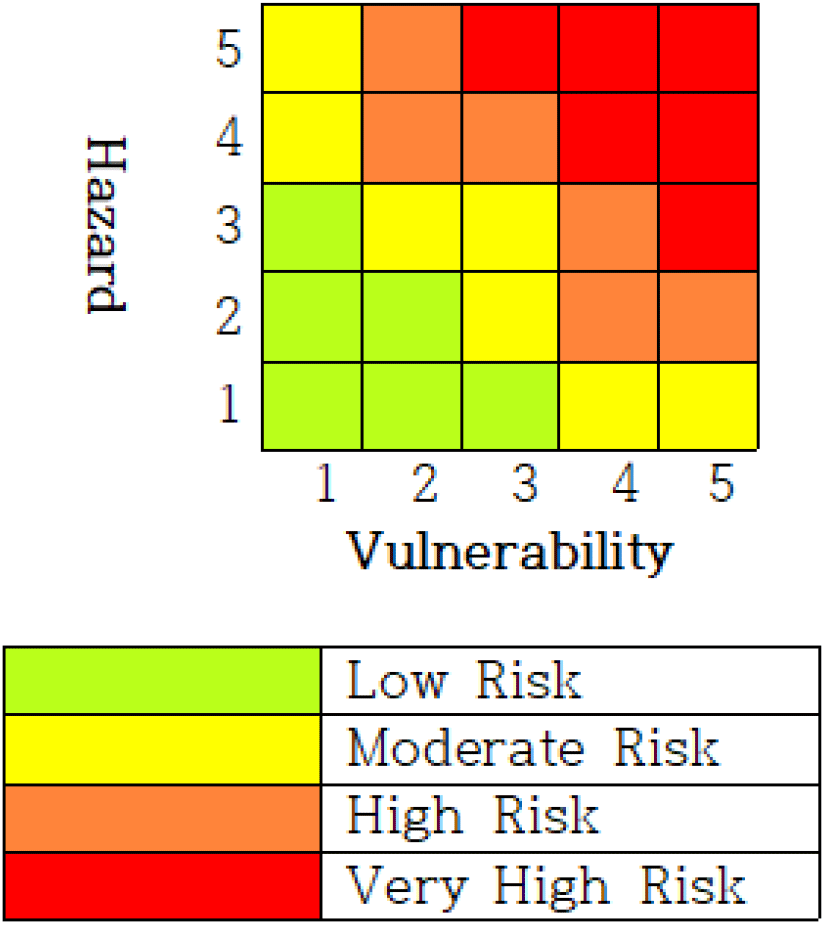
유엔 재해위험 감소 사무국(United Nations Office for Disaster Risk Reduction, UNISDR)에 따르면, 위험이란 자연적 또는 인위적인 위해(hazard)와 취약성(vulnerability)의 작용에 따른 결과(Risk=Hazard × Vulnerability)로 정의한다(Appiotti et al., 2020). 위험 매트릭스(Risk Matrix)는 위험평가방법 중 하나로 위해와 취약성을 매우 위험(red), 고위험(orange), 중위험(yellow), 저위험(green) 등 몇 가지 단계로 나누어서 Fig. 1의 형태로 표현한 후 평가 대상의 위험도를 최종 구분한다(Pascarella et al., 2021). 이번 연구는 전국 229개 시·군·구 관내 가금농장의 HPAI 발생과 연관된 AI인체감염증의 위험도를 평가는 AI인체감염 가능성이 높은 가금관련 종사자가 근무하는 축산시설의 수를 위험 매트릭스의 취약성(vulnerability) 축으로 지정하고, 가금농장의 HPAI 유행 시 시·군·구별 평균 발생 건수를 위해(hazard) 축으로지정하여 실시하였다. 취약성 축의 시·군·구별 가금농장 HPAI 유행당 평균 발생 건수는 0 이상인 비음정수이고 이산적이며 과대산포형(overdispersion)의 가산자료(count data)이기에 일반화 선형 모형(GLM, generalized linear model) 중 음이항 회귀모형을 이용하여 분석하였다. 5×5 위험 매트릭스 분석을 위하여 k-평균 군집화(K-means Clustering)를 이용하여 취약성 축과 위해 축 각각을 5개의 구간으로 범주화하였다.
위험 매트릭스의 위해 축에 적용할 가금농장의 HPAI 유행당 예상 평균 발생건수를 일반화 선형모형으로 추정하기하기 위해, 229개 시·군·구단위로 2003년부터 2018년까지 총 7차례(’03~’04, ’06~’07, ’08, ’10~’11, ’14~’16, ’16~’17, ’17~’18) 발생했던 가금농장 HPAI의 유행당 평균 발생 건수를 종속변수로 설정하였다. 가금농장의 HPAI 발생과 관련된 독립변수은 기존 연구에서 다룬 위험요인과 농림축산검역본부의 역학조사 보고서를 검토하여 ① 가금농장의 저병원성 조류인플루엔자(low pathogenic avian influenza, LPAI) 발생 평균 건수, ② 야생조류의 HPAI 발생 평균 건수, ③ 하천밀도, ④ 경지밀도, ⑤ 가금 사육밀도, ⑥ 닭 사육밀도, ⑦ 오리 사육밀도, ⑧ 축산차량 등록 현황의 8가지 위험요인을 변수로 선정하였다. 모든 독립변수 값은 연속형으로 측정하였다. 다변량 회귀분석에 앞서 독립변수 간 Spearman 상관분석을 실시하고, 추가적으로 독립변수 전체의 다중공선성을 분산팽창계수(variance inflation factor, VIF)을 이용하여 파악하였다. 다중공선성은 VIF 값이 10 이상인 경우로 간주하였다. 상관분석 결과 가금류 전체 사육밀도와 닭 사육밀도 사이에 0.997**의 높은 상관관계가 확인되었고, 추가적으로 확인해 본 결과 가금류 전체 사육밀도와 닭 사육밀도의 VIF 값이 30을 초과하였음을 확인했다. 따라서, 가금류 전체 사육 밀도 변수를 제외한 나머지 변수를 독립변수로 최종 선택한 후 음이항 회귀모형을 이용하여 시군구별 가금농장의 HPAI 발생 건수를 추정하는 모델을 구축하였다. 모든 통계량의 유의수준은 P<0.05, 자료분석은 IBM SPSS Statistics 26 통계프로그램을 이용하였다.
결 과
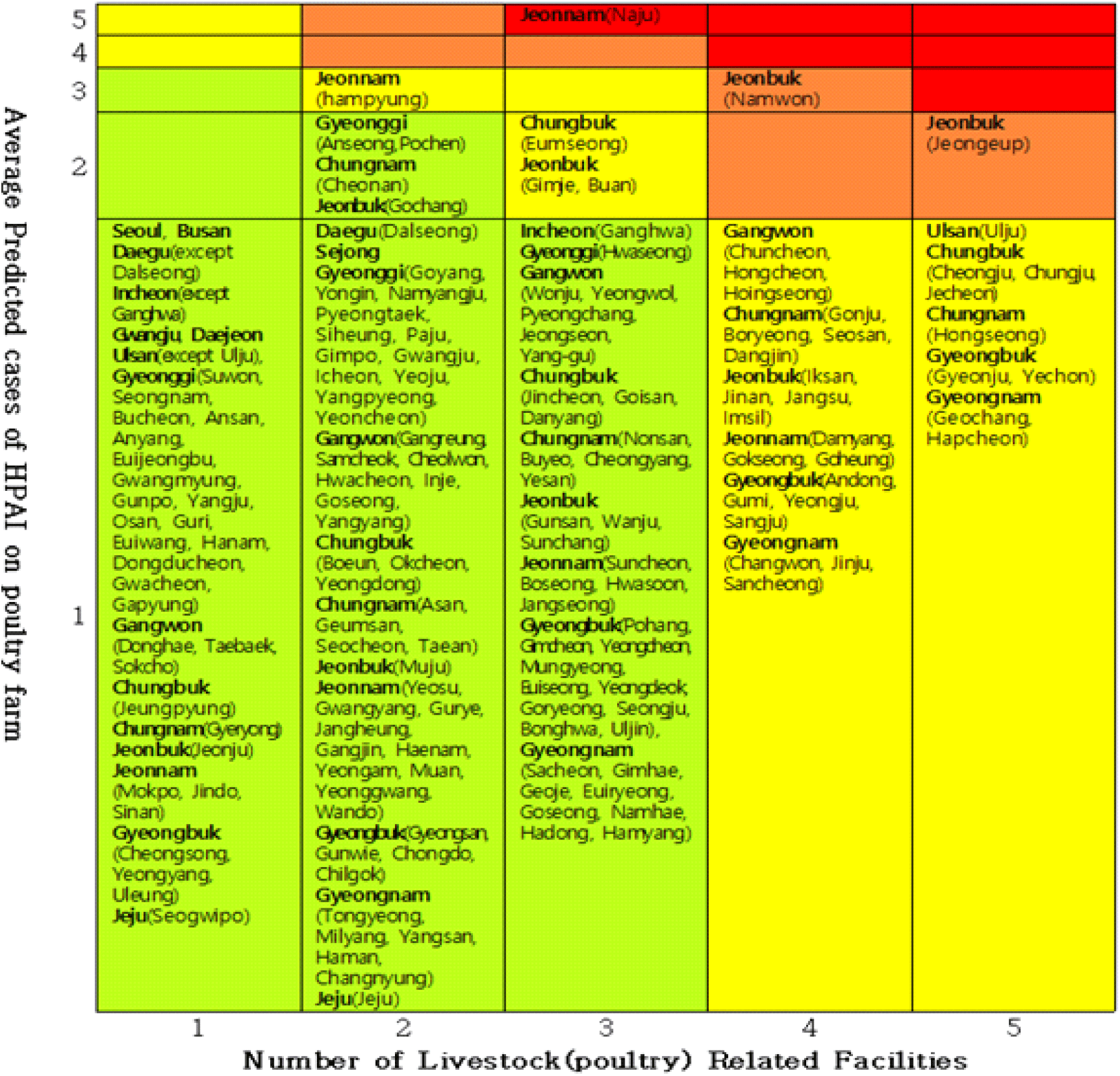
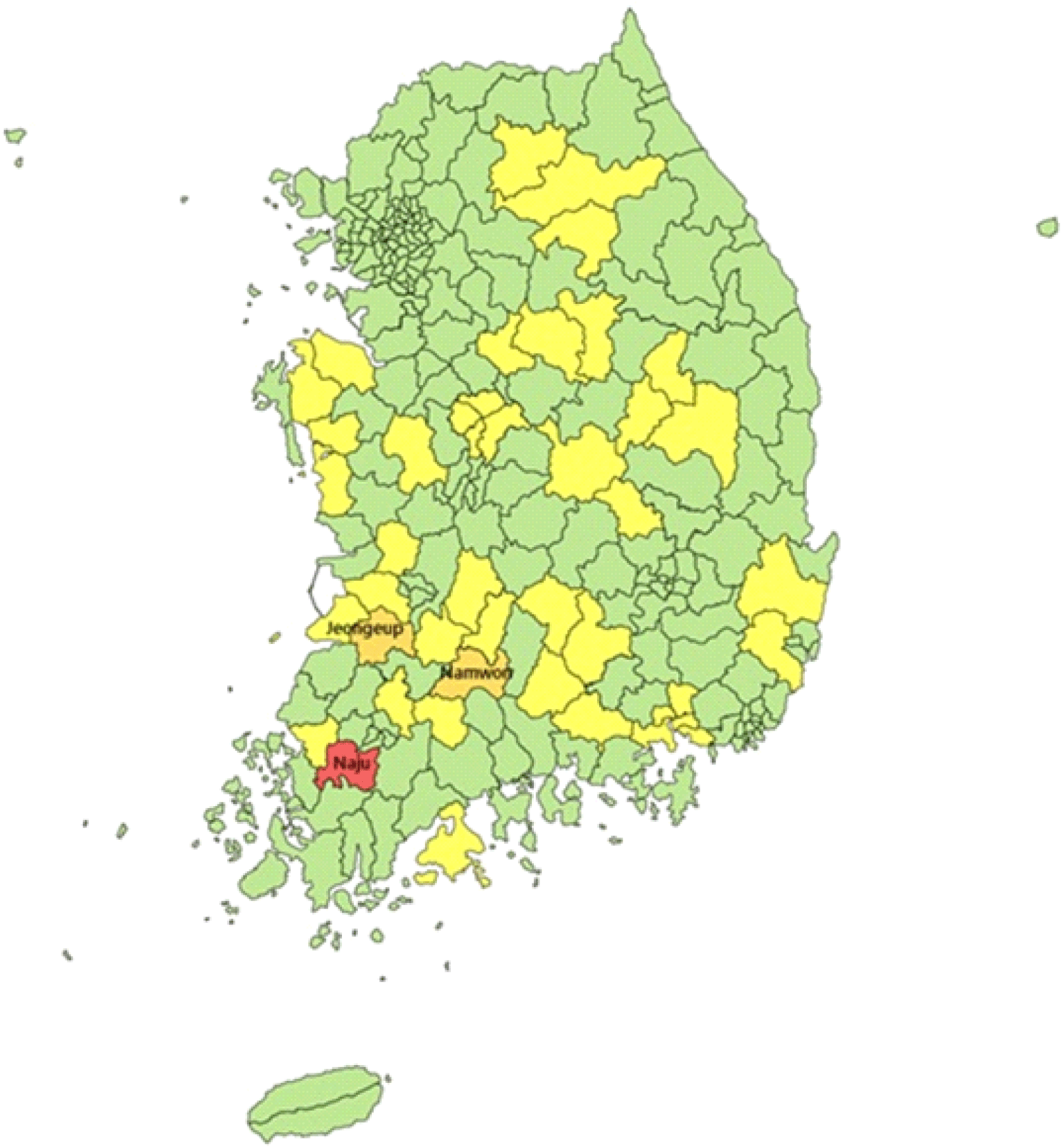
시군구별 가금농장 HPAI 발생과 독립변수간의 상관성에 대하여 분석한 결과 Table 4와 같이 LPAI 평균, 닭 밀도, 오리밀도, 축산차량 등록 수가 통계적으로 유의한 상관성을 보이는 것으로 확인되었다(P-value<0.05). 가금농장에서 LPAI가 1건 발생 시 가금농장의 고병원성AI 발생이 6.87배 증가하는 것으로 나타났고, 닭과 오리의 밀도가 1,000 두/km2 증가할 경우 가금농장의 고병원성AI 발생은 각각 1.618배, 10.252배 증가하는 것으로 확인되었으며, 축산차량의 경우 100대 증가 시 가금농장의 고병원성AI 발생이 1.13배 증가하는 것으로 나타났다. 해당 모형모형으로 라 229개 시·군·구별 가금농장의 HPAI의 각 유행 당 발생 건수(Mean Predicted Value)를 예측한 결과, 나주시가 2,060건으로 가장 많았고 익산 48.7, 함평 26.9, 남원 25.1, 부안 13.7 등의 순서로 확인되었고, 229개 시·군·구의 평균 발생건수는 10건으로 나타났다. AI인체감염증 위험 매트릭스의 위해(hazard) 축은 위의 모형을 통해 확인한 시·군·구별 가금농장 고병원성AI 유행당 평균 발생 예측 건수를 적용하였고, 취약성 축은 시·군·구별 가금관련 축산시설 수를 적용하였다. 각 축에 해당 변수 값의 분포를 구간화 하기 위하여 k-평균 군집화를 적용해 본 결과, 축산시설은 15번의 반복계산 이후 군집 중심값의 변화가 없거나 작아서 수렴이 일어났고 최종적으로 74개소, 468개소, 763개소, 1,046개소, 1,521개소의 5개 군집 중심이 확인되었으며, 각 군집별 시·군·구 수는 각각 100개, 54개, 43개, 22개, 10개로 나타났다. 가금농장의 HPAI 평균발생 건수는 2번의 반복계산 이후 군집 중심값의 변화가 없거나 작아서 수렴이 일어났고, 최종적으로 0.303건, 9.286건, 26.000건, 48.714건, 2,060.000건의 5개 군집 중심이 확인되었으며, 각 군집별 시·군·구 수는 각각 217개, 8개, 2개, 1개, 1개로 나타났다.「위험=위해 × 취약성」에 따라 229개 시·군·구를 Fig. 2와 같이 5 × 5 매트릭스에 해당하는 영역에 배치한 결과, AI인체감염증의 매우 고위험 지역은 전라남도 나주시로 확인되었고, 고위험 지역은 전라북도 정읍시, 전라북도 남원시로 나타났다. 중간 위험지역은 울산광역시 울주군, 강원도 3개 지역(춘천, 홍천, 횡성), 충청북도 4개 지역(청주, 충주, 제천, 음성), 충청남도 5개 지역(공주, 보령, 서산, 당진, 홍성), 전라북도 6개 지역(김제, 부안, 익산, 진안, 장수, 임실), 전라남도 4개 지역(함평, 담양, 곡성, 고흥), 경상북도 6개 지역(안동, 구미, 영주, 상주, 경주, 예천), 경상남도 5개 지역(창원, 진주, 산청, 거창, 합천)으로 확인되었다. 나머지 지역은 AI인체감염 저위험 지역으로 나타났다(Fig. 3).
CI, Confidence Interval; HPAI, Highly Pathogenic Avian Influenza; LPAI, Low Pathogenic Avian Influenza; RR, Relative Risk.
고 찰
위험 매트릭스를 활용하여 AI인체감염증의 발생 위험지역을 평가하는 것은 그동안 연구 사례가 없는 최초의 연구로 원 헬스(One Health) 관점의 사전 예방적 방역정책 마련에 기초 자료로 활용할 수 있다는 점에서 큰 의미가 있다고 볼 수 있다. 위험 매트릭스를 통해 위험지역을 분석하는 것은 정책적 의사결정과 위기 대응 계획 수립에 활용 가능하므로(Koehle et al., 2016), 이번 연구에서 AI인체감염의 위험이 높게 확인된 지역을 중심으로 위험요인에 대한 선제적 관리 및 방역계획 수립이 필요하다고 판단된다. AI인체감염증의 예방은 가금농장의 고병원성AI와 연계하여 공통적인 위험요인을 관리할 필요가 있으며, 이번 연구에서 가금농장의 HPAI 발생에 영향을 주는 위험요인으로 가금농장의 저병원성AI 발생 건수, 닭과 오리의 사육 밀도, 축산차량 등록 현황이 확인되었다. 가금농장의 밀집 정도는 고병원성AI의 감염 및 전파에 많은 영향을 미친다는 결과를 제시한 선행연구(Park et al., 2019; Ahn et al., 2020)와 같이 이번 연구에서도 닭과 오리의 밀도는 HPAI 발생에 유의성있는 변수로 확인되었다. 오리농장의 HPAI 발생 요인을 분석한 선행연구(Ahn et al., 2020)에서도 오리는 사육으로 얻어지는 수익이 많아 사육두수가 많고 사육 회전율이 높아서 AI바이러스의 전파 위험이 높다고 제시하였다. 또한, 농림축산검역본부 역학조사보고서에 따르면 ’03년부터 ’18년까지 7차례 고병원성AI 유행에 따른 1,055건의 양성건 중 오리농장의 발생이 553건으로 가장 많았고(닭 465건, 기타 37건), ’14년 이후 오리의 양성건수가 466건으로 집중적으로 늘어남에 따라 2017년 오리사육 휴지기제 등의 정책이 시행되는 등 오리에 대한 관리는 가금농장의 HPAI뿐만 아니라 AI인체감염증 예방에 있어서도 가장 중요한 위험요인이라고 판단된다.
위험요인인 가금 사육 두수를 줄이기 위해 2017년 농림축산식품부는 오리 사육 휴지기제를 시행하였고, 그 결과 2016/17 고병원성AI 유행에 비하여 2017/18 유행은 발생 건수의 감소(421건 → 22건), 살처분 수의 감소(3,808만 마리 → 654만 마리), 살처분 보상금 지출 감소(2,195억원 → 551억원)의 성과가 있었다. 다만, 전체 오리 사육수의 약 50.4%인 352만 마리의 오리 사육을 인위적으로 제한한 결과 오리고기 가격 상승과 소비자 생산자 잉여가 감소하는 등 사회·경제적 파급효과가 크게 나타날 수 있기 때문에(Cho et al., 2019) 신중한 접근이 필요하다. 가금농장의 LPAI가 검출된 것은 야생조수류 등으로 인해 농장 내부로 AI 바이러스가 유입되었음을 추정할 수 있고, 1983년 미국의 H5N2 HPAI, 1994년 멕시코 H5N2 HPAI, 1999년 이탈리아 H7N1 HPAI, 2003년 네덜란드 H7N7 HPAI의 경우와 같이 LPAI 바이러스가 고병원성으로 변이되어 피해를 유발할 수 있다는(Richard et al., 2017) 연구 결과와 같이 이번 연구에서도 주요한 위험요인으로 확인되었으므로 AI인체감염증 예방을 위해 야생조수류와 가금농장에서 지속적인 능동예찰 및 관리가 필요하다. 축산차량은 농림축산검역본부의 역학조사 결과와 같이 이번 연구에서도 위험요인으로 확인되었다. 여러 선행연구에서 철새도래지는 가금농장에서 HPAI 발생확률을 높이는 위험요소로 제시하였으나(Ahn et al., 2019; Kim and Bae, 2020), 이번 연구에서 철새도래지와 관련된 요인인 야생조류의 HPAI 검출건수, 경지밀도와 하천밀도는 HPAI 발생에 유의성있는 변수로 확인되지 않았다. 이는 과거 연구들이 농장단위 분석이었다면 이번 연구는 행정구역 단위 분석으로 공간적 자기상관성이 배제되었기 때문으로 판단된다. 또한, 방사 사육 형태(Backyard Farm)가 많은 동남아시아 등에서 나타난 가금농장 주변 농경지의 면적이 증가하면 HPAI의 발생이 증가한다는 연구결과(Gilbert et al., 2007)와 달리 축산물품질평가원의 2020년 축산물유통정보조사 보고서에서 우리나라는 가금 계열화 비율(닭 96.4%, 오리 93.4%)이 높아 방사 사육의 비율이 낮다고 볼 수 있어 위험요인으로 나타나지 않은 것으로 판단된다.
많은 연구에서 AI인체감염증의 위험요인을 제시하고 있지만 발생 위험지역에 대해서는 연구한 사례가 없었다. 이번 연구에서 k-평균 군집화를 통해 229개 시·군·구를 분류하고 위험 매트릭스 상 25개의 셀에 배열한 결과 상대적으로 가금농장과 축산시설의 수가 적은 도시화된 지역의 위험도가 낮게 확인되었다. 저위험(Low risk)으로 확인된 지역은 192개 시·군·구로 전체 229개 중 83.8%로 나타났는데, 이는 통계청에서 확인된 2021년 우리나라의 도시화율인 81.4%와 비슷한 수치이다. 현실적으로도 AI바이러스에 감염된 조류와 접촉 가능성이 낮은 도시화된 지역에서 거주하는 일반 국민들에게 AI인체감염증의 발생 가능성은 낮다고 판단된다. 농림축산검역본부의 역학조사보고서에 따르면 국내 가금농장의 고병원성AI의 유행주기는 평균적으로 약 2~3년이기 때문에 위험 매트릭스도 주기적으로 분석하여 원헬스적 관점에서 AI인체감염증 발생 위험 지역과 위험요소를 파악하고 관리할 수 있다면 방역당국의 의사결정을 명확히 하고 사회·경제적 비용을 감소할 수 있을 것으로 판단된다. 이번 연구에서 AI바이러스가 가금에서 사람으로 전파되는 종 감수성과 개별 농장의 방역수준, 바이러스 혈청형과 clade, 개별 축산관계자의 위생인식 및 예방접종 수준, 지역별 가금 관련 축산관계자의 정확한 통계 및 국외 발생 사례 등 AI인체감염증에 영향을 줄 수 있는 다양한 요인들을 고려하지 않은 한계가 있다. 또한 모델의 범용성 측면에서 가금농장과 야생조류의 고병원성AI 발생 최신 데이터가 지속적으로 추가·보완된다면 보다 정확한 위험도 평가가 가능할 것으로 판단된다. AI인체감염증에 대하여 농식품부, 보건복지부, 환경부 등 관련 부처 및 중앙·지방 정부간 원헬스적 접근으로 상호 정보공유 및 합동 조사 등을 추진하여 향후 연구에서 상기 사항들을 보완할 수 있다면, AI인체감염에 대하여 더욱 면밀한 위험분석으로 사전 예방적 방역관리에 활용할 수 있을 것으로 생각된다.








