서 론
산란계에서 산란 지속성은 경제적 측면과 함께 환경 관점에서도 매우 중요하여 10주간 산란율을 유지하면 12개 계란 생산 시 1 g의 질소 배출 감소 효과가 있다(Bain et al., 2016). 산란 지속성은 육종 개량, 사양 관리, 사료 급여 방법, 질병 예방, 환경 관리 등 다양한 요인에 의해 결정된다(Bain et al., 2016; Underwood et al., 2021). 따라서 높은 산란 지속성을 유지하기 위해서는 닭의 생산단계에 따른 산란 관련 기관의 기능 발달과 노화 및 이들 조직의 항상성 유지에 대한 생리적 이해가 필수적이다. 산란계는 부화 발생기, 육추기 및 산란기 등과 같은 생활사와 산란 주기별 체 조직의 대사와 항상성 조절 작용의 변화가 발생된다(Lilburn and Loeffler, 2015; Gu et al., 2021a). 닭의 신체 발육과정을 살펴보면 부화 직후에는 소화기관이 급격히 발달하는 시기로서 6~10일령에 소장 및 간의 발달이 활발히 이루어진다(Kim et al., 2021). 고도의 신체 발육기에는 대사 작용에 따른 체 조직에서 발생하는 산화 스트레스를 방어하는 항산화 효소 역시 부화 전후 체 조직에서 높게 발현된다(Surai, 2020; Nam et al., 2024). 소화기에 이어 번식기 발달이 진행되어 산란기에는 이들 기관에서 대사 및 생리 작용의 변화로 산화 스트레스가 급격히 증가한다(Tang et al., 2019). 닭의 산란 주기는 18~20주령에 산란이 개시되어 30~40주령에서 최대 산란 피크를 나타낸 후 48주령 이후 점차 감소하는 산란 후기의 형태로 구분된다(Tumova et al., 2017; Du et al., 2025). 특히 산란후기 56~65주령에는 난의 품질도 급격히 저하되고 난각 강도, 육반 및 혈반 등의 발생이 증가한다고 보고되었다(Kim et al., 2018). 산란 생리는 유전적 소인, 영양, 장내 미생물, 광 주기, 계절 등 많은 내외적 요인에 의해 영향을 받는다(Liburn and Loeffler, 2015; Muyyarikkandy et al., 2023).
산란이 진행될수록 산란 스트레스와 연령 증가에 따른 노화로 소화기와 번식기의 산화 스트레스가 점증된다(Gu et al., 2021b). 지속적 산란은 과도한 활성 산소(reactive oxygen species, ROS) 생성을 유발하여 지질 과산화, DNA와 조직 단백질 손상 등을 초래한다(Liu et al., 2018). Zhang et al.(2020)은 산란후기 산란계의 소장에서 흡수 세포 구조 손상, 막 투과성 증가, 영양소 흡수율 감소 등 소화 기능의 저하가 발생한다고 보고하였다. 또한 위장관에서 Lactobacilli 등 유익 미생물군이 감소하고 Clostridium perfringens 등 유해균이 증가하므로 점막조직에서 염증도 증가한다(Zhang et al., 2020). 소장 상피세포는 분화가 1~3일로 매우 짧고 영양, 위장관 미생물, 연령, 스트레스 등 많은 요인에 의해 영향을 받기 때문에 소장의 기능을 잘 유지하는 것이 산란 생산성에 매우 중요하다(Estaki et al., 2014). 또한 닭은 간에서 75%의 난황 지방이 합성되므로 지속적 산란으로 지방증(steatosis)과 지방간(fatty liver) 발생이 증가하여 난 생산성이 현저히 감소한다(Julian, 2005). 난관은 좌측 복강의 대부분을 차지하는 가장 큰 번식기관으로 관상선 세포에서 난백 단백질(ovalbumin)을 합성하고 난관 누두부와 팽대부를 거치며 난황과 난 단백을 결합하여 계란을 형성한다(Cipera, 1980).
산란계는 산란후기로 진행될수록 소장 흡수 세포 기능 감소, 지방간, 난소 및 난관 기능 저하 등과 같은 복합적 요인으로 난 생산성이 감소한다(Zhang et al., 2020; Taghipour-Shahbandi et al., 2024). 이는 산란 스트레스와 연령 증가로 소화기와 번식기의 산화-환원력 불균형에 따른 산화 스트레스가 주요한 원인이라고 알려져 있다(van Eck et al., 2023). 따라서 산란 지속성을 높이기 위해서는 산란 단계별 산화 스트레스 발생 정도에 관한 연구가 중요하지만 지금까지 이에 관한 연구는 부족한 실정이다. 닭에서 산란에 따른 산화 스트레스를 예방하기 위해 항산화 vitamins과 무기물을 급여하여 난 생산성 및 품질을 향상시킬 수 있다는 많은 연구가 보고되었다(Surai, 2002; Jang et al., 2014b). 또한 carotenoids, flavonoids 등 식물성 항산화제는 체 조직에서 항산화력을 증진하여 생산성, 면역 및 번식을 증진한다는 다양한 연구도 보고되고 있다(Jang et al., 2014a; Surai, 2020; Bi et al., 2024).
따라서 본 연구는 White Leghorn에서 산란 단계별(산란개시기, 피크기 및 후기) 소장, 간 및 난관에서 소화 효소와 항산화 지표를 조사하여 산란과 연령 증가에 따른 스트레스로부터 산란 생산성을 높일 수 있는 기초 자료를 제공하고자 한다.
재료 및 방법
본 연구는 동물실험윤리위원회의 승인(GNU-240710-C0142)을 받고 규정을 준수하여 동물실험을 실시하였다. 실험계는 본 대학에서 유지 중인 White Leghorn 종계에서 부화하여 케이지 육추한 18주령부터 62주령의 산란계를 이용하였다. 사육 시설은 반개방 평사 사육사(2,800 cm2/수)로서 자연 일조 조건에서 자유 급이와 급수로 사양 관리하였다. 산란 단계별 주령은 산란개시기(18주령), 산란피크기(36주령) 및 산란후기(62주령)로 구분하여 전체 18수(n=6)를 선발하여 실험 분석에 이용하였다. 상세한 세부 사양 관리는 경상국립대학교 동물사육장의 관리 방법을 준수하여 실시하였다.
케이지 육추 후 평사 사육 중인 18, 36 및 62주령 암컷 White Leghorn을 각 주령별 체중이 유사한 6수를 선발하여 3시간 절식하고 실험에 사용하였다. 조직 샘플을 채취하기 위해 체중을 측정하고 에테르 마취 후 경정맥을 절개하여 안락사 하였다. 소장, 간, 췌장, 비장 및 난관 등의 장기를 획득하여 무게를 측정하였다. 소장은 근위 아래부터 결장 앞까지 소장 전 부위 채취 후 장간막 지방을 제거하고 생리식염수로 세척하여 소화물을 제거하였다. 소장 점막 세포를 획득하기 위하여 절개 후 glass slide로써 점막을 분리하고 일정량의 mannitol 완충 용액(pH 7.4)을 혼합하여 5,000 rpm에서 원심분리(Vision, VS-15,000 CF) 후 점막 무게(십이지장 및 공장)를 측정하였다. 획득한 장기는 무게를 측정하고 소장 점막, 간 및 난관은 −70°C에서 분석 시까지 냉동 보관하였다.
소장(십이지장 및 공장)에서 채취한 점막 조직을 mannitol buffer(150 mM mannitol, 10 mM tris base, 30 mM succinate, 5 mM K2HPO4; pH 7.4)에 적정 비율로 혼합하여 균질화(omni tissue homogenizer, Omni Int., NW, USA)하였다. 점막의 융모 구성 성분으로 존재하는 효소를 분리하기 위해 2% triton X-100을 1:1 비율로 혼합한 시료를 2시간(25°C) 저장한 후 5,000 rpm(4°C)에서 원심분리하여 얻은 상층액을 효소 활성도 분석에 사용하였다. 이당류 분해 효소인 maltase와 sucrase는 Dahlgvist(1968)의 방법을 ELISA(VMax, molecular devices, CA, USA)에 적용하여 최종 분해 산물 glucose는 sigma glucose assay kit로 분석하였다. Leucine aminopeptidase(LAP) 활성도는 Gal-Garber and Uni(2000) 방법으로 leucine p-nitroaniline를 기질로 사용하여 405 nm에서 ELISA를 이용하여 측정하였다. Alkaline phosphatase(ALP)는 assay kit(Takara Bio Inc., Cat MK301, Shiga, Japan)를 이용하여 희석한 점막 조직 균질액을 p-nitrophenyl phosphate (pNPP) 용액과 혼합하여 37°C에서 30분간 발색 반응을 시행하였다. 이후 0.5 M NaOH stop 용액을 첨가하고 ELISA (405 nm)로 흡광도를 측정하여 활성도를 계산하였다. 단백질 분석은 Pierce BCA protein(Assay kit 23225, Thermo, MA, USA) kit로 570 nm에서 ELISA를 사용하여 측정하였다. 효소 특이적 활성도(specific activity)는 전체 활성도에서 단백질 mg당 농도로 나누어 표시하였다.
각 조직의 cytosol 분획은 Xia et al.(1995) 방법에 따라 실시하였다. 간단히 기술하면, 조직과 isolation buffer (0.32 M sucrose, 0.001 M EDTA 및 0.01 M Tris-HCl)를 1:5 비율로 혼합하여 균질화(Omni tissue homogenizer, Omni Int. NW USA)하고 13,600 ×g에서 30분 원심 분리를 실시하였다. 원심분리 후 획득한 상층액은 항산화 효소 및 지질 과산화도를 분석하기 위해 −70°C에 냉동 보관하였다. Superoxide dismutase(SOD) 활성도는 SOD assay kit(Cayman, Ann Arbor, MI, USA)를 이용하여 분석하였다. 분석방법으로 희석한 간 cytosol에 radical detector와 xanthine oxidase를 혼합하고 실온에서 30분 저장하였다. 분석은 ELISA로써 450 nm에서 측정하여 활성도를 계산하였다. 결과 값의 단위는 SOD 활성도를 50% 저해하는 값을 1 unit로 정의하였다. Glutathione peroxidase(GPX) 활성도는 Tappel et al.(1978) 방법에 따라 실시하였다. 방법을 간단히 기술하면, 시료에 반응 용액(0.1 mM NADPH, glutathione reductase 1 unit/mL, reduced glutathione, 0.25 mM; pH 7.4)을 첨가 후 5분간 37°C incubator에서 저장하고 H2O2를 첨가하여 분광 광도계(Ultrospec 2100 pro, Biochrom, USA)로 340 nm에서 흡광도의 감소 속도를 측정하였다. GPX 활성도 unit는 단백질 mg당 1분 동안 산화되는 NADPH nmol 수로 정의하였다. Glutathione s-transferase(GST)는 1 mM reduced glutathione을 chlorodinitrobenzene(CDNB) 희석한 시료를 가한 후 340 nm에서 흡광도의 변화 비율을 측정하였으며, 1 unit는 mg protein 당 1분간 반응하는 CDNB의 μmol 수로 표시하였다(Habig et al., 1974). 지질과산화물은 thiobarbituric acid 방법에 따라 생성된 malondialdehyde(MDA)을 분광광도계로서(532 nm) 흡광도를 측정하여 분석하였다(Bidlack and Tappel, 1973). 효소 특이적 활성도는 전체 활성도에서 단백질 mg당 농도로 나누어 표기하였다.
결과 및 고찰
White Leghorn에서 산란 단계별 체중과 장기 무게를 조사한 결과는 Table 1에 제시하였다. 먼저 체중의 변화를 살펴보면, 산란피크기(36주령) 닭은 산란개시기(18주령)보다 현저하게(P<0.05) 체중이 증가하였으나, 산란후기(62주령)의 닭과 비교 시에는 유의적 차이가 없었다. 산란계의 상대적 장기 무게(g/100g BW)를 조사한 결과, 간 및 췌장 무게는 산란 단계별 통계적 차이는 없었다. 그러나 소장 점막 세포량과 길이 및 비장의 상대적 무게는 주령 증가에 따라 점차 감소하여 62주령 산란계에서 가장 낮았고 18주령에서 가장 높은 결과를 보였다(P<0.05). 난관의 상대적 무게는 산란피크기(36주령)에서 산란개시기(18주령)에 비교 시 현저히(P<0.05) 증가하였고 산란후기(62주령)까지 난관의 무게가 비슷하게 유지되었다.
산란계에서 지속적인 산란 생산성을 유지하려면 소화 및 번식 기관의 기능 유지가 매우 중요하다. 닭은 부화 후 체중 증가와 함께 소화기관의 급격한 발육이 진행되며 이후 번식 기관의 발달 순서로 진행된다(Nitsan et al., 1991; Scanes et al., 2020). 소화 장기의 발육은 유전적 소인에 의해 자연발생적으로 진행되지만 섭취하는 영양소의 성분 및 수준에 의해서도 큰 영향을 받으며 소장, 췌장과 간 등의 발달이 진행된다(Richard, 2005; Kim et al., 2021). 본 연구 결과 산란개시기(18주령)까지 발달된 소장 흡수 세포 및 형태는 그 후 산란피크기를 지나 산란후기에서는 소장의 외형적 발달이 감소되었다. 연령 증가에 따른 소화기관의 외형적 변화에 관한 연구는 주로 랫드 등 실험동물을 이용하여 많이 수행되었지만(Majumdar et al., 1997), 산란계도 연령이 증가하면 소장에서 산화 스트레스가 증가하여 자가 포식(autophagy) 작용으로 흡수 세포의 기능과 구조 손상이 발생하여 항상성이 감소하는 것으로 알려져 있다(Hansen et al., 2018). Zhao et al.(2024)은 62주령 산란계에서 노화로 소장의 기능과 영양소 흡수력이 감소하여 산란 생산성이 저하되는바 항산화 물질 급여 시 소장의 기능 유지로 생산성에 도움을 줄 수 있다고 보고하였다.
간은 닭에서 지방 합성, 영양소 대사 및 해독 작용의 중추적 역할을 수행하는 소화기관으로 난황 지방의 75%가 간에서 합성된다(Richard, 2005; D’Andre et al., 2013). Viana et al.(2022)은 45주령 산란계에서 평균 소장 길이는 128.6 cm, 체중당 상대적 간 무게 2.31%, 췌장 0.21%를 나타내는 것으로 보고하여, 본 연구의 결과와 비슷하였다. 일반적으로 닭의 성장 단계에서 간 무게는 연령이 높을수록 증가하지만, 체중당 상대적 무게는 점차 감소하는 양상을 보인다(Alshamy et al., 2019). 암탉의 산란율과 간의 크기와의 상관관계를 조사한 결과, Garlich et al.(1975)은 21품종에서 71주령까지 상대적 간 무게 비율과 계란의 생산성과는 상관관계는 없었다고 보고하였다. 본 연구에서도 산란개시기(18주령)와 산란피크기(36주령) 및 산란후기(62주령)에서 간의 상대적 무게 비율은 유의한 차이가 없어 선행 연구와 일치한다.
난소 및 난관은 난 생성과정에서 영양소를 공급하는 소화기관과 함께 난황 형성 및 난 단백 합성 장소로 산란 지속성과 난 품질 유지에 가장 중요한 번식기관이다. Shi et al. (2020)은 White Leghorn에서 16~22주령까지 난관의 상대적 무게(%)를 조사한 결과 17주령부터 난관 및 난소의 무게가 급격히 증가하는 것으로 보고하였다. White Leghorn은 17주령에서 번식기의 발달이 급격히 진행되어 난포 형성이 현저히 증가한다(Shi et al., 2020). 그러나 번식 기관의 발달은 닭의 품종에 따른 차이가 있어 중국 토종계는 21주령(Shi et al., 2019), 육계는 22주령(Shi et al., 2017)에 급격히 발달하는 것으로 보고되었다. 본 연구에서도 18주령에서 난관의 크기가 가장 작았지만 36주령에서 난관의 크기가 급격히 증가한 것으로 Shi et al.(2019)의 연구 결과와 유사하다. 본 연구에서 36주령에서 44.95g의 난관 무게는 42주령 산란계의 평균 난관 무게 43.8g과 유사하였다(Cipera, 1980). 또한 62주령의 난관 무게는 36주령에 비해 감소하여 산란피크기 이후 난관 무게와 기능이 점차 감소하므로 난 생산성 역시 감소한다는 결과(Gonzalez-Moran, 2016; Taghipour-Shahbandi et al., 2024)와 일치한다. 닭에서 비장은 면역에 중요한 역할을 담당하는 기관으로 산란계의 건강과 밀접한 관련이 있다. 비장 무게와 기능은 닭의 성장과 산란율 증가에 따라 증가하지만, 연령이 증가하면서 산란후기에는 점차 감소하는 것으로 보고되었다(Schmucker et al., 2021). Xu et al.(2024)은 산란계에서 10주령에서 38주령까지 비장의 상대적 무게를 조사한 결과 주령이 증가할수록 유의하게 비장의 무게가 감소하는 것으로 보고하였다. 본 연구에서도 산란후기(62주령)와 산란피크기(36주령) 간에는 차이가 없었지만, 산란개시기(18주령)와 비교 시 연령이 증가할수록 비장의 상대적 무게가 현저히 감소하여 선행 연구 결과와 유사하였다.
White Leghorn에서 산란 단계별 소장 융모의 이당류 분해효소(maltase, sucrase), LAP 및 ALP의 특이적 활성도 변화는 Fig. 1에 나타내었다. 이당류 분해효소인 maltase와 sucrase 특이적 활성도는 18주령과 36주령에서 모두 높게 유지되었지만, maltase 활성도는 62주령에서 18 및 36주령에 비해 현저히 감소하였다(P<0.05, Figs. 1A and 1B). 소장 점막세포에서 LAP 활성도는 산란 단계에 따른 차이는 없었다(Fig. 1C). ALP 활성도는 18주령에서 가장 높게 나타났고 산란 단계가 진행될수록 36주령과 62주령에서 유의하게 감소하였다(P<0.05, Fig. 1D).
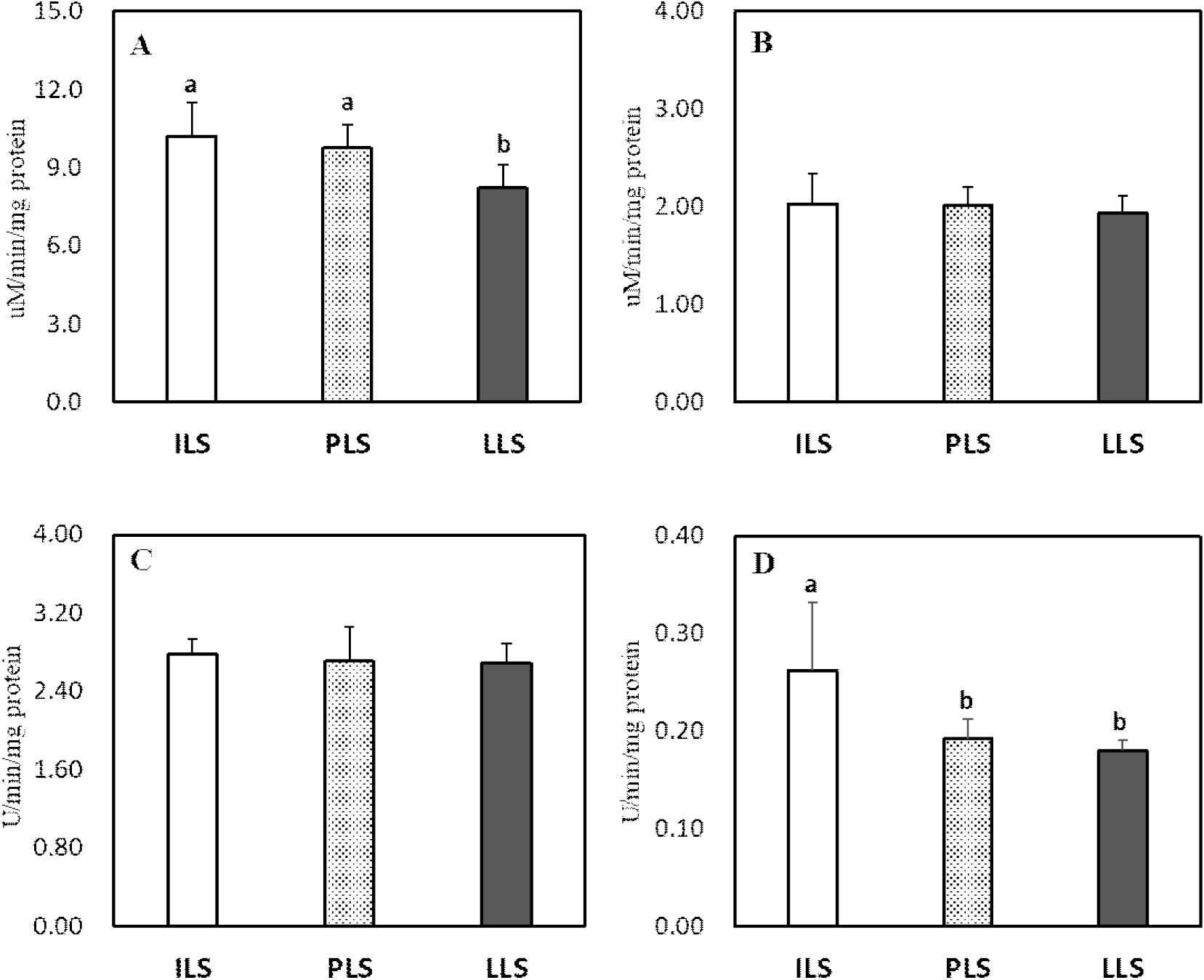
산란계에서 산란 단계별 소화 생리의 변화에 따른 대사 스트레스는 소장 흡수 세포의 구조 및 기능을 손상하여 산란 생산성과 난의 품질에도 부정적 영향을 미친다(Gu et al., 2021a). 본 연구 결과 산란후기 62주령의 White Leghorn에서 소장 흡수 세포에 존재하는 maltase 및 ALP 활성도가 18주령과 36주령과 비교 시 현저하게 감소하였다. 이러한 결과는 소장 흡수 세포에서 지속적 산란 스트레스 및 노화와 관련이 있는 것으로 해석되며, 산란피크기 이후 난 생산성이 감소하는 사실과도 연관이 있다(Tumova et al., 2017). 소장 미세 융모의 구성 성분으로 maltase와 sucrase는 이당류 분해 효소로서, 고수준의 탄수화물 사료를 섭취하는 닭에서 특히 maltase 활성도가 높다(Sell et al., 1989). 또한 산란계에서 난황의 지방산 25%는 소장에서 흡수되는 지방산에서 공급되므로 소장의 흡수 세포 기능이 매우 중요하다(Alvarenga et al., 2011; van Eck et al., 2023). 산란계의 생산성은 소장의 구조, 소화 효소 활성도, 장내 미생물 등과 같은 위장관의 기능에 의해 영향을 받는다(Gu et al., 2021a; Kim et al., 2021). 본 연구 결과와 유사하게 Hy-line brown 산란계 75주령은 28주령에 비해 소장의 maltase와 sucrase 활성도가 감소하고 trypsin 농도 또한 감소하여 미소화 아미노산이 증가하였다고 보고되었다(Gu et al., 2021a). 노령 산란계에서는 소장의 아미노산 운반체 발현 저하로 아미노산 흡수율도 감소하는 것으로 보고되어(Dato et al., 2019) 위의 사실을 뒷받침한다. ALP는 일인산염 에스테르(phosphomonoester) 가수분해 효소로서 인의 흡수와 융모의 crypt-villus 분화 지표이다(Belabbas et al., 2015). 소장에서 ALP 발현은 융모의 분화 발달, 영양 수준, 위장관 미생물 등 다양한 요인에 의해 영향을 받는데(Estaki et al., 2014; Gao et al., 2024), 본 연구 결과 산란개시기(18주령)에서 가장 높은 ALP 활성도를 보여 이 시기가 소장 흡수 세포의 발달과 분화율이 높고 장관의 건강성이 우수한 것으로 생각된다. 산란후기에서는 소장의 기능 및 소화율 저하로 난 형성에 필요한 영양소 공급이 감소하여 생산성과 난 품질이 저하된다(Zhang et al., 2020). 또한 산란후기에는 난관의 기능 저하로 난의 albumen 무게가 감소하고 난 신선도도 감소하는 것으로 보고되었다(Izat et al., 1986; Gu et al., 2021b).
이상의 결과 White Leghorn에서 소장 점막의 maltase 활성도는 18 및 36주령에서 가장 높은 수준을 보였고 ALP 활성도 역시 18주령에서 가장 높았고 62주령에서 가장 낮았다. 따라서 산란후기 62주령에서 소장 흡수 세포의 기능 및 분화 발달이 점차 감소하는 것으로 산란후기의 산란 지속성 및 난 품질을 증가시키기 위해 사료 영양소 배합 조절, 생균제와 효소제 등과 같은 사료첨가제를 활용하는 세심한 사양 관리가 필요하다.
산란 단계별 소장, 간 및 난관 조직의 항산화 효소 활성도와 지질과산화도 변화는 Figs. 2, 3, 4, and 5에 각각 나타내었다. 소장 점막조직의 항산화 효소 분석 결과, 18주령과 비교 시 산란후기 62주령에서 SOD 활성도가 유의하게 감소하였으나(P<0.05, Fig. 2A), GPX를 포함한 다른 항산화 효소들은 산란 단계에 따른 뚜렷한 변화가 관찰되지 않았다(Figs. 2B, 2C, and 2D). 간 조직의 SOD, GPX 및 CAT 활성도는 18주령과 36주령과 비교 시 62주령에서 유의하게 감소하였다(P<0.05, Figs. 3A, 3B, and 3C). 그러나 GST 활성도는 산란후기 62주령에서 유의하게 높은 수준을 보이는 것으로 나타났다(P<0.05, Fig. 3D). 난관 조직에서 항산화 효소를 살펴보면, SOD, GPX 및 CAT 활성도는 산란개시기와 비교 시 산란피크기 또는 산란후기에서 이들 효소의 활성도가 현저히 감소하였다(P<0.05, Figs. 4A, 4B, and 4C). 난관 조직에서 GST 활성도는 산란 단계가 진행될수록 오히려 증가하여 62주령에서 가장 높은 활성도를 보였다(P<0.05, Fig. 4D). 지질과산화도를 살펴보면(Fig. 5), 소장 점막 세포와 난관 조직에서는 MDA 변화가 없었지만, 간 조직의 MDA 함량은 18주령과 32주령을 비교 시 62주령에서 유의하게 증가하였다(P<0.05, Fig. 5B).
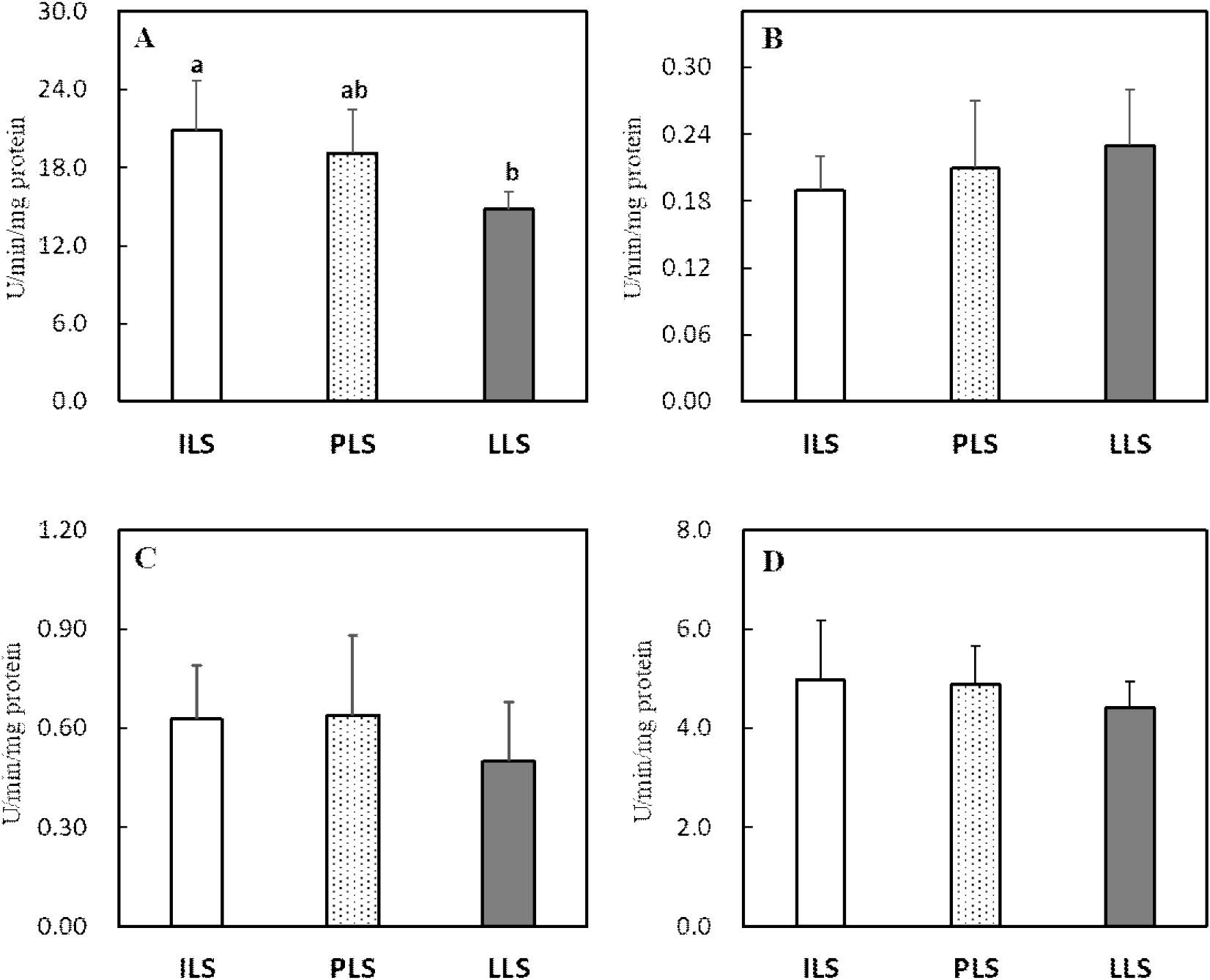
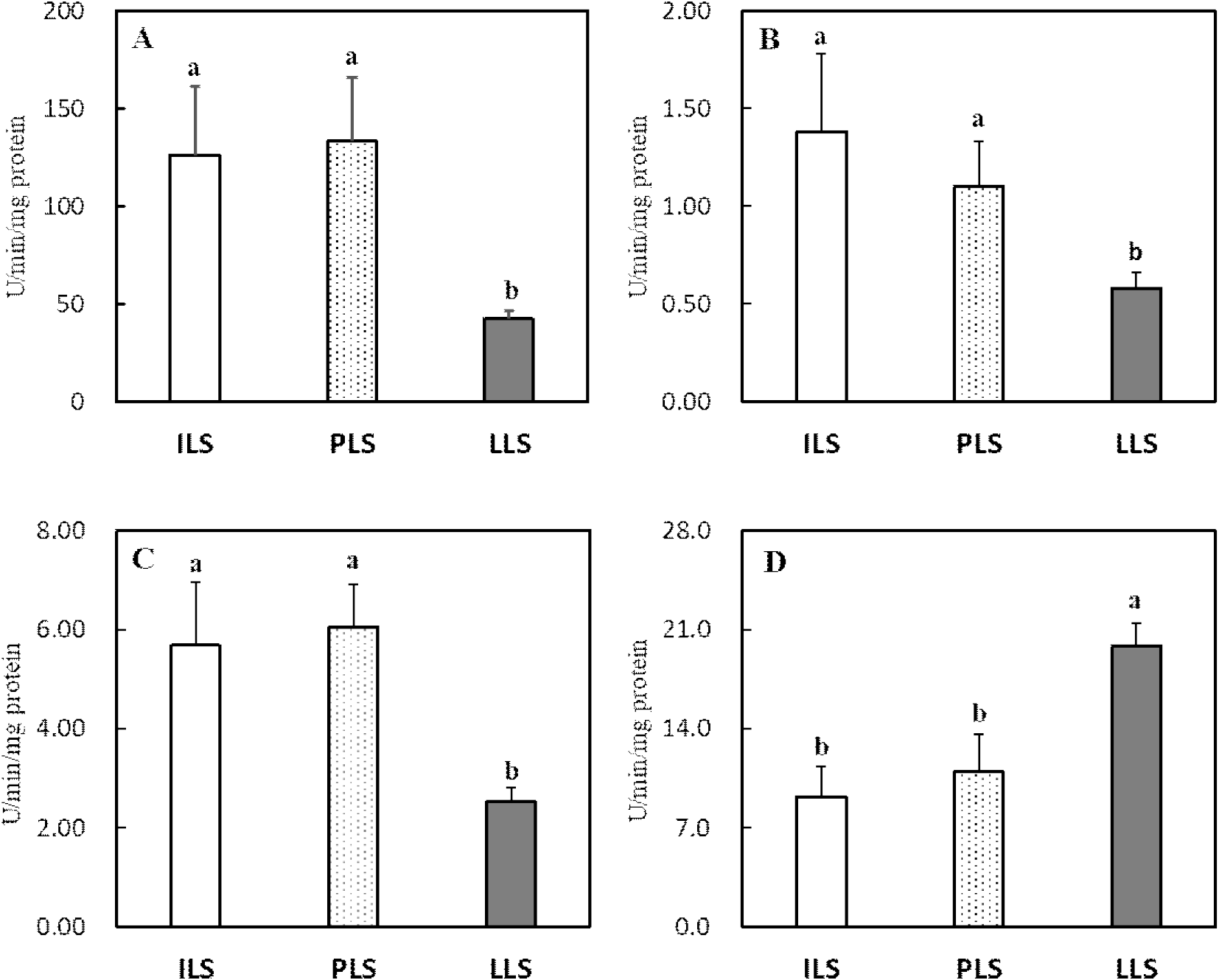
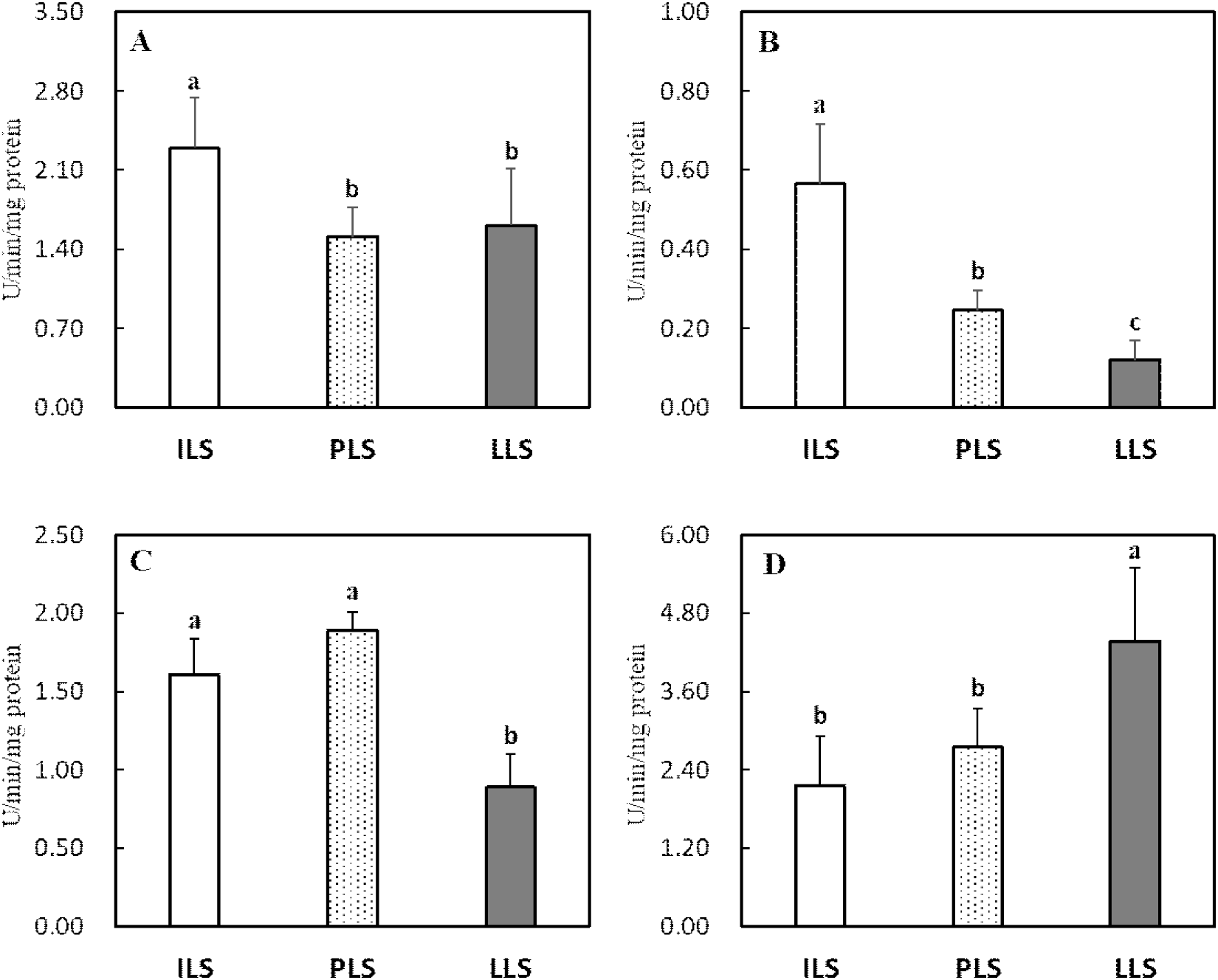
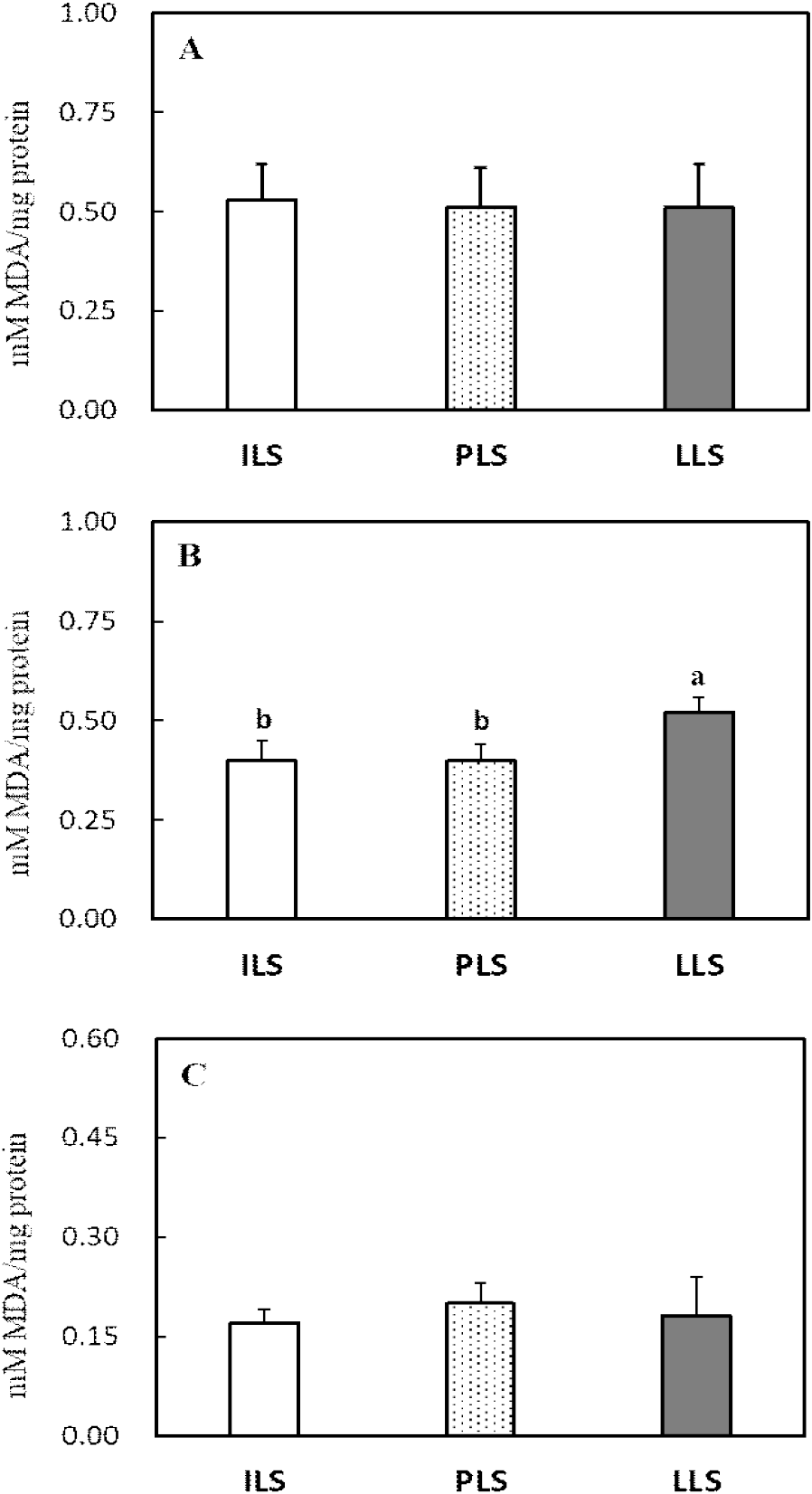
산란계에서 지속적인 산란율을 유지하기 위해서는 난황과 난백 형성에 필요한 영양소를 공급하는 소장, 지방 합성의 중추 기관인 간 및 난백을 형성하는 난관에서 산화 스트레스 완화가 매우 중요하다(van Eck et al., 2023). 본 연구 결과 산란 단계별 산란에 관련된 장기의 항산화 효소를 조사한 결과, 특히 산란후기 62주령에서 간과 난관의 SOD, GPX 및 CAT 활성도가 감소하고 간의 지질과산화도가 현저히 증가하여 산란에 따른 심각한 산화 스트레스가 발생되는 것을 확인하였다. 산란계와 같이 성장이 느린 닭에서도 항산화 작용으로 SOD가 체 조직의 산화 스트레스를 예방하는 중추적 역할을 한다(Coudert et al., 2023). 닭은 배아 발생단계에서 난황 내 불포화지방산 함량이 높고 활발한 대사 작용이 개시되고(Tang et al., 2019), 급격한 체 성장이 이루어지는 육추기에도 소장, 간 등에서도 높은 산화 스트레스가 유발된다(Kim et al., 2021). 또한 산란기에는 지속적 산란으로 소화 및 번식기에서도 산화 스트레스가 발생한다(Wang et al., 2021; Xu et al., 2024). 닭의 소장 상피세포는 발달 분화 단계가 1~3일로 짧으며, 연령, 영양, 장내 미생물, 스트레스, 사료첨가제 등 여러 요인이 소장의 구조와 기능, 미생물균총, 산화-환원 작용, 면역 등의 변화를 유발하여 난 생산성에 영향을 미친다(Estaki et al. 2014; Wang et al., 2021). Li et al.(2022)은 80주령 산란후기에는 노화로 소장에서 산화-환원력의 불균형으로 소장 흡수 세포의 구조와 기능에 문제를 발생되어 산란율이 감소된다고 보고하였다. 따라서 지속적 산란 스트레스는 소장 흡수 세포의 구조 변화와 염증을 유발하고, 염증에 따른 ROS는 산란계의 산화 스트레스로 소장관의 기능이 손상된다(Li et al., 2022). 본 연구에서도 선행 연구와 유사하게 산란후기 62주령의 소장에서 SOD 활성도가 감소하는 것으로 나타나 산란이 진행될수록 소장에서 산화 스트레스 방어 작용이 감소하는 것으로 보인다. Du et al.(2024)은 산란후기 71주령 닭에게 betaine 급여 시 소장 흡수세포의 SOD, CAT와 항산화 효소 전사인사(Nrf2) 발현을 촉진하여 산화 스트레스를 완화한다고 보고하였다.
간에서 합성된 지방은 난소에서 난황으로 축적되는데, 난황 지방의 70%는 간에서 합성됨으로 지속적 산란은 간 조직에 심각한 산화 스트레스를 유발한다(Wagner et al., 1978). 따라서 산란후기에는 간 조직에서 지방증과 지방간 발생률이 현저히 증가하여 난 생산성과 품질이 감소한다(Julian, 2005). 산란후기에는 고에너지 사료와 케이지 사육에 따른 운동 부족으로 간과 복강에 과도한 지방 침착으로 간 조직은 지방간 출혈증후군(fatty liver hemorrhagic syndrome, FLHS)이 다발한다(Shinia et al., 2019). Shinia et al.(2019)은 19주령 산란계에서는 발생되지 않았지만 28주령 이상 과체중 산란계에서 FLHS 유병률이 급격히 증가하고 산란율은 감소한다고 보고하였다. Xing et al.(2020)은 간, 소장, 난소, 난관에서 지방 축적이 증가하면 대사성 질병으로 SOD, catalase 등 항산화 효소가 감소하고 지질과산화도가 증가한다고 보고되었다. Chu et al.(2024)도 지방간 증상이 유발된 50주령 산란계의 간 조직에서 SOD와 GPX 등 항산화 효소 활성도가 감소하고 지질과산화가 증가하였다는 결과를 발표하였다. Gu et al.(2021b)도 28, 48.5주령 및 75주령 산란계의 간 조직에서 항산화 지표를 조사한 결과, 75주령에서 SOD와 GPX 활성도가 현저히 감소하고 지질과산화가 증가한다는 사실을 보고하였다. 이러한 결과들은 본 연구에서도 36주령과 62주령에서 산란개시기 18주령보다 간 조직에서 SOD와 GPX 활성도가 현저히 감소하고 지질과산화가 증가한 사실과 매우 유사하다. 그러나 본 연구에서 산란후기 닭의 간 조직에서 GST 활성도는 오히려 현저히 증가하였다. 이는 산란후기에 지방간 증상과 같은 세포 손상으로(62주령 83.3% 지방간 발생, 본 연구의 data 미제시) 간 조직에서 대사 작용 이상에 따른 이물질 해독 효소인 GST가 증가하였다고 판단된다. Tsai et al.(2017)는 Hy-Line 산란계(25~45주령)에서 지방간을 유발시킨 결과 간의 GST 활성도가 현저히 증가하여 닭에서 지방간증후군의 biomarker로서 GST가 이용될 수 있다고 보고하였다. GST는 산화 스트레스로 발생한 대사산물을 제거하는 작용과 독성물질 해독기능을 동시에 가지고 있는 이물질(xenobiotics) 대사 효소로서(Hayes et al., 2005), 본 연구에서 산란후기에 간 조직 손상에 따른 보상작용에 의해 GST 발현이 증가한 것으로 생각된다.
산란계의 난관 발달과 난백 합성은 estrogen에 의해 촉진되며 누두부와 팽대부의 관상선 세포에서 난백이 합성되어 난의 형성에 중요한 역할을 한다(Cipera, 1980). 특히 번식 기관은 타 장기보다 노화에 가장 취약한 조직으로 난관의 건강은 산란 생산성과 난 품질의 필수적 조건으로 난관의 산화 스트레스 완화가 중요하다(Elhamouly et al., 2019). 일반적으로 산란후기에는 산화 스트레스로 난소에서 난포 형성이 줄고 난관에서 알부민 형성이 감소하여 난 생산성과 품질이 현저히 저하된다(Xu et al., 2024). 궁극적으로 산란계에서 지속적 산란은 간 손상과 더불어 번식기에서 높은 산화 스트레스가 유발된다. 따라서 산란계에서 산란 지속성과 난 품질을 위해서는 소화기-번식기의 대사적 연결 축에서 항산화 방어 작용은 매우 중요하다고 생각된다. 특히 산화 스트레스가 과도하게 발생하는 산란피크기와 후기에 난 생산성과 품질 유지를 위한 사양 전략으로 항산화제의 급여가 필요하다. 또한 지속적 산란과 사양 환경의 변화에 따라 발생되는 산화 스트레스에 대한 저항성이 높은 품종개량 역시 양계 산업에서 중요하게 고려해야 할 것으로 생각된다.
이상의 결과를 종합해보면, 산란계는 산란개시기 18주령에서 소장 흡수세포의 소화 효소 및 간과 난관 조직에서 산화 스트레스를 방어하기 위한 항산화 효소들이 높게 발현하였다. 그러나 산란피크기 이후 산란에 따른 과도한 산화 스트레스로 산란후기 62주령에는 소화 효소 및 간과 난관의 항산화 효소 활성도가 현저히 감소하였다. 한편 산란후기에는 세포 손상의 보상작용으로 간과 난관 조직에서 GST 발현은 증가하였다.
적 요
본 연구는 White Leghorn에서 산란 단계(산란개시기 18주령, 산란피크기 36주령 및 산란후기 62주령)별 소장 흡수세포의 소화 효소 및 소장, 간과 난관에서 항산화 작용에 관한 변화를 조사하기 위하여 실시되었다. 산란 단계에 따른 체중과 증체량은 18주령에서 36주령까지 유의하게 증가하였지만(P<0.05), 36주령과 62주령 간에는 차이가 없었다. 간 및 췌장의 상대적 장기 무게(g/100g BW)는 산란 단계에 따른 차이가 없었다. 소장 점막세포량 및 비장의 상대적 무게는 62주령에서 가장 낮았고 18주령에서 가장 높았다(P<0.05). 난관의 상대적 무게는 36주령에서 가장 높았고(P<0.05), 산란후기 62주령에서는 감소하는 경향을 보였다. 소장 점막세포의 maltase 활성도는 18 및 36주령, alkaline phosphatase 활성도는 18주령에서 가장 높았고 모두 62주령에서는 현저하게 감소하였다(P<0.05). 산란 단계별 항산화 지표를 살펴보면, 소장 점막에서 SOD 활성도는 산란후기 62주령에서 산란개시기 18주령보다 현저히 감소하였지만(P<0.05), 다른 항산화 효소는 차이가 없었다. 간과 난관 조직에서 항산화 효소의 활성도 변화를 보면, SOD, GPX 및 CAT 활성도는 18주령에서 가장 높았으나, 32주령 이후 또는 62주령에서 현저히 감소하였다(P<0.05). 한편 간과 난관 조직에서 GST 활성도는 산란 단계가 진행될수록 현저하게 증가하여 62주령에서 가장 높았다(P<0.05). 지질과산화도는 소장과 난관에서는 산란 단계별 차이가 없었지만 간 조직에서는 18 및 36주령과 비교 시 62주령에서 유의하게 증가하였다(P<0.05). 이상의 결과 White Leghorn에서 산란후기 62주령에서 소장의 소화 효소 및 간과 난관에서 SOD, GPX 및 CAT 등 항산화 효소가 현저히 감소하고 간에서 지질과산화도가 증가하였다. 따라서 산화 스트레스가 과도하게 발생하는 산란피크기와 산란후기에 항산화제의 적용은 난 생산성과 품질 유지에 매우 중요한 사양 전략이 될 수 있다.








