서 론
가금에 있어서 인공수정기법의 발달과 함께 체외에서 정액을 활용하는 방법은 수많은 육종가들이 가장 많이 이용하는 방법으로 오랜 역사를 가지고 있다. 그럼에도 불구하고 닭 동결정액에 관한 연구는 아직 미진하고, 실험실 수준에서 머무르고 있다고 판단된다(Choi et al., 2012; Choi et al., 2013). 이러한 이유는 아직까지 닭에서 동결정액을 이용할 때, 생 산된 수정란의 수정율과 부화율이 신선정액의 성적에 미치지 못하기 때문이며, 닭 동결정액의 희석비율도 약 4배 정도 로 머무르고 있어 대량 생산이 힘들기 때문이다. 그러나, 닭 동결정액에 관한 연구는 악성질병의 위협에서 소중한 유전 자원을 멸실에서 보호하는 유일한 수단으로 알려져 있으며, 이는 원시생식세포와 함께 동결유전자원으로 가치가 높아 유전자원은행을 구축하는데 있어서 반드시 필요한 연구영역으로 알려져 있다(Blackburn et al., 2009; Blackburn, 2000; Blesbois, 2011; Seigneurin et al., 2013). 특히 닭의 경우, 소에 비하여 더 농후한 정자가 정상적인 수정란을 생산하는데 필요하다. 이는 가금의 동결정액 생산의 효율성을 낮추는 원인이 되고 있어, 희석배율을 높여 그 생산 효율을 높이는데 많은 투자와 연구가 필요하다(Sexton, 1981).
닭 정액을 평가하는 방법으로 가장 정확하고 빠른 방법은 컴퓨터를 활용하는 방법이다. 단위 시간 당, 정자가 이동하는 방향 및 거리 및 속도에 관한 지표를 설정하여 자동으로 측정한 자료를 자동으로 분석하는 소프트웨어가 존재한다. 이 는 “컴퓨터를 활용한 정자 분석: CASA(computer assisted sperm analysis)”라고 부르며, 자동으로 현미경의 영상을 디 지털 자료로 분석하므로 빠른 시간 안에 객관화 된 자료를 얻을 수 있다. 연구자의 시간과 노력이 절약되며, 정확도가 매우 높아 선호도가 높은 것으로 보고되었다(Farrel et al., 1998; King et al., 2000; Blesbois et al., 2008). 그러나, 형태적 으로 움직이는 닭 정자 두부의 중심을 정확히 인지하기 어렵고, 긴 편모에 의하여 죽은 정자일지라도 두부 자체가 살아 있는 정자의 움직임에 의하여 산 것처럼 움직일 수 있기 때문에 CASA에 의한 닭 정자 분석 자료는 세밀한 관찰과 보정 이 필요한 것으로 판단된다. 또한, 프로그램을 이용한 정자 분석은 적절하게 희석된 정자가 필요하며, 약 20~30 × 106 /mL 정도가 적절하다고 알려져 있다(Vantman, 1988). 닭의 경우, 정액 내 정자 농도가 평균 2~5 × 109 /mL 정도로 매우 높은 농도의 정액을 생산하므로 문제점을 야기할 수 있으며, 정액을 낮은 농도로 희석을 실시하면, 희석충격에 의하여 운동성이 낮아지며 정자가 죽는 현상이 있음이 보고되어 있다(Harrison et al., 1982).
닭 동결정액 생산에 있어 아직까지 융해 후 생존율에 대한 자료가 충분히 보고되어 있지 않다. 심지어, 닭 정자 생존성 이 낮더라도 수정율과 부화율에 대한 성적은 어느 정도 유지될 수 있음이 밝혀져 있고, 인공수정에 필요한 최소한의 정 자 수 또한 추정하기가 어렵다. 암탉은 매일 일정량의 정자를 암컷의 자성생식도관에서 이용해야 매일 배란되는 난자를 수정시킬 수 있다. 그러므로, 정확한 수정 적기와 양, 수정간격에 대한 자료를 정확하게 유추하기 힘든다. 특히 동물의 종류에 따라, 품종에 따라 동결정액의 융해온도 및 시간이 서로 다를 수 있는데, 연구자에 따라 그 선호도가 다른 것이 사실이다. 소와 개의 경우, 37℃에서 38℃의 온도에서 30초에서 1분간 융해하여 정자를 융해하며, 연구자마다 약간씩 다르게 보고하고 있어 다양한 방법을 통하여 융해하고 있음을 알 수 있다(Linde-Forsberg et al., 1999; Rastegarnia et al., 2013). 소와 돼지의 동결정액은 54℃에서 13초간 노출하여 융해하는 것이 더 우수한 보고가 있다(Senger, 1980). 개의 경우, 70℃에서 6∼8초간 노출하여 융해하는 것을 선호하는 경우가 존재한다(Kong et al., 1999; Rastegarnia et al., 2013). 그럼에도 불구하고, 닭의 경우, 대부분의 연구자는 저온 융해를 선호하는 경향이 있으며, 5℃에서 2~5분간 융해하는 것이 일반적인 것으로 알려져 있다(Sexton and Fewlass, 1978; Purdy et al., 2009). 저온 융해의 경우, 포유류 에서는 거의 사용하지 않는 방법으로 그 생리적 기작은 정확하게 알려져 있지 않으나, 닭 정액에 주로 사용되는 동결보 호제의 독성을 낮추기 위한 것으로 추정되고 있다. 또한, 닭 정액에 있어서 저온충격은 없는 것으로 알려져 있으며, 오 히려 높은 온도에서 정자의 대사 및 활력도가 급증하여 정액의 품질을 낮추는 것으로 판단된다. 그러므로, 닭 정액을 효 율적으로 동결하는 것도 중요한 연구목표이지만, 동결된 정액을 적절하게 융해하는 방법은 가금 유전자원을 효율적으 로 활용하고, 가금 동결정액을 평가하고 그 이용성을 증진하는데 중요한 연구 영역임에 틀림없다.
따라서 본 연구에서는 다양한 융해 조건에 따라 동결정액을 융해하여 닭 정자 운동성에 대한 분석을 실시하였으며, 닭 동결정액의 융해온도를 최적화하는 조건을 탐색하였다. 동결정액의 융해 조건에 대한 자료는 동결 정자를 활용하는데 있어서 반드시 필요한 연구 결과라고 판단된다. 가금의 계통을 보존하는 수단으로 동결정액은 이용될 수 있으며, 융해 방법은 동결정자의 활용성을 증진하는 기본자료로 활용될 수 있기에 닭 동결정액을 정립하는 방법에 관한 연구를 수행 하였다.
재료 및 방법
공시축은 국립축산과학원 가축유전자원센터에 사육 중인 오계(Ogye) 계통 수컷 20수를 사용하였다. 시험에 관련된 오 계의 사양관리 및 정액채취는 국립축산과학원 동물실험윤리위원회(승인번호 20180289)의 규정을 준수하여 시행하였 다.
모든 시약은 Sigma-Aldrich Chemical Co.(USA)의 한국 대리점을 통하여 구입하였으며, 정액의 희석액 제조에 이용된 물은 Irvine Scientific(Santa Ana, USA)에서 제조한 체외수정 클리닉 등급(Water for Assisted Reproductive Technology) 을 이용하였다. 닭 정액 분석을 위하여 희석제로 이용되는 BPSE-I(Beltsvile Poultry Semen Extender–I)는 potassium phosphate dibasic trihydrate 1.27 g, sodium L glutamate 0.867 g, D-fructose(anhydrous) 0.5 g, sodium acetate trihydrate 0.43 g, TES 0.195 g, potassium citrate 0.064 g, potassium phosphate monobasic 0.065 g 및 magnesium chloride anhydrous 0.034 g을 최종 부피가 100 mL가 되도록 세포배양용 초순수를 용해하여 제조하였다(Sexton and Fewlass, 1978). HS-1 희석액의 조성은 Hanzawa et al.(2010)에 의하여 제안된 방법으로 제조하였으며, sodium L glutamate 1.2 g, potassium acetate 0.3 g, D(+)-glucose 0.2 g D(+)-trehalose dihydrate 3.8 g, BES 0.5 g 및 Bis-TRIS 0.5 g을 세포 배양용 초순수에 용해하여 최종 부피가 100 mL가 되도록 제조하였다.
오계의 정액 채취는 횡취법을 이용하였으며, 신선정액을 눈금이 있는 15 mL 튜브에 옮겼다. 약 5~8 수의 오계에서 주 1~2회의 빈도로 채정하여 혼합된 정액을 이용하였으며, 5℃ 실험용 얼음에 담아 15분 이내에 실험실로 이송하였다. 동 일한 온도조건에서 동결보호제를 함유하지 않은, 정액과 동량의 HS-1 희석액을 신선정액에 점적하여 1차 희석을 실시 하였고(1:1 희석비율), 희석 후 20분간 평형시간을 가졌다. 희석된 정액은 2차 희석을 실시하였는데, 동일한 방법으로 MA 동결 보호제의 최종농도가 8%가 되도록 조정된 HS-1희석액으로 다시 희석하였다. 2차 희석이 끝난 정액은 평형시 간 없이 0.5 mL straw(FHK, Japan)에 충전하고, 끝부위를 초음파 밀봉기(Minitube, Germany)를 이용하여 밀봉하였다. 정액을 희석하는 작업 과정 동안, 정액과 희석제를 동일한 온도로 유지하기 위하여 5℃로 조정된 저온정액처리장치 (FHK, Japan) 안에서 희석, 충전 및 밀봉작업을 실시하였다. 희석 정액이 충전된 스트로는 액체질소 표면 위 4 cm에 30 분간 노출하여 예비동결을 실시하였고, 스트로를 액체 질소에 바로 침지하여 정액 동결 스트로를 제작하였다(Sasaki et al., 2010).
최소 21일에서 50일 이상 액체질소에 보존된 오계의 정액을 융해하여 실험에 공시하였다. 실험 1에서는 5℃ 저온수조 (FHK, Japan)에서 2분간 융해하는 방법, 37℃에서 30초 동안 융해하는 방법, 54℃에서 13초 동안 융해하는 방법 및 70℃에서 7초간 융해하는 방법을 조사하였다. FAF-BSA 1%(w/v)가 함유된 BPSE를 37℃로 가온하여 융해된 정액에 1:7에서 1:9 비율로 투입하여 재 희석하였고(Kim et al., 2017), 희석된 동결정액 10 µL를 동일한 온도로 가온한 Makler counting chamber에 점적하여 현미경의 대물렌즈로 관찰하면서 2분을 기다린 후, CASA를 이용하여 정자의 운동성을 분석하였다.
실험 2에서는 현장에서 융해할 경우를 가정하여 실험용 얼음을 이용하여 5℃ 저온수를 제조한 저온수를 이용하여 융해 하고, 알코올 20%를 첨가한 냉각수를 이용하여 융해하여 실험실 얼음에 정치하였으며, 대조군으로 실험 1의 저온수조 융해방법으로 융해한 정액을 이용하였다.
실험 3에서는 각각 37℃에서 30초로 융해하는 방법, 54℃에서 13초 융해하는 방법 및 70℃에서 7초간 융해하는 방법 을 이용하였고, 실험용 얼음이 아닌 37℃의 가온판 (Eppendorf Thermomixer C, Germany)에 바로 이동하여 온도를 유 지하면서 Makler counting chamber로 옮긴 후 2분 후 검사하였다. 이는 융해된 닭 정액에서 저온 충격에 의한 운동성 저하 현상이 나타나는지를 알아보기 위한 실험방법으로 실험 1과 차별성이 존재한다.
실험 4에서는 실험 1의 저온수조법과 실험 3의 54℃에 13초 융해법을 이용하여 정자를 융해하고, CASA 분석을 실시하 였고, 남은 정액은 17℃에서 30분 및 1시간 동안 보존한 후, 정자 운동성 다시 검사하여 장수성을 검사하였다.
CASA분석을 위하여 각 실험군에서 융해된 정자는 BPSE (1% FAF-BSA)로 20~30 × 106 /mL 농도로 희석하였다. 희석 후 37℃에서 2분간 정치한 후 분석을 실시하였고, 정자의 움직임은 Makler counting chamber를 이용하여 Nikon Eclipse C1 현미경과 연결된 CASA(ISAS, Poiser R & D, Paterna, Spain) 프로그램으로 관찰하였다. 각 시료에서 총 정 자수가 최소 600개 이상이 되도록 초당 25프레임의 자료를 Makler counting chamber의 최소 3위치 이상에서 얻어 닭 정자를 분석하였다. 닭 정액의 분석은 프로그램 제조사에서 추천하는 설정값으로 관찰하였으며, 인식하는 소적 크기 (particle size)는 10~80 µm2의 범위를 설정하여 curvilinear velocity(VCL), straight-line velocity(VSL), average path velocity(VAP), linearity(LIN, ratio of VSL/VCL), straightness(STR, VSL/VAP), beat-cross frequency(BCF), Wobble(WOB) 및 amplitude of lateral head displacement(ALH)에 대한 자료를 획득하였다.
결 과
닭 동결 정액을 저온 수조를 이용하여 5℃에서 융해하면 Fig. 1에서 제시된 바와 같이 68.4±0.9%의 운동성을 관찰할수 있었으나, 37℃에서 30초 동안 융해한 정액은 15.7±0.5%, 54℃에서 13초 동안 융해한 정액은 17.9±4.1%, 70℃에서 7 초 동안 융해한 정액은 14.5±2.1%로 관찰되어 그 유의적 차이가 존재하였다(P<0.05). 이때, 융해된 정액은 다시 실험실 얼음에 정치시켰으며, 동일한 온도로 냉장된 BPSE(1% FAF-BSA) 희석액으로 다시 희석하여 정자의 운동성을 판별하 였다.
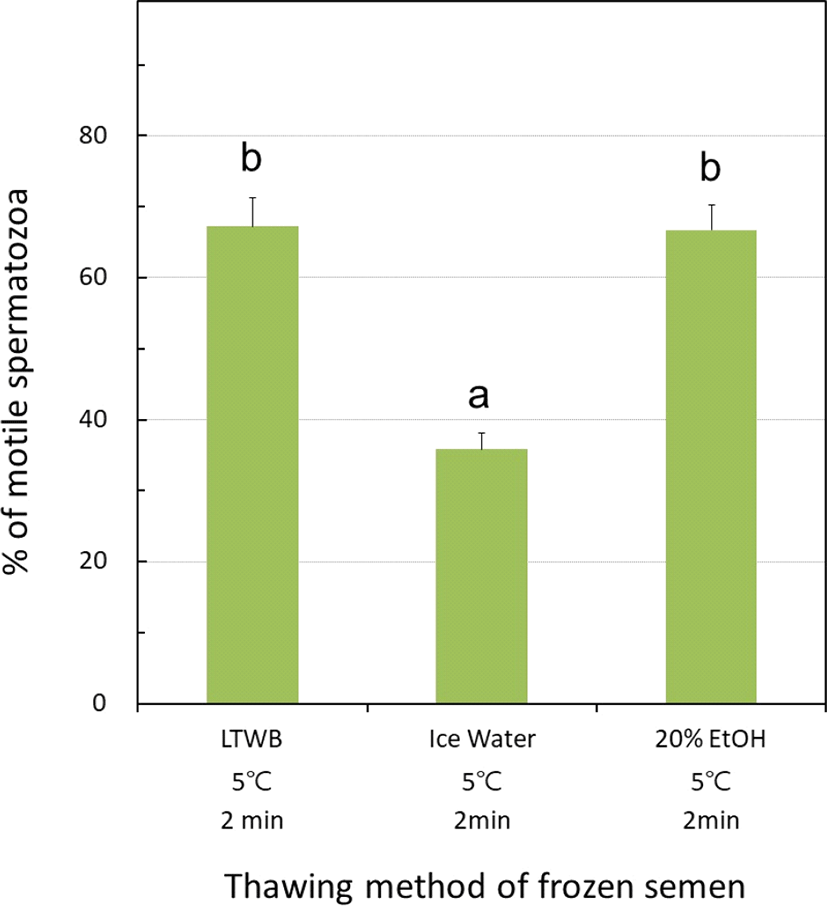
실험실에서 융해된 정자는 안정적인 저온수조를 이용하므로 변이가 없을 것으로 사료되나, 농장에서 직접 융해하여 닭 인공수정을 실시할 경우를 가정하여 실험실용 얼음을 적절하게 투입하여 5℃로 조절된 저온수를 준비하였다. 또한, 20% 에탄올이 함유된 저온수를 동일하게 준비하여 닭 동결정액을 융해하는데 이용하였고, 그 정자의 운동성을 관찰하 였다. Fig. 2에서 동일한 5℃ 조건에서 융해된 3가지의 정액에서 운동성을 관찰하였는데, 저온수조의 경우 정자의 운동 성은 67.3±4.1%로 관찰되었으며, 실험용 얼음을 이용한 저온수의 경우 35.8±2.3%로, 그리고 20% ethanol을 함유한 저 온수의 경우, 66.7±3.6%로 관찰되었다. 저온수조와 ethanol을 이용한 저온수의 경우, 융해된 정자의 운동성은 일반 저 온수의 것보다 유의적으로 높은 생존성을 나타내었다(P< 0.05).
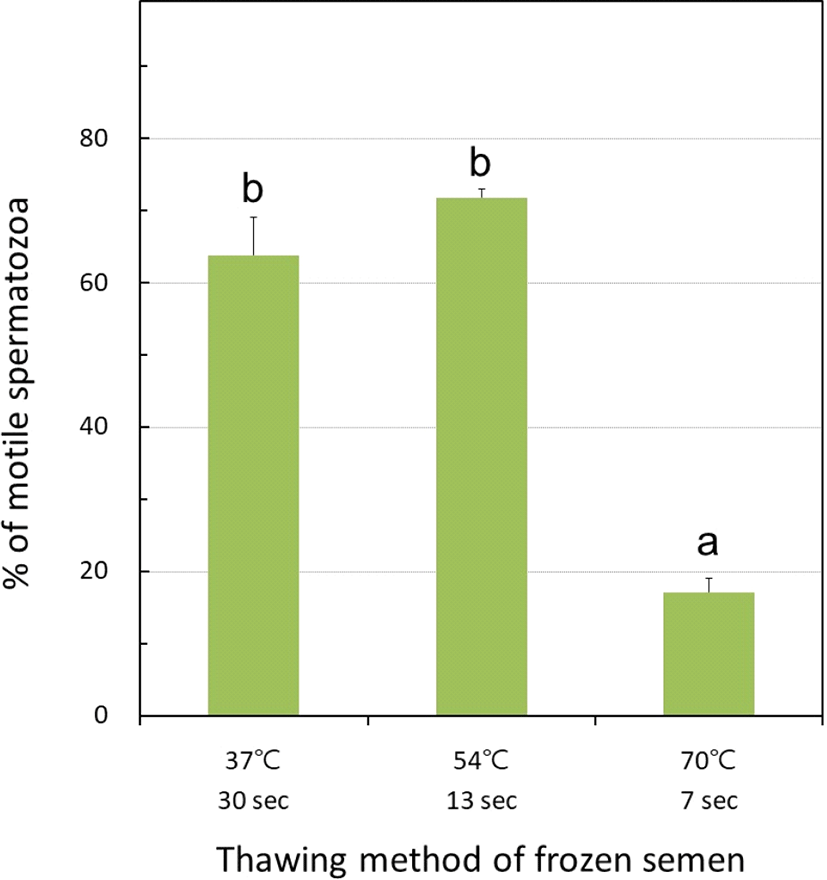
실험 1에서 관찰된 정액의 일부는 다시 실험용 얼음에 냉 각되기 때문에 저온충격 효과가 존재할 수 있다. 그러므로 실험 3에서는 그 효과를 조사하기 위하여 실험 1과 동일한 조 건으로 융해를 실시하고, 각 융해 정액을 37℃에서 일정시간 유지하는 조건으로 정액을 희석하여 운동성을 조사하였다. Fig. 3에서 제시된 바와 같이 37℃에서 30초간 융해한 동결 정액에서 닭 정액의 운동성은 63.8±5.3%로 관찰되었다. 54℃에서 13초 동안 융해한 정액에서 71.8±1.2%의 운동성을 관찰하였으며, 70℃에서 7초 동안 융해한 정액에서 17.2±1.9%의 운동성이 관찰되었다. 37℃와 54℃에서 융해된 정액의 정자운동성은 70℃에서 융해된 정자의 운동성보 다 유의적으로 우수한 것으로 판단되었다(P<0.05).
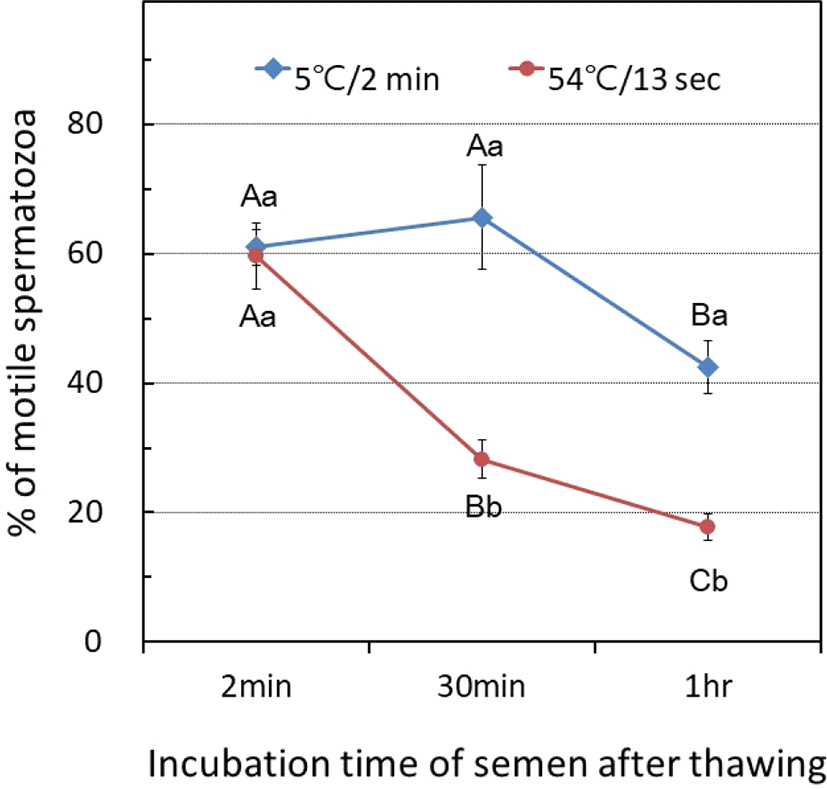
실험 1과 실험 3에서 높은 운동성을 보인 저온수조 5℃ 융해 조건과 54℃에서 13초간 융해하는 조건이 정자의 장수성 을 비교하기 위하여 1시간 동안, 30분의 간격으로 정자 운동성을 분석하였다. Fig. 4에서 제시된 바와 같이, 5℃에서 2 분간 융해한 정액은 61.0±2.8% 운동성을 나타내었으며, 30분 후 65.6±8.0%로, 1시간 후에는 42.5±4.1%로 변화하였다. 그러나, 54℃에서 13초간 융해된 닭 정자의 운동성은 59.6± 5.1%로 관찰되었고, 30분 후 28.3±3.0%로, 1시간 후에는 17.7±2.0%로 감소하였다. 5℃에서 2분간 융해한 정자의 운동성은 약 30분까지 변화가 없었으나, 1시간 후에는 유의적 으로 감소하였으며, 54℃에서 13초간 융해된 닭 정액의 생존성은 30분 이내에 유의적으로 감소하였다(P<0.05).
고 찰
최근 조류인플루엔자(avian influenza; AI)와 같은 악성질병의 창궐로 수많은 가금류는 위험에 처해 있으며, 이러한 질병 은 조류 집단 사망과 집단 도태를 야기하기 때문에 가금유전자원의 망실에 대한 위협이 점차 증대되고 있다. 이런 이유 로, 동결보존기술은 가금 종축을 안전하게 보존될 수 있는 유일한 기술이라고 판단된다. 그러므로, 가금 동결정액을 계 통 및 개체 별로 보존하는 것은 국가 자산을 안전하게 보호하고, 위기에 대응할 수 있는 동결전자원을 확보하는 수단으 로 그 중요성이 매우 높다.
닭 정액에 대한 동결기술개발에 대한 연구는 다른 가축보다 일찍이 먼저 수행되어 왔으나, 여전히 해결해야 할 문제점 들이 존재한다. 특히 동결보호제로서 glycerol은 닭에 있어서 불임을 유발하고, 인공 수정 후 수정란이 발생이 되지 않는 특이한 생리적 현상을 가지고 있다(Shaffner et al., 1941; Polge et al., 1949; Neville, 1971; Lake, 1986; Hammerstedt et al., 1992; Gill et al., 1996). 그러므로 닭 정자를 동결하는 방법은 글리세롤을 이용하지 않는 경향으로연구되고있으며, 운동성을 분석하는 것보다 정자의 생체 수정능력을 검증하고 정액의 품질을 판별하는데집중하고 있다. 그러므로 융해 에 대한 정확한 이해도가 떨어지고 있고, 비록 닭 정액을 높은 농도로 동결하더라도 융해과정에 있어 많은 소실이 발생 하면 활용도에 대한 우려가 높은 특성이 존재한다.
정확한 닭 정자의 운동성 분석을 위하여 흔히 이용되는CASA 분석방법에는 보통 세포수 측정용 슬라이드 또는 마클러 챔버(Makler’s counting chamber)를 주로 활용하는데, 이 때 도구의 특성상 정자의 농도는 약 20~30 × 106개의 정액이 필요하다고 밝혀졌다(Makler, 1980; Vantman, 1988). 그러나, 닭 동결 정액을 제조하기 위하여 매우 높은 농도 정액을 이용하고 유지해야만 하는 이유가 있는데, 닭에서 신선정액의 경우 50~100 × 106개 정자수가 1회 인공수정을 위하여 필요하며, 동결정액의 경우 최소 5∼7 × 108개 이상의 정액이 필요하다고 보고되었기 때문이다(Sexton, 1981; Lake, 1986). 그러므로 오계에서 두당 약 0.5~0.8 mL 부피의 정액을 채취하였고, 이를 실험군에 동일하게 활용하였다. 높은 농도의 닭 동결정액은 생존율이 조금만 낮아져도 운동성을 회복하지 못한 정자의 수가 급속도로 높아지는 특성이 존재 한다. 또한, 닭 동결정액의 융해 기법을 정립하는 것은 동결정액을 활용하는 효율을 증진시키고, 운동성이 높은 정자를 확보하여 수정율과 부화율을 증진시킬 수 있으므로 중요도가 높다.
본 연구에서는 이러한 융해에 관련된 자료를 확보하여 기존의 소, 돼지 및 개의 동결정액을 융해하는 방법과 비교하였 으며, 닭 동결정액을 융해할 때, 적절한 융해방법을 제공하여 정확한 동결정액 인공수정법을 확립하고자 연구를 수행하였다.
저온 융해법으로서 닭 동결정액은 많은 연구자들이 선호하는 방법이나, 열역학적 기작은 아직까지 잘 설명되어 있지 않 고 있으며, 경험적인 실험 결과물로서 닭에서만 이용되고 있다. 여기에는 저온에 대한 닭 정액의 생존능력이 소, 돼지 또는 말의 정액과 다르기 때문인 것으로 추정되며, 닭 정액에 있어서 저온충격에 대한 보고는 아직 없는 것으로 판단된 다. 닭 신선정액의 경우, 채취 직후에 실험용 얼음에 바로 노출하여도 오히려 생존 능력이 오래 유지되는 현상이 있는 것으로 보아, 닭 생리학적으로 특이한 현상으로 파악된다. 또한 닭 원정액은 오히려 낮은 농도로 희석할 때, 정자가 죽 어가는 현상을 관찰할 수 있어, 희석 충격이라는 표현을 사용하기도 한다. 동결을 위한 닭 정액의 적절한 희석의 농도는 4배에 머무르고 있으며, 이는 융해 후 CASA 분석을 실시하여 정확한 방법으로 희석하지 못하면 융해 후 생존성이 낮은 것으로 오판할 수 있는 가능성이 매우 높다. 본 연구에서는 기 보고된 바와 같이 비교적 높은 희석배율로 희석하기 위하 여 FAF-BSA를 사용하였으며, 이는 CASA 분석을 정확하게 할 수 있는 방법으로 판단된다.
가축유전자원센터의 농장에서 직접 동결정액을 융해 할 경우, 동결정액을 융해하는 액체가 과냉각되어 몇 개의 정액을 녹일때, 스트로 주위에 얼음 결정이 재형성되는 현상을 빈번하게 관찰하였다. 또한, 이러한 현상은 스트로로 열 전달을 적절하게 하지 못하는 주요 원인이 되며, 인공수정 이후 정자의 수정능력을 저하시키는 요인으로 의심되었다. 그러므 로, 현장에서 활용할 수 있는 정확한 융해 방법이 고안되어야 수정능력을 증진시킬 수 있을 것으로 추정되었다. 본 연구 에서는 동결정액을 융해하는 방법을 정립하고자 동결정액을 융해하는 다양한 온도 및 노출시간을 조사하였으며, 다른 연구자의 보고와 마찬가지로 5℃에서 2분간 융해하는 것이 가장 우수한 결과를 얻었다(Fig. 1). 또한 저온수조를 이용하 여 융해하는 방법이 가장 안정적임을 알 수 있었으며, 저온수보다 20% 알코올이 포함된 저온수에 융해아여야 정자의 생존율을 극대화 할 수 있었다(Fig. 2). 과 냉각된 저온수의 경우, 절반 가까이 정자 운동성이 저하될 수 있는데, 이러한 현상은 적절한 융해조건을 확립하기 위하여 저온수 온도 유지가 매우 중요하다는 것을 보여주고 있다. 닭 동결정액을 37℃와 54℃에서 융해하더라도 정액의 운동성에 비교적 높으나, 70℃에서 융해한 정자는 14~17%의 운동성을 나타내 어 인공수정에 이용하지 못한다는 결론에 도달하였다(Fig. 1 및 Fig. 3). 특히 54℃로 닭 동결정액을 융해할 경우, 저온 융해법과 비슷한 생존율을 보였으나, 정자의 생존성은 그 후 급격히 떨어짐을 관찰하였으며, 이는 본 연구에서 사용한 침투성 동결보호제의 독성에 의한 것으로 추정되었다(Fig. 4). 또한, 실험 1에서 융해 직후 실험용 얼음에 노출하여 온도 를 저하시켜 볼 때, 융해된 정자의 생존성은 급격히 나빠지는 것을 관찰하였으며, 이는 신선정자와 달리, 동결 및 융해 된 닭 정자는 저온 충격이 나타날 수 있음을 의미하고 있다.
적 요
본 연구에서는 닭 동결 정액의 융해 방법에 따라 정자 운동성의 변화도를 분석하였고, 적절한 융해방법에 대한 자료를 확보하였다. 동결정액을 융해하는 방법은 축종에 따라 서로 다른 열전달 효율을 제시하기도 하나, 닭 동결 정액에 대한 연구는 미진한 상태이다. 특히 닭 정액은 고 농도의 정액을 필요하기 때문에 이러한 요인에 대한 정자 운동성은 변이가 많은 것으로 알려져 있다. 그러므로, 닭 정액 융해에 필요한 온도는 5℃임을 알 수 있었으며, 닭 농장에서 동결정액의 융해를 실시할 때, 알코올이 함유된 냉각수를 이용하게 되면 냉각수의 과냉각 생태를 방지할 수 있음을 관찰하였다. 또 한, 동결정액을 이용한 인공수정을 실시할 때, 현장에서 직접 닭 정액을 융해하여 시간을 절약할 수 있으며, 인공 수정 작업시간이 30분을 넘기게 되면 정자의 운동성은 감소하여 수정율에 영향을 미치는 것으로 판단된다. 그러므로, 농가 에서 동결정액을 활용할 경우, 융해에 신경을 써야하며 정확한 방법을 적용하여야 수정란의 부화율 감소현상을 막을 수 있을 것으로 보인다. 이와 같이 본 연구에서 제시된 방법으로 동결정액을 이용할 때, 동결정액의 수정율이나 부화율의 변이를 막을 수 있고, 동결 정액을 활용한 가금 종축생산 효율이 높아질 것으로 판단된다.








