서 론
아연(Zn)은 체 조직에서 300여 종이 넘는 효소들과 단백질(metalloenzyme) 작용에 관여하는 필수 미량광물질로서, 이들 생체 단백질의 구조 또는 촉매 역할로서 가축의 성장 및 대사 작용에 중요한 기능을 한다(Prasad, 2014). 육계에서 아연 요구량은 40(NRC, 1994)∼50 ppm(Korea Feeding Standard for Poultry, 2017) 수준으로 곡류사료에는 아연이 부족하기 때문에 ZnO 또는 ZnSO4 등으로서 보충 급여하고 있다(Huang et al., 2007). 그러나 닭에서 밀사, 감염, 폭염 등과 같은 심각한 스트레스 상황에서 120∼150 ppm 수준 이상으로 아연 급여 시 질병을 억제할 수 있다는 연구들이 보고(Abd El-Wahab et al., 2013; Navidshad et al., 2016)되면서 아연의 보충급여에 대한 관심이 매우 높다.
현재 가축에서 아연의 급여 수준에 대한 연구와 함께 생체 이용효율이 높은 아연 화합물에 대한 체내 생리적 기능을 활성화 시키는 연구가 진행되고 있다(Liu et al., 2015). 특히 Zn-methionine과 같은 유기태 아연은 소장에서 흡수율이 증가되고 항산화 방어 작용과 같은 생리적 기능을 활성화하는 것으로 보고되고 있다(Bun et al., 2011; He et al., 2019). 아연은 활성산소(Reactive oxygen species; ROS)로부터 DNA 손상을 방지하고, 세포분화 및 세포자살 과정에서 세포를 보호하는 항산화 기전을 담당하는 것으로 알려져 있다(Song et al., 2009). ROS는 체내 대사과정에서 생성되어 건강한 가축에서는 체 조직의 항산화 방어 시스템에 의해 적절하게 제거되어 심각한 문제를 초래하지는 않는다. 그러나 과도한 ROS가 생성되거나, 빨리 제거되지 못하면 조직의 지질과산화에 따른 산화 스트레스로 가축의 생산성 저하를 초래하게 된다(Yang et al., 2017). 지금까지 연구에 의하면 아연 결핍 시 체 조직에서 ROS에 의한 산화 스트레스가 증가하여 DNA 손상을 유발 또는 DNA 원상복구에 관련된 반응과정에 문제가 발생된다고 알려져 있다(Alam and Kelleher, 2012; Prasad, 2014). 특히 아연이 함유된 Cu/Zn superoxide dismutase(SOD)는 체 조직에서 항산화 방어 작용에 가장 중요한 역할을 수행하고 있다(Liochev and Fridovich, 2000). Bun et al.(2011)은 육계에게 기초사료(29.6 ppm)에 유기태 아연을 농도 별(20, 40 및 60 ppm)로 첨가 급여한 결과, 생산성은 차이가 없었지만 간 조직에서 SOD 활성도가 증가하고, 지질과산화도가 감소하여 아연이 닭에서 산화 스트레스를 감소시킨다고 보고하였다. 이러한 작용은 Zn의 보충급여가 체 조직에서 항산화 효소의 활성도를 증가시켜 과도하게 생성된 ROS를 제거시켜 지질과산화도가 감소된 결과로 해석된다(Zhou et al., 2005).
한편, 아연의 흡수는 소장 흡수세포에 존재하는 여러 종류의 아연 운반단백질(Zinc transporters; ZnT)에 의해 조절된다고 보고되었다(Nishito and Kambe, 2018). 소장 흡수세포에서 흡수된 아연은 원형질 액에서 metallothionein(MT)과 함께 결합하여 간으로 이동되거나 또는 소포체에 저장된다(Nishito and Kambe, 2018). Zn 결합 MT는 간, 췌장, 소장 등 여러 장기에 존재하는 아연 수용체로서 thiol 기(SH group) 단백질이다(Hamer, 1986; Kimura and Kambe, 2016). 아연이 함유된 MT는 ROS로부터 세포 방어기능 작용도 가진다고 알려져 있다(Tupe et al., 2010). 아연은 MT와 Cu/ZnSOD 합성에 관여하며, 적정 수준의 아연 급여는 이들 항산화 작용에 관여하는 단백질 합성을 촉진시켜 체 조직의 항상성 기능을 증진한다(Cabre et al., 2001).
따라서 본 연구는 아연의 보충급여가 한국 재래닭의 체내 항상성 유지에 미치는 영향을 조사하기 위하여 기초사료(100 ppm)에 50 ppm의 산화아연 또는 Zn-methionine을 각각 급여하여 혈액, 소장 점막세포와 간 조직에서 항산화 지표 및 아연의 운반에 관련된 유전자 발현에 미치는 영향을 조사하였다.
재료 및 방법
본 연구의 동물실험은 대학의 동물실험윤리위원회(IACUC)의 허가를 받아 실시되었다. 공시동물은 4주령 수컷 한국 재래닭(평균 개시 체중, 251.83±4.50 g) 144수를 대조군(CON), 무기태 아연(ZnO, 50 ppm) 급여군 및 유기태 아연(Znmethionine, 50 ppm) 급여군(ZnM) 등 총 3개군에 군별 6개 반복(케이지)을 두고, 케이지당 8수로 완전임의 배치하였다. 사료에 첨가한 아연제제는 산화아연(ZnO) 또는 Zn-methionine (®Zn-120, Avalia, Zinpro Corp, USA)으로서 기초사료(100 ppm, 산화아연)에 각각 50 ppm씩 배합하여 4주간 시험사료를 급여하였다.
시험사료는 한국가금사양표준(2007년)의 산란계 육성기의 사양표준에 따라 제조된 상업용 어린 병아리 사료를 사용하였다. 시험용 기초사료는 옥수수, 대두박 위주로 배합한 것으로 사료의 영양소 수준은 Table 1에 제시한 바와 같으며, 실제 아연 함량 91 ppm 수준으로 분석되었다. 사양관리로서 사료는 자유급이하고, 자동 급수기로 음수를 공급하였다. 점등 관리는 부화 후 종야 점등을 실시하고, 시험개시 후 종료까지 자연일조에 따라 실시되었다. 각 케이지의 닭의 사육밀도는 농림축산식품부의 고시(제2015-167호)에 따라 0.046 m2/수를 준수하고, 계사의 환경온도는 23∼25℃를 유 지하였다.
| Items | Nutrient composition |
|---|---|
| ME (Mcal/kg) | 2,890 |
| Crude protein (%) | 19.14 |
| Crude fat (%) | 3.70 |
| Crude fiber (%) | 3.08 |
| Lysine (%) | 1.06 |
| Ca (%) | 1.14 |
| P (%) | 0.57 |
| Zn1 (ppm) | 91 ppm |
4주간의 사양시험이 종료된 후, 각 처리군당 6개 케이지에서 각 케이지당 평균체중에 가까운 1수(n=6)를 선발하였다. 선발된 닭을 8시간 절식을 실시하고, 체중 측정 후 경정맥을 통해 채취한 혈액을 sodium heparin 코팅 시험관에 보관하였다. 혈액학적 지표 분석을 위해 3,000 rpm에서 20분간 원심 분리한 혈장을 —70℃에 냉동 보관하였다. 이어서 복강 절개 후 간장과 소장의 맹낭부위(십이지장 및 공장)까지 절단하여 채취하였다. 소장 점막세포를 분리하기 위하여 소장을 절개하여 생리식염수로 3회 연속으로 세척한 후 내용물을 제거하고 grass slide로서 점막세포를 분리하였다. 연속적으로 일정량의 생리식염수를 혼합하여 5,000 rpm(4℃, 10분)에서 원심분리(Vision, VS-15,000 CF, Korea) 후 점막세포를 세척하였다. 소장과 간 조직은 항산화 효소활성도 및 아연운반체 mRNA 발현 분석을 위해 —70℃에 냉동 보관하였다.
혈중 항산화력 지표인 total protein, albumin, blood urea nitrogen(BUN) 및 uric acid 등과 같은 질소화합물 함량은 자동혈액생화학분석기(Mindray, BS-120, Mindry Bio Medical Electronics Co., Shnzhen, China)로 분석하였다. 혈액의 total antioxidant status(TAS)는 Randox kit(NX 2332, Randox Lab, Antrim, UK)를 사용하여 분광광도계(600 nm)로서 흡광도를 측정하여 항산화력을 분석하였다. 방법을 간단히 기술하면 혈장과 chromogen 용액을 1:50 비율로 혼합하여 600 nm에서 최초 흡광도를 측정한다. 다시 일정량의 기질을 혼합하여 배양한 후, 다시 600 nm에서 흡광도를 측정하여 최초 흡광도의 차이를 표준용액과 비교하여 TAS 농도로 계산하였다.
소장점막과 간 조직의 cytosol과 microsome 분획은 Kupfer와 Levin(1972) 방법에 따라 실시되었다. 간단히 기술하면 조직 1 g 당 5 mL의 0.25 M sucrose 용액(0.25 M, sucrose, 0.005 M MgCl2, 0.025 M KCl 및 0.008 M CaCl2 pH 7.4)을 첨가하여 균질기(Omni tissue homogenizer, Omni Int. NW, USA)로서 균질화하였다. 상층액을 완충용액(0.0125 M sucrose, 0.005 M MgCl2 및 0.008 M CaCl2)으로 희석한 다음, 10,000 rpm에서 15분간 원심분리 하였다. 분리된 상청액을 cytosol, 펠렛을 1 mL의 1.15% KCl 용액에 균질화하여 microsome으로 분획하여 —70℃에 냉동 보관하였다. 각 조직의 cytosol에서 superoxide dismutase(SOD) 활성도는 sigma ki(Sigma assay kit 19160, Sigma-Aldrich, St. Louis, MO, USA)로서 측정하였다. 효소 활성도 측정은 xanthine oxidase를 혼합한 시료를 첨가한 후, 반응을 시작하여 ELISA reader(450 nm, VMax, Molecular Devices, CA, USA)에서 흡광도 값을 측정하였다. 그 외 상세한 방법은 kit에 제시한 방법에 따라 분석을 실시하였다. 단위 값은 샘플에 존재하는 효소가 SOD의 활성도를 50% 저해하는 값을 1 unit로 정의하였다. Glutathione peroxidase(GPX) 활성도는 Tappel et al. (1978)의 방법으로 반응조건은 시료에 반응용액(0.1 mM NADPH, glutathione reductase 1 unit/mL, reduced glutathione, 0.25 mM; pH 7.4)을 가한 후 5분간 37℃ incubator에서 배양시킨 다음, H2O2를 가하여 340 nm에서 흡광도의 감소 속도를 조사하였다. GPX 활성도의 unit는 mg protein당 1분 동안 산화되는 NADPH nM 수로 정의하였다. Glutathione S-transferase(GST) 측정은 Habig et al.(1974)의 방법으로 반응조건은 1 mM reduced glutathione을 chlorodinitrobenzene(CDNB) 혼합물에 희석한 시료를 가한 후, 340 nm에서 흡광도가 변화되는 비율을 측정하였으며, 1 unit는 mg protein당 1분간 반응하는 CDNB의 μM 수로 표시하였다. Microsome의 지질과산화도는 thiobarbituric acid 방법에 의해 생성된 malondialdehyde(MDA)량을 분광광도계로서 흡광도(532 nm)를 측정하여 조사하였다(Bidlack and Tappel, 1973). 효소의 특이적 활성도(specific activity)는 전체 활성도에서 단백질 mg당 농도로 나누어 표시하였다. 각 조직의 단백질 분석은 BCA 방법(Pierce Biotechnology, Rockford, IL, USA)으로 560 nm에서 ELISA reader로서 측정하였다.
소장 및 간 조직의 아연운반체(ZnT-1 및 ZnT-5) 및 metallothionein(MT)의 mRNA 발현은 다음과 같이 분석하였다. 소장과 간 조직에서 total RNA 추출은 HiGene Total RNA Prep Kit(Biofact, Cat. No. RP101-050, Daejeon, Korea)을 사용하였다. 간단히 기술하면 액체질소에 균질화한 30 mg 조직에 350 μL RB 용액과 5 uL protein K(10 ng/mL)을 넣고 혼합 후 56℃에 10분간 저장하였다. 혼합액을 14,000 rpm(4℃)에서 3분간 원심분리하고 얻은 상청액을 tube에 옮기고 추출한 용액을 100% 에탄올에 침전시켜 14,000 rpm(4℃)에 30초 원심분리 하였다. 이어서 column에 RNA 세척용액 500 μL를 넣고 14,000 rpm(4℃)에 2회 원심과정을 반복하였다. Column에 침전된 추출물을 50 uL RNAease free water에 용출시키고, total RNA는 분광광도계(Gene Quant pro, Amersham, NJ, USA)로서 260/230 nm에서 정량하였다. cDNA 합성은 1 μg의 total RNA와 1.0 mg oligo dT(Promega Co., Wisconsin, USA)를 70℃에서 5분, 4℃에서 5분 동안 역전사(reverse transcription) 과정으로 실시하였다. 5× first strand buffer, 2.5 mM dNTP, 0.1 M DTT, superscript III 및 RT-혼합액의 반응액은 42℃에서 50분, 90℃에서 10분, 42℃에서 50분간 연쇄반응하였다. mRNA 발현량은 SYBR green supermix(Bio-Rad, CA, USA)을 이용하여 real-time quantitative PCR(Bio-Rad, MyiQ™, CA, USA)로서 분석하였다. 분석한 ZnT-1, ZnT-5 및 MT 등의 primer는 Table 2에 제시하였으며, 각 유전자의 발현은 β-actin에 대한 상대적 발현량을 Livak & Schmittgen(2001) 방법에 따라 ΔCt 및 2—ΔΔCt 값으로 계산하였다.
아연 급여원에 따른 항산화 지표 및 아연운반 유전자 mRNA 발현에 미치는 영향은 SAS package program(SAS, 1996)을 이용하여 General Linear Model(GLM) 절차에 따라 유의성을 검정하였다. 95% 수준에서 유의적 차이가 인정될 때 Tukey 방법에 의한 다중검정으로 처리 간 유의성 분석을 실시하였다.
결과 및 고찰
산화아연(ZnO) 또는 Zn-methionine을 4주령 재래닭에게 4주 동안 보충 급여한 후 분석한 혈액의 항산화 지표는 Table 3에 나타내었다. 혈액 생화학적 지표에서 total protein, albumin, blood urea nitrogen(BUN) 등과 같은 질소화합물은 처리군 간 뚜렷한 차이가 없었다. 항산화 물질로 알려진 요산(uric acid)은 Zn-methionine 급여군에서 가장 높게 나타났으며, ZnO 급여군보다 유의하게(P<0.05) 증가하였다. 그러나 혈액의 총 항산화능(TAS)과 지질과산화도(MDA)는 아연의 급여 및 급여원에 따른 차이는 없었다.
혈액에서 항산화제 방어작용은 복잡한 상호작용 시스템으로 총 항산화력은 알부민과 요산이 혈청 항산화력의 70% 이상을 차지한다고 보고되었다(Park and Kweon, 2013). 알부민은 혈액에서 지방산 운반기능에 관여하는 단백질로서 효율성은 낮은 항산화 물질이나 함량이 높아 혈장의 총 항산화력에서는 중요한 역할을 담당한다(Wayner et al., 1987). 알부민의 항산화 방어능력은 특히 구리이온 의존성 지질 과산화작용과 수산화기 형성을 억제하는 기능을 가지고 있다고 알려져 있다(Halliwell and Gutteridge, 1990). 요산은 hydroxyl radicals과 반응하는 항산화제로서 혈액에서 bilirubin, 비타민 A 및 E와 같은 다른 항산화물에 비해 상대적으로 높은 농도로 존재하므로 중요한 위치를 차지한다(Wayner et al., 1987). 따라서 본 연구결과, 요산이 Znmethionine 급여군에서 가장 높게 나타나 혈액의 총 항산화능 증가에 긍정적인 영향을 미칠 수 있을 것으로 생각된다.
체 조직에서 아연은 산화제인 철, 구리 이온들과 경쟁적으로 세포막과 결합하는 특징(길항작용)으로 free radical 생성을 억제하는 직접적인 항산화제 역할을 한다(Tate et al., 1999). 또한, 아연은 NADPH oxidase 억제제로 작용하여 활성산소를 감소시키는 것으로도 보고되었다(Prasad, 2014). Yang et al.(2017)은 육계에서 Zn 함유 palygorskite를 기초사료(80 ppm)에 20, 40, 60 및 80 ppm를 3주간 보충 급여한 결과, 아연급여량에 비례적으로 혈청 지질과산화도는 감소되었으나, SOD 활성도는 차이가 없었다고 보고하였다. 그러나 본 시험에서는 아연의 보충급여에 따른 TAS 및 지질과산화도 수준은 모든 처리군에서 비슷한 수준을 보였다. 따라서 혈액 생화학적 항산화 지표 성분을 조사한 결과를 종합하면 50 ppm의 아연 보충급여는 혈중 uric acid을 제외하고, 다른 항산화 지표에는 뚜렷한 영향을 미치지 않는 것으로 나타났다.
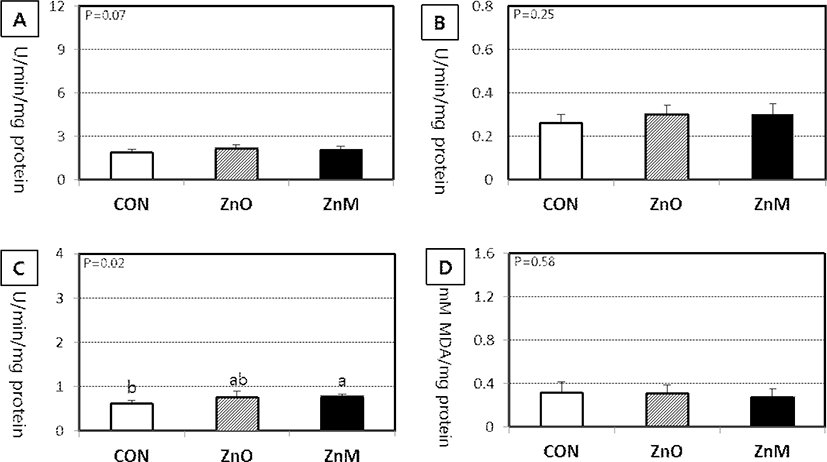
산화아연 또는 Zn-methionine을 급여 후, 소장 및 간 조직에서 항산화 효소 활성도 및 지질과산화도에 미치는 결과는 Fig. 1과 2에 각각 나타내었다. 먼저 아연보충급여에 따라 소장 점막세포에서 SOD 활성도는 증가되는 경향을 보였으나(P=0.07), SOD와 GPX 활성도 및 지질과산화도(MDA) 모두 통계적으로 유의한 차이가 없었다(Fig. 1). 그러나 소장 점막세포의 GST 활성도는 아연 보충급여에 따라 증가되는 것으로, 특히 ZnM 급여군에서 대조군에 비해 유의하게(P<0.05) 높았다.
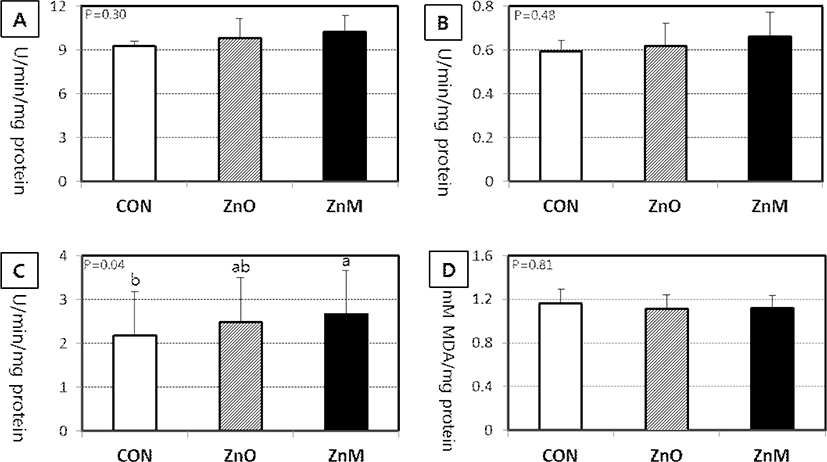
간 조직에서도 SOD와 GPX 활성도는 산화아연 또는 Zn-methionine 50 ppm 보충급여에 따른 영향을 받지 않았다. 항산화 기능과 이물질 대사기능을 동시에 가지는 GST 활성도는 Zn-methionine 급여에 따라 대조군에 비해 활성도가 현저히(P<0.05) 증가하는 것으로 나타났다(Fig. 2). 그러나 간 조직의 지질과산화도(MDA)는 모든 처리군에서 비슷한 수준을 보여 아연의 보충급여가 정상적인 지질 막에는 유의한 영향을 미치지 않는 것으로 나타났다.
가축에서 과도한 산화적 스트레스가 발생될 경우, 효소학적 및 비 효소학적 항산화 방어체계로 활성산소를 제거하여 체내 항상성을 유지한다(Espinosa-Diez et al., 2015). 효소학적 방어작용에 관여하는 것들은 SOD, GPX, GST와 catalase 등이며, 비효소학적 항산화 물질은 체내에 존재하는 thiol 단백질(환원형 glutathione, MT 등), 비타민 C, E 등과 같은 것들이다(Surai, 2003). 특히 아연이 함유된 Cu/Zn SOD는 조직의 세포에 널리 분포하는 항산화 효소로서 O2—를 H2O2로 전환하여 지질과산화를 방지하는 가장 중요한 효소이다(Liochev and Fridovich, 2000). GPX는 H2O2를 H2O로 전환하는 효소로서 원형질액에 존재하며 지질과산화물의 독성을 제거하는 역할을 한다(Tappel et al., 1978). GST는 비극성 독성물질과 결합하여 중화하는 해독작용과 산화 스트레스에 의해 발생한 대사산물을 제거하는 항산화 역할을 동시에 한다(Hayes et al., 2005).
지금까지 Zn 급여수준과 급여원에 따른 체 조직의 항산화 작용에 관련된 다양한 연구결과들이 발표되었다. Liu et al.(2015)은 육계에서 기초사료(0 ppm)에 아연의 수준(60, 120 및 180 ppm) 및 급여원(ZnSO4 및 Zn-amino acid)에 따른 연구를 실시한 결과, 간 조직에서 SOD 활성도는 아연 급여수준 또는 아연급여원에 따른 차이는 없음을 보고하여 본 연구에서 관찰한 결과와 유사하였다. 또한, 간 조직의 지질과산화도 역시 아연 무급여군을 제외하고, 60 ppm 이상 급여군에서 모두 비슷한 수준을 보여 아연의 요구량 수준이상에서는 산화스트레스에 현저한 영향을 미치지 않았다고 보고하였다(Liu et al., 2015). 또한 본 연구의 결과와 유사하게 Bun et al.(2011)도 육계에서 기초사료(29.6 ppm)에 유기태 Zn을 농도 별(0, 20, 40 및 60 ppm)로 보충급여한 결과, 간 조직에서 지질과산화도와 catalase 활성도는 모든 처리군에서 차이가 없었으며, SOD 활성도는 아연 20 ppm 이상 급여군들 간에는 비슷한 수준의 활성도를 보였다.
그러나 Zhao et al.(2014)은 열 스트레스 사육조건에서 육계의 기초 사료(60 ppm, ZnO)에 아연 나노입자를 수준(20, 60 및 100 ppm)별로 급여한 결과, 60 및 100 ppm의 아연 나노입자 급여군에서 간 조직의 SOD 활성도가 현저히 증가하여 아연 급여원 및 수준이 항산화력에 유의한 영향을 미친다고 하였다. 또한, Bun et al.(2011)도 육계에게 콕시듐 감염 시 아연의 보충급여는 항산화 효소의 활성도를 증가시키고 콕시듐 낭포체(oocyst) 배설을 감소시킨다고 보고하였다. Rao et al.(2016)은 열대지방의 여름 동안 육계에게 40 ppm의 유기태 아연을 급여한 결과, 혈액의 SOD 활성도가 현저히 증가되고, 지질과산화도는 감소되는 것으로 보고하였다.
한편, 본 연구에서는 Zn-methionine 급여에 따라 소장 및 간 조직에서 GST 활성도가 현저히 증가되었는바, 이는 아연의 보충급여가 이물질 대사기능을 촉진시킬 수 있는 가능성을 제시한다. 아연에 대한 연구는 주로 항산화작용 기능에 초점이 맞추어 진행되었는데, Mansour et al.(2017)이 살충제 노출된 랫드에서 아연을 급여할 경우 독성에 의해 저해된 GST 등과 같은 항산화 효소와 지질과산화도를 정상수준으로 회복시켰다고 보고하였다. 또한 중독광물질에 의해 간 독성이 유발된 랫드에서 아연을 급여할 경우 지질과산화도를 감소시키고, GST 활성도를 정성 수준으로 회복시키는 것으로 보고하여(Jamakala and Rani, 2015) 아연이 간 독성물질로부터 체 조직을 방어하는 기능이 있음을 제시하였다.
이상의 결과에서 정상적인 사육조건에서는 닭에서 요구량 수준(40 ppm) 이상의 아연을 급여할 경우, SOD 등과 같은 항산화 효소의 발현에는 영향을 미치지 않았지만, 독성물질과 결합하여 중화하는 해독작용과 산화 스트레스에 의해 발생한 대사산물을 배설하는 GST 활성도는 증가시키는 것으로 나타나, 이에 대한 추가연구가 필요하리라 생각된다.
산화아연 또는 Zn-methionine을 급여 후, 소장 및 간 조직에서 아연 운반체(ZnT-1, ZnT-5) 및 MT의 mRNA 발현량을 조사한 결과는 Table 4과 5에 각각 나타내었다. 소장 흡수세포에서 아연 운반단백질 ZnT-1(8.62배, P=0.09) 및 ZnT-5 (7.3배, P=0.06) mRNA 발현은 Zn-methionine 급여군에서 대조군에 비해 증가되는 경향은 뚜렷하였으나, 통계적 차이는 인정되지 않았다. 소장 흡수세포의 MT mRNA 발현은 처리군간 차이가 없었다(Table 4). 간 조직에서 아연수송(ZnT-1, ZnT-5) 및 MT mRNA 발현은 아연 급여에 따른 유의적 차이가 인정되지 않았지만, ZnO군(2.47 배)과 ZnM군(4.12배)에서 대조군에 비해 MT의 mRNA 발현이 증가되는 경향(P=0.10)을 보였다(Table 5).
아연은 동물의 소장 흡수세포의 운반체를 통해 흡수되어 소장, 간 등으로 이동되어 SOD, MT 등과 같은 다양한 아연 함유 단백질의 발현에 영향을 미치는 것으로 보고되었다(Kimura and Kambe, 2016). 따라서 본 연구에서는 소장과 간 조직에서 아연운반체(ZnT-1 및 ZnT-5) 및 MT의 mRNA 발현을 조사하였다. 사료내 아연의 흡수는 소장 점막세포의 Zn 운반체(ZnT-1, ZnT-5 등)와 연관 단백질(ZIP)과 같은 2 종류의 아연 운반 단백질들에 의해 조절된다(Nishito and Kambe, 2018). ZnT-1은 소장세포에서 아연을 장막을 통해 혈액으로 운반하는 역할을 하며 사료의 아연의 수준에 의해 영향을 받는다고 알려져 있다(McMahon and Cousins, 1998; Yu et al., 2008). 또한 ZnT-5도 소장 흡수세포에서 아연의 흡수에 중요한 역할을 한다(Cragg et al., 2005). 흡수된 아연은 소장 점막세포 원형질액에서 MT 단백질과 함께 결합하여 간으로 이동되거나 소포체에 저장된다(Nishito and Kambe, 2018). MT는 소장, 간 등 여러 장기에 존재하는 아연 수용체로서 시스테인 함량이 23∼33%인 thiol성 단백질로 활성산소로부터 세포를 방어하는 기능과 아연의 저장고(Pool) 역할을 동시에 한다(Hamer, 1986; Ruttkay-Nedecky et al., 2013).
Tang et al.(2015)의 연구에 의하면, 기초사료에 ZnSO4 또는 Zn zeolite clinoptilolite(Zn-ZCP)를 80 ppm 수준으로 급여 시 소장의 ZnT-1, ZnT-2 및 ZnT-5와 MT 단백질 mRNA 수준은 아연의 급여원에 따라 이들 유전자가 다르게 발현될 수 있음을 보고하였다. Wang et al.(2019)은 육계에게 80 ppm 수준의 아연을 급여 시 Zinc pectin oligosaccharides 킬레이트 함량에 비례하여 간에서 MT 및 ZnT-1의 mRNA 발현이 증가하였다고 보고하였다. 또한 Li et al.(2015)은 산란계에서 기초사료(80 ppm, ZnSO4) 급여군에 비해 아연 함유 zeolite clinoptilolite를 40.25 ppm과 80.5 ppm을 급여 시 공장에서 ZnT-1과 MT의 mRNA 발현이 현저히 증가되는 것으로 보고하였다. 이들 연구와는 상이하게 He et al.(2019)은 아연 급여원으로 90 ppm의 ZnSO4을 콕시듐 감염 육계에게 급여 시 공장의 ZnT-5는 증가되었으나, 유기태 아연급여 시에는 오히려 ZnT-1 발현은 감소되었다고 보고하였다. Liu et al.(2015)이 육계에서 Zn 급여원(무기태 vs. 유기태)과 급여량(0, 60, 120 및 180 ppm)에 따른 MT mRNA 발현은 0 ppm 급여군에서 현저히 낮았지만, 60 ppm 이상에서는 차이가 없었다고 보고하였다. 본 실험에서도 100 ppm 아연이 함유된 기초사료에 50 ppm의 보충급여 시 소장에서 아연 운반단백질(ZnT-1 및 ZnT-5)과 간에서 MT mRNA 발현이 증가되는 경향을 보였으나 유의적 차이는 인정되지 않았다. 이와 같이 Zn 급여 수준과 급여원이 체 조직에서 아연운반 유전자 발현에 미치는 영향에 관한 연구 결과들을 살펴보면, 닭에서 Zn 결핍은 항산화력과 아연 운반체 관련 단백질 발현을 저하시켜 체내 항상성을 저하시키는 것으로 보이나, 적정 요구량 수준이상의 아연 급여 시 이들 지표는 여러 가지 요인에 의해 영향을 받는 것으로 보인다.
결론적으로 한국 재래닭에서 Zn-methionine 보충 급여는 소장 또는 간 조직에서 아연 운반체 및 저장 단백질 발현을 증가시킬 수 있는 가능성을 제시하며, 항산화 방어작용에 긍정적인 영향을 미칠 수 있을 것으로 판단된다. 그러나 아연의 보충 급여수준에 따른 아연 운반단백질 발현과 항산화 방어작용에 관한 연구는 다양한 사육환경요인에 영향을 받는 것으로 향후 지속적인 추가 연구가 요구된다.
적 요
본 연구는 한국 재래닭에서 Zn 보충제 급여가 체내 항산화 지표 및 아연운반체 발현에 미치는 영향을 조사하기 위하여 기초사료(100 ppm, 대조군)에 산화아연(ZnO) 또는 Zn-methionine(ZnM)을 각각 50 ppm을 첨가하여 모두 3개군으로 설정하여 4주간 사양시험을 실시하였다. 혈중 total protein, albumin, blood urea nitrogen과 같은 질소화합물은 처리군들 간 차이가 없었으나, uric acid는 ZnM군에서 ZnO군보다 유의하게(P<0.05) 증가되었다. 혈액의 총 항산화능과 지질과산화도에서는 아연의 급여원에 따른 차이는 없었다. 소장에서 항산화 효소 활성도 및 지질과산화도를 조사한 결과, superoxide dismutase(SOD), glutathione peroxidase(GPX) 및 지질과산화도는 아연의 보충급여 및 급여원에 따른 차이는 없었으나, glutathione S-transferase (GST) 활성도는 ZnM군에서 대조군에 비해 현저히(P<0.05) 증가되었다. 간 조직에서 SOD와 GPX 활성도 및 지질과산화도는 처리군간 비슷한 수준을 보였으나, GST는 ZnM군에서 대조군에 비해 현저히(P<0.05) 증가하였다. 소장 흡수세포에서 아연 운반단백질 ZnT-1(8.62배 P=0.09) 및 ZnT-5(7.3배, P=0.06) mRNA 발현은 ZnM군에서 증가되는 경향은 보였으나, 통계적 차이는 인정되지 않았다. 간에서 아연운반체 mRNA 발현은 아연급여에 따른 통계적 차이는 없었으나, ZnM군에서 대조군에 비해 MT mRNA 발현이 4.12배 증가되는 경향(P=0.10)을 보였다. 이상의 결과로 보아 기초사료에 Zn-methionine 보충 급여(50 ppm)는 재래닭의 소장 및 간 조직에서 GST 활성도를 유의하게 증가시키고, 소장에서 아연운반체 mRNA 발현을 증가시키는 경향을 보여 유기태 아연급여는 체내 산화적 스트레스 방어 긍정적인 영향을 미칠 수 있는 것으로 생각된다.








