Article
2018년도에 분리된 닭 전염성기관지염 바이러스에 대한 병원성 시험
박담희1
,
윤하나2
,
주효선3
,
김규직4
,
고성혜4
,
이다예4
,
송창선5,6,†
Determining Pathogenicity of Infectious Bronchitis Virus Isolated in Korea 2018
Dam-Hee Park1
,
Ha-Na Youn2
,
Hyo-Sun Ju3
,
Kyu-Jik Kim4
,
Seong-Hye Go4
,
Da-Ye Lee4
,
Chang-Seon Song5,6,†
Author Information & Copyright ▼
1건국대학교 수의과대학 조류질병학 실험실 대학원생
5건국대학교 수의과대학 조류질병학 실험실 교수
1Student, Avian Disease Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
2Chief Researcher, KCAV Co., Ltd., Seoul 05029, Republic of Korea
3Senior Researcher, KCAV Co., Ltd., Seoul 05029, Republic of Korea
4Researcher, KCAV Co., Ltd., Seoul 05029, Republic of Korea
5Professor, Avian Disease Laboratory, College of Veterinary Medicine, Konkuk University, Seoul 05029, Republic of Korea
6Representative, KCAV Co., Ltd., Seoul 05029, Republic of Korea
© Copyright 2019, Korean Society of Poultry Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Oct 10, 2019; Revised: Nov 15, 2019; Accepted: Nov 18, 2019
Published Online: Dec 31, 2019
적 요
IBV는 전세계적으로 양계산업에 문제시되고 있는 호흡기성 질병으로 육계 및 산란계의 생산성에 큰 영향을 미치고 있다. 본 연구는 2018년도에 분리된 3개의 IBV의 병원성을 확인하였다. 동물실험을 통해서 염증정도, 섬모소실도 그리고 폐사율의 결과를 바탕으로 2018년도 분리주인 QX-like IBV형은 병아리에게서 충분한 병원성을 지닌 것을 확인하였다.
ABSTRACT
Infectious bronchitis virus (IBV) is an acute respiratory disease, causing economic losses in poultry production. IBV commonly manifests respiratory disease symptoms and poor egg quality in poultry, affecting overall performance of both broilers and layers. IBV infection further predisposes poultry to secondary opportunistic bacterial infections. IBV undergoes rapid genetic evolution resulting in various new strains. There is no cross protection among IBV serotypes which makes full protection against wild-type IBV virtually impossible. In this study, recently isolated IBVs (K24/18, K29/18, K183/18) from Korean broiler farms were genetically analyzed based on S1 gene. According to the results, IBV isolates showed highest homology with QX-IBV. However, phylogenetic tree analysis revealed that isolates were divided into distinct sub-clusters within QX-IBV. To determine pathogenicity of IBV, day-old chicks were challenged with IBV through ocular route. After challenging the chicks, we executed microscopic examination, virus detection in their organs, and observation of clinical signs and mortality. We found that the K24/18, K29/18, K183/18 challenge groups showed 28%, 57%, and 42% mortality, respectively, with high microscopic trachea lesion scores, indicating that these QX-IBV-like strains are pathogenic to chicks and can therefore be a threat to poultry production.
Keywords: infectious bronchitis virus (IBV); serotype; cross protection; pathogenicity; respiratory
서 론
닭 전염성 기관지염 바이러스(IBV; Infectious bronchitis virus)는 전세계적으로 양계농가에 지속적인 피해를 입히고 있는 급성 호흡기 질환이다. 이는 1986년에 국내에서 최초로 보고되었지만(Rhee et al., 1986), 바이러스 특성상 잦은 유전적 변이와 바이러스간 재조합으로 인해 다양한 혈청형이 끊임없이 새롭게 발견되고 있으며(Wang et al., 1994), 이들 혈청형들 간에는 상호 교차반응 및 면역능 형성이 어려워 질병의 예방에 많은 어려움을 겪고 있다(Ignjatović and Sapats, 2000). IBV는 모든 일령에 감수성이 존재하지만 낮은 일령의 병아리일수록 감수성이 높다는 특징을 지니고 있다. 이와 같은 바이러스에 감염된 개체들은 심한 호흡기 증상을 보이며 2차적인 세균 감염까지 동반하면 높은 폐사율을 나타나게 된다. 이외에도 산란 장기인 난소와 수란관에 손상을 주어 무산란계와 같이 산란율 감소에 직접적인 영향을 미치는 임상 증상을 나타내어 농가에 큰 피해를 야기시키고 있다(Chew et al., 1997).
과거 한국에서 주로 농가에 피해를 입힌 IBV는 호흡기형인 Mass형과 K-I형이었다. 하지만 최근 농가에서 분리된 IBV에 대한 유전자 분석 결과는 주로 중국 유래의 QX-IBV like 형과 비슷한 형태를 나타낸다는 것을 확인하였다(Lee et al., 2008).
본 연구에서는 2018년도에 육계농장에서 폐사를 나타낸 닭으로부터 IBV를 분리해 유전자 분석을 진행하였으며, 1일령 SPF 병아리에 공격접종을 통한 바이러스의 병원성을 확인하였다.
재료 및 방법
1. 바이러스 분리 및 RNA 추출
2018년도 육계농장에서 IBV와 관련된 임상증상을 나타낸 개체들로부터 바이러스 분리를 위해 기관, 신장, 맹장편도를 채취하여 10% W/V PBS로 유제하였다. 3,000 rpm에 10분 원심분리 후, 0.45 μm 필터로 여과하여 장기당 3개의 10일령 SPF 종란(Hy-Vac, USA) 장요막강에 0.2 mL씩 접종하였다. 접종 후 37°C에 72시간 동안 배양하였으며, 접종 후 24시간 이내의 폐사는 접종사로 간주하였다. 72시간 배양 후, 장요막강액에서 바이러스를 수거하였으며, Viral genespin™ Viral DNA/RNA Extraction kit(iNtRON Biotech, Korea)를 사용하여 유전자를 추출하였다. 위와 같이, 감염 의심 개체로부터 추출된 유전자를 이용해 특정 primer로 총 3종의 IBV를 확인하였다(Table 1).
Table 1.
Information of field isolates of IBV used in this study
| IBV isolate |
Type of birds |
Year of isolation |
Clinical sign |
| K24/18 |
Broilers |
2018 |
Nephritis |
| K29/18 |
Broilers |
2018 |
Nephritis |
| K183/18 |
Broilers |
2018 |
Nephritis |
Download Excel Table
2. PCR 및 Sequencing
계태아란 장요막강에서 증식한 바이러스를 유전자 추출 후, one-step Probe RT-PCR kit(Qiagen, Germany)와 realtime PCR(Applied Biosystems, USA) 기기를 이용해 5’-UTR 유전자를 증폭하여 진단하였다(Callison et al., 2006). 계통학적 분석을 진행하기 위해 두 쌍의 primer를 이용하여 onestep RT-PCR kit(Qiagen, Germany)를 50°C에 30분, 95°C에 15분 그리고 94°C에 1분 30초 52°C에 1분 30초 및 72°C에 2분씩 40회 반복과 최종 72°C에서 10분간 반응시켜 S1 유전자 부위를 증폭시켰다(Table 2). 증폭산물은 1.5%(w/v) 아가로스 겔에서 전기영동을 실시하여 해당 밴드를 확인한 다음, Gel extraction kit(Elpis Biotech, Korea)를 이용하여 증폭산물을 마크로젠사(Macrogen, Korea)에 염기서열 분석을 의뢰하였다. 염기서열 교정 및 alignments는 Geneious (Biomatters Ltd, USA)로 진행하였으며 마지막으로 MEGA version 6를 이용해 phylogenetic tree를 작성하였다. 분석된 유전자 서열은 GenBank에 공개된 60개 IBV의 정보를 참조하여 분석하였다(Lim et al., 2012).
Table 2.
Sequence of S1 gene specific primers
| Target gene |
Primer |
Sequence (5’-3’) |
PCR product size |
| S1 gene |
IBV F1 |
AGCAACRCCAGTTGTDAATTTG |
700~800 bp |
| IBV R1 |
CWGTACCATTAACAAARTAAGCMAG |
| IBV F2 |
TGTGTATTTTAAAGCAGGTGGACC |
| IBV R2 |
GTTTGTATGTACTCATCTGTAAC |
1,000~1,100 bp |
Download Excel Table
3. 사용동물
2018년도에 분리된 IBV의 병원성을 확인하기 위해 1일령 SPF 병아리를(Nam-Deog Sanitek Co., Korea) 사용하였으며, 실험은 건국대학교 동물실험윤리위원회(IACUC)의 기준에 따라 진행되었다(승인번호 KU19156). 1일령 SPF 병아리 48마리를 K24/18, K29/18, K183/18형 공격접종군 및 음성대조군으로 총 4그룹으로 나누었다. 대조군을 제외한 시험군 3그룹에 공격접종 바이러스를 각각 수당 104.5 EID50으로 점안 접종하였다.
4. 조직학적 검사
바이러스 접종 5일 후, 5마리는 조직학적 검사를 진행하기 위해 안락사하여 기관 상부, 중부 그리고 하부 및 신장을 채취한 뒤, 중성포르말린에 고정을 실시한 후 H&E(Hematoxylin and Eosin)염색하였다. 기관은 섬모소실도와 염증정도 그리고 신장은 염증정도만을 측정하였다. 섬모소실도는 정상일 경우 0점, <25%의 섬모소실을 보였을 경우 1점, 25∼50%는 2점, 50∼75%는 3점 그리고 75∼100%는 4점으로 측정하였다. 기관의 염증정도는 정상일 경우 0점, mild한 경우 1점, moderate한 경우 2점 그리고 severe한 경우 3점으로 측정하였으며, 신장의 경우 정상일 경우 0점, focal한 경우 1점, multifocal한 경우 2점, diffuse일 경우 3정으로 측정하였다(Riddell, 1987).
5. 바이러스 검출
분리된 바이러스의 검출율을 확인하기 위해 나머지 7마리는 접종 7일 후 경추탈골을 통한 안락사를 진행하였다. 개체별로 기관, 신장, 맹장편도, 폐, 간, F낭을 채취하여 10% W/V PBS로 유제한 뒤, real-time PCR(Applied Biosystems)을 이용하여 장기별 바이러스 검출을 실시하였다.
6. 임상증상 관찰
바이러스 접종 후 7일 동안 병아리 상태를 확인하였으며, 폐사율을 기록하였다.
결 과
1. PCR 결과
IBV 감염 의심 폐사계로부터 기관, 신장 그리고 맹장편도를 혼합한 시료에서real-time PCR을 실시한 결과, 모두 IBV 양성으로 확인되었다.
2. S1 Gene 염기서열 및 계통학적 분석 결과
염기서열 분석 결과, 분리된 3개의 IBV K24/18, K29/18, K183/18형은 서로 98.6∼99.2% 정도의 상동성을 나타내었으며, K-1형에 속하는 B4형과 75.7∼76.1%의 상동성을 보였다. 또한, 두 가지의 K-2형인 KM91형과 83.9∼84.5%, QX-IBV형과 94.3∼94.8%의 상동성을 나타내었다.
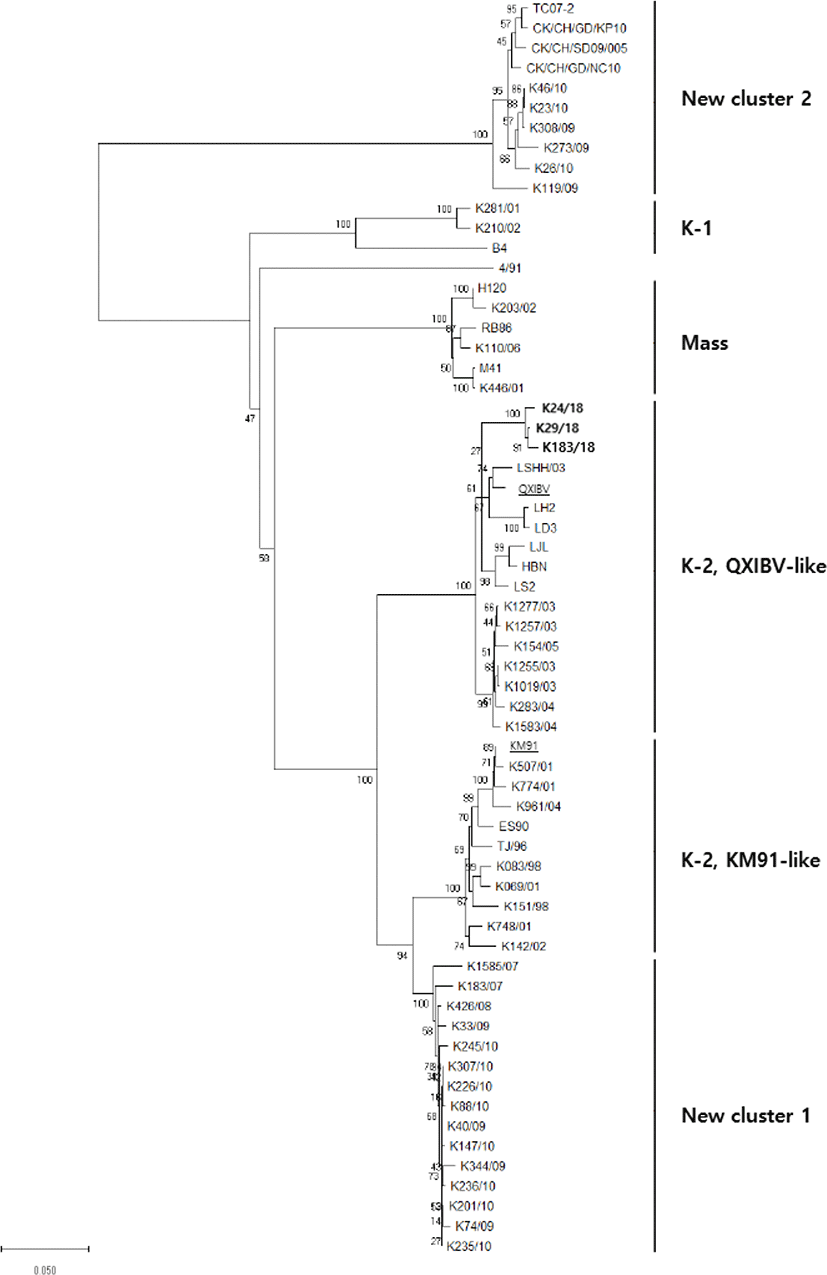
분리된 3개의 IBV K24/18, K29/18, K183/18형은 S1 유전자 염기서열에 대한 Phylogenetic tree 분석 결과, 국내 분리된 K1019/03, K1255/03 및 중국에서 분리된 LH2, LD3형과 같은 cluster에 속한 QX-IBV like형으로 확인되었지만, 그 안에서도 독립적인 cluster를 이루고 있음을 보였다(Fig. 1).
Fig. 1.
Infectious bronchitis virus (IBV) phylogenetic tree based on S1 genes. Strains used in this phylogenetic tree are 3 IBV isolates and 60 reference strains. IBV isolates used in this study are marked in bold. QX-IBV and KM91 strains are underlined and bolded. Genogroups and subgenogroups of IBV are indicated on the right.
Download Original Figure
3. 조직학적 검사 결과
공격접종 5일 후 조직학적 검사 결과, K183/18형이 분리된 다른 IBV보다 음성대조군에 비해 상부기관에서 상대적으로 높은 염증정도를 보여주었으며(Table 3), 3개의 IBV 모두 평균 3∼4점으로 음성대조군보다 섬모가 월등히 소실된 것을 확인할 수 있다(Table 4).
Table 3.
Inflammatory response of trachea and kidney from challenged chickens
| Group |
Inflammatory response1 (Mean±SD) |
| URT |
MRT |
LRT |
Kidney |
| G1 |
K24/18 |
0.6±0.5 |
0.8±0.4 |
0.2±0.4 |
0.8±1.1 |
| G2 |
K29/18 |
0.4±0.5 |
0.2±0.4 |
0.4±0.5 |
0.6±0.9 |
| G3 |
K183/18 |
1.8±0.4 |
0.4±0.5 |
0.4±0.5 |
0.6±0.9 |
| G4 |
Control |
0.0±0.0 |
0.0±0.0 |
0.0±0.0 |
0.4±0.5 |
Download Excel Table
Table 4.
Loss of trachea cilia from challenged chickens
| Group |
Loss of trachea cilia1 (Mean±SD) |
| URTB |
MRTC |
LRTD |
| G1 |
K24/18 |
3.2±0.8 |
3.2±1.1 |
2.4±1.1 |
| G2 |
K29/18 |
4.0±0.0 |
3.8±0.4 |
3.6±0.9 |
| G3 |
K183/18 |
3.8±0.4 |
4.0±0.0 |
4.0±0.0 |
| G4 |
Control |
0.2±0.4 |
0.2±0.4 |
0.3±0.5 |
Download Excel Table
4. 바이러스 검출 결과
공격접종 7일 후 바이러스 검출 결과는 기관, 신장, 맹장편도, 폐 그리고 F낭에서 100%로 IBV가 검출되었지만, 간에서는 K24/18, K29/18, K183/18형 순서대로 57%, 71%, 100% 검출되었다(Table 5).
Table 5.
Virus detection of each IBV isolates from different organs
| Virus re-isolated organ |
K24/18 |
K29/18 |
K183/18 |
| Trachea |
7/7 |
7/7 |
7/7 |
| Kidney |
5/5 |
3/3 |
4/4 |
| Cecal tonsil |
7/7 |
7/7 |
7/7 |
| Lung |
5/5 |
3/3 |
4/4 |
| Liver |
4/7 |
5/7 |
7/7 |
| Bursa |
5/5 |
3/3 |
4/4 |
Download Excel Table
5. 임상증상 관찰 결과
7일 동안의 폐사율은 K24/18, K29/18, K183/18형 순서대로 28%, 57%, 42% 폐사율로 K29/18형이 가장 높았다(Table 6).
Table 6.
Mortality of each IBV isolates
| K24/18 |
K29/18 |
K183/18 |
| Mortality |
Mortality |
Mortality |
| 2/7 |
4/7 |
3/7 |
Download Excel Table
고 찰
현재 국내에서 유행하고 있는 IBV는 심한 호흡기와 산란저하를 유발하는 호흡기형 K-1형과 호흡기를 동반하나 신장염과 산란 저하가 더 뚜렷한 신장형 K-2형이 존재하며, 신장형 IBV의 경우 한국형과 중국형 신장형으로 나누어진다(Lim et al., 2011). 이와 같이 다양한 혈청형을 지닌 IBV를 방어하기 위해 많은 생독 및 사독백신이 개발되었지만, 혈청형간 교차방어가 성립되지 않는 IBV의 특성으로 인해 다양한 종류의 변이형 IBV를 방어하기에는 한계가 있는 것으로 평가된다(Lee et al., 2004). 최근 국내에서 가장 많은 피해를 입히는 IBV는 중국 유래의 QX-like IBV 형이다. 하지만 동일한 QX-like IBV형임에도 불구하고, 지속적인 유전적 변이로 인해 다양한 병원성을 나타내고 있다 (Worthington and Jones, 2006). 이에 따라 2018년도 국내 육계농장에서 3개의 IBV를 분리하여 유전자 및 계통학적 분석과 동물실험을 통해 병원성을 확인하였다.
실험결과, 2018년도에 분리된 IBV는 K-1형보다 K-2형이 보다 더 높은 상동성을 보였고, 그중 중국형 유래의 QX-IBV와 94.3∼94.8%로 가장 유사하였다. 그리고 계통학적 분석 결과, 3개의 IBV 모두 QX-like IBV형으로 확인되었다. 동물실험을 통한 조직학적 검사 결과는 K183/18형 상부기관에서만 염증정도가 상대적으로 음성대조군에 비해 높게 측정 되었다. 하지만 섬모소실도에서는 3개의 IBV 모두 기관 상부, 중부 및 하부에서 평균 3∼4점으로 많은 섬모가 소실된 것을 확인할 수 있다. 마지막으로 7일 동안의 실험결과, K24/18, K29/18, K183/18형 공격접종군은 각각 2, 4, 3마리가 폐사하였으며, 바이러스 검출은 K183/18형에서 기관, 신장, 맹장편도, 폐, 간, F낭에서 100% 분리되었지만, K24/18형 그리고 K29/18형은 간에서 각각 57%, 71% 분리되었다. 조직검사 및 바이러스 검출 결과에서는 K183/18형이 다른 IBV보다 병원성이 다소 높은 것을 확인할 수 있었지만, 폐사율에서는 반대로 K29/18형이 높았다.
분리된 IBV형은 QX-IBV안에서 독립적인 cluster를 이루고 있는 것을 확인할 수 있다. IBV는 유전적 변이가 잦은 바이러스로(Wang et al., 1994) 같은 QX-like IBV형임에도 불구하고, 상반된 병원성을 보일 수가 있다. 하지만 현재 한국에서 분리된 QX-like IBV형에 대한 병원성이 평가된 시험이 존재하지 않다. 추가적으로 바이러스 접종 농도 및 공격접종 경로를 동일하게 진행해야 IBV serotype간 정확한 병원성 비교 분석이 가능하다.
앞선 전반적인 실험결과를 토대로 음성대조군에 비해 분리된 3개의 QX-like IBV형은 폐사를 보였고, 조직학적 검사에서도 염증 정도 및 섬모소실도에서 높게 측정된 것으로 보아 1일령 병아리에게서 충분한 병원성을 보였지만, 보다 확실한 병원성을 평가하기 위해서는 공격접종 균주를 K1형 및 K2형의 한국형 신장형 그리고 다른 년도에서 분리된 QX-like IBV형을 포함하여 기관의 섬모소실도 뿐만이 아니라, IBV 감염 시 나타나는 신장 요산침착과 같은 부검소견 관찰 항목이 추가된 동물실험이 필요하다.
사 사
본 연구는 농림축산식품부의 재원으로 농림식품기술기획평가원의 농생명산업기술개발사업 (317010-3)의 지원을 받아 연구되었음.
REFERENCES
Callison SA, Hilt DA, Boynton TO, Sample BF, Robison R, Swayne DE, Jackwood MW 2006 Development and evaluation of a real-time Taqman RT-PCR assay for the detection of infectious bronchitis virus from infected chickens. J Virol Methods 138:60-65.

,


Chew PH, Wakenell PS, Farver TB 1997 Pathogenicity of attenuated infectious bronchitis virus for oviduct of chickens exposed
in ovo. Avian Dis 41:598-603.

,


Lee EK, Jeon WJ, Lee YJ, Jeong OM, Choi JG, Kwon JH, Choi KS 2008 Genetic diversity of avian infectious bronchitis virus isolates in Korea between 2003 and 2006. Avian Diseases 52(2):332-337.

,


Ignjatović J, Sapats S 2000 Avian infectious bronchitis virus. Rev Sci Tech 19(2):493-508.

,


Lee SK, Sung HW, Kwon HM 2004 S1 glycoprotein gene analysis of infectious bronchitis viruses isolated in Korea. Arch Virol 149(3):481-494.

,


Lim TH, Lee HJ, Lee DH, Lee YN, Park JK, Youn HN, Kim MS, Lee JB, Park SY, Choi IS, Song CS 2011 An emerging recombinant cluster of nephropathogenic strains of avian infectious bronchitis virus in Korea. Infect Genet Evol 11:678-685.

,


Lim TH, Kim MS, Jang JH, Lee DH, Park JK, Youn HN, Lee JB, Park SY, Choi IS, Song CS 2012 Live attenuated nephropathogenic infectious bronchitis virus vaccine provides broad cross protection against new variant strains. Poultry Science 91:89-94.

,


Riddell C. 1987 Avian Histopathology. American Association of Avian Pathology: Kennett Square, PA.

Matthijs MG, van Eck JH, de Wit JJ, Bouma A, Stegeman JA 2005 Effect of IBV-H120 vaccination in broilers on colibacillosis susceptibility after infection with a virulent Massachusetts-type IBV strain. Avian Dis 49(4):540-545.

,


Rhee YO, Kim JH, Mo IP, Yoon HS, Choi SH, Namgoong S. 1986 Outbreaks of infectious bronchitis in Korea. J Perinat Med 26:277-282.

Wang L, Junker D, Hock L, Ebiary E, Collisson EW 1994 Evolutionary implications of genetic variations in the S1 gene of infectious bronchitis virus. Virus Res 34(3):327-338


Worthington KJ, Jones RC 2006 An update in the European

RT-PCR IBV survey and recent findings on a novel IBV genotype. Pages 176-188 In: Proc. 5th Symp. Avian Corona and Pneumovirus Infections, Rauischholzhausen, Germany.