서 론
지난 반세기 동안 가금 특히 닭은 성장, 육량과 산란율 등의 생산 효율이 눈부시게 향상되었다. 이러한 것은 육종 개량 및 사양관리 기술의 개선에 의한 것으로 가금 산업의 발달에 따른 동물성 식품의 공급으로 인류 보건에 크게 기여하고 있다. 한편 생산성 향상의 이면에는 육종 개량에 따른 대사성 질병 및 지구 온난화와 환경오염 등 사육 환경의 변화와 같은 내외적 요인들에 의해 가금의 건강 및 복지에 심각한 문제가 초래되고 있다(Surai, 2020; Alo et al., 2024).
가금의 건강에 미치는 가장 부정적 문제 중 하나는 내외적 스트레스에 의해 유발되는 체 조직의 산화 스트레스(oxidative stress)로서 이에 적절히 대응하지 못하는 것이다. 산화 스트레스는 활성산소(reactive oxygen species, ROS)에 의해 유발됨으로 이의 발생 기전의 연구와 항산화 방어 작용은 가금의 건강 유지에 매우 중요하다(Surai, 1999). 다양한 연구에서 체 조직의 항산화 방어 작용은 가금의 면역, 생존율 향상, 번식력 및 가금 생산물의 품질에 유의한 영향을 미치는 것으로 보고되었다(Surai, 2002; Mishra and Jha, 2019; Surai, 2020). 따라서 가금은 발생학적으로 배아 발달 및 성장 단계에서 산화 스트레스를 유발하는 ROS로부터 체 조직을 보호하는 다양한 항산화 시스템이 급격히 발달하였다(Surai et al., 1999). 또한 폭염 등 환경 스트레스 발생 시 vitamin C와 E와 같은 항산화제 급여는 가금의 항산화 방어작용에 유익한 도움을 준다(Jang et al., 2014b). 특히 생산성 위주의 육종 개량으로 가금의 근육 발달은 매우 증가하였으나, 장기 조직의 기능은 이에 비례적으로 발달하지 못해 신체 항상성 유지에 심각한 문제가 발생할 수 있어(Julian, 2005), 항산화제 급여는 더욱 중요하다. 항산화 영양소는 과도한 대사 작용, 환경 스트레스, 곰팡이 독소 등에 의해 생성되는 ROS로부터 산화 스트레스를 방지하는 중요한 수단이 될 수 있다(Surai and Kuklenko, 2000; Mishra and Jha, 2019). 최근 기후 변화에 따른 열 스트레스로 체온 조절 기능이 낮아 산화 스트레스가 더욱 심각한 가금에서 항산화제의 사용이 더욱 주목을 받고 있다. 따라서 친환경 사육 방법으로 산화 스트레스 완화에 따른 항상성 증가는 동물 건강과 복지를 증진하고 근육 조직의 안정성 증가로 가금 생산물의 품질을 향상할 수 있어 항산화제 사용량이 현저히 증가하고 있다(Oke et al., 2024; Oni et al., 2024).
따라서 본 고찰의 목적은 가금에서 체 조직의 항산화 방어체계에 대한 이해를 바탕으로 사료첨가제로써 활용할 수 있는 천연 항산화제들의 종류, 작용 기전 및 효과와 잠재적 적용 가능성에 대한 정보를 제공하고자 한다.
가금에서 항산화 방어 작용의 중요성
가금 사육과정에서 다양한 내외적 스트레스 요인들에 의해 체내 심각한 산화 스트레스가 발생할 수 있다(Fig. 1). 먼저 내적 산화 스트레스 요인들을 살펴보면, 체 조직에서 생성되는 ROS는 세포 신호전달 작용 등과 같은 긍정적 효과도 있지만, 과도하게 생성되면 세포 손상을 초래한다(Sies and Jones, 2020). 특히 비정상적 대사 작용으로 생성된 과도한 ROS는 DNA 돌연변이, 단백질 변성, 지질 과산화 등을 유발하는 것이 잘 알려져 있다(Mujahid et al., 2007). 세포막은 소수성과 친수성 부분으로 구성된 이중 지질 막 구조로 내생적으로 발생하는 superoxide, hydrogen peroxide, hydroxyl radicals, hydrogen peroxide, peroxyl radicals 등과 같은 ROS가 막 단백질 산화와 세포막의 손상을 유발한다(Fig. 2). 세포막 구성 성분의 불포화지방산 산화는 막 구조와 유동성 변화, 흡수성과 및 세포막 효소의 기능에도 큰 영향을 미친다(Surai, 2002).
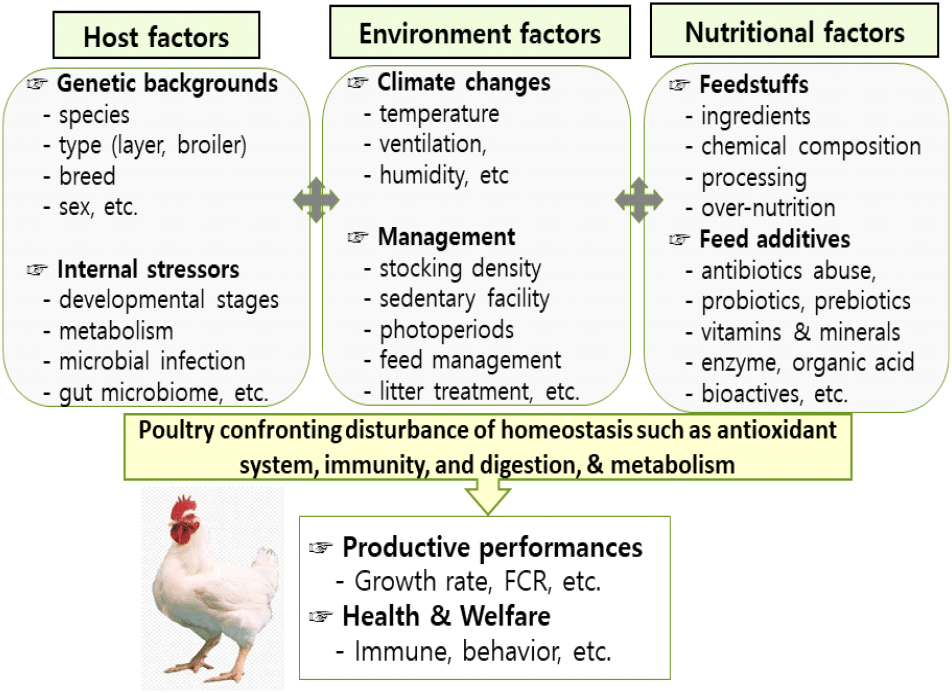
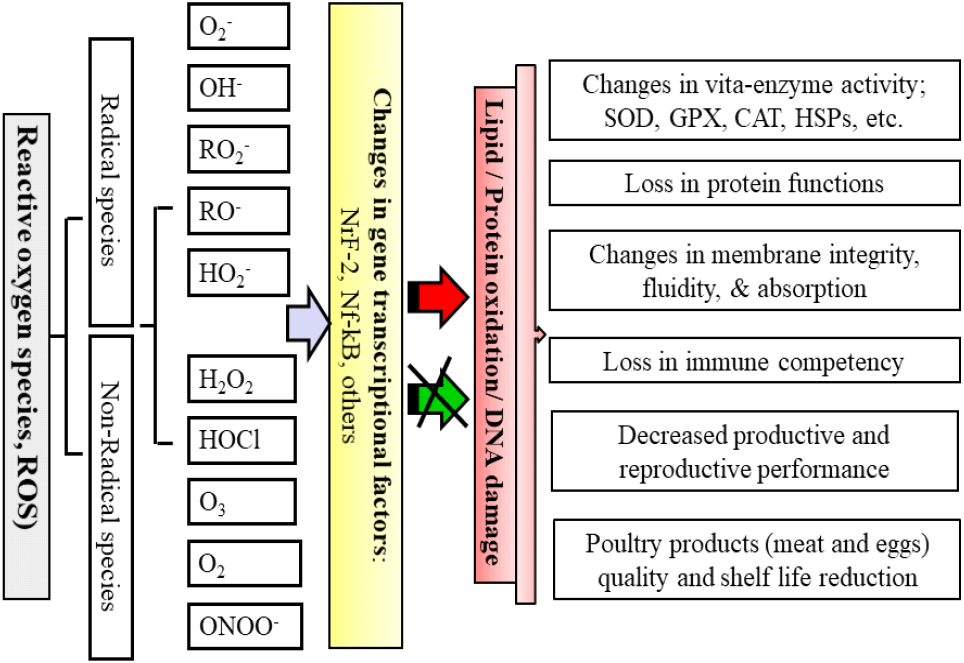
지금까지 잘 알려진 사실은 체내 항상성 유지를 위한 항산화 작용은 동물의 연령, 품종, 성 등 유전적 요인 등에 따라 많은 차이가 있다(Fig. 1). 육계와 산란계는 각각 성장, 산란 능력 및 영양소 이용 효율 등 생산성 위주로 육종되어 대사 작용에 따른 산화 스트레스 유발 요인이 매우 높다(Soleimani et al., 2011). 특히 빠른 근육 성장 위주로 개량된 육계에서 고온 스트레스에 노출되면 산화 스트레스의 대응이 더욱 취약하다(Kpomasse et al., 2021). 또한 부화 발생 전후와 육성기에 대사 작용의 증가로 체내 산소 요구량 증가함으로 과도한 ROS가 생성되어 산화 스트레스가 더욱 심각한 것으로 보고되며(Surai, 1999; Julian, 2005), 이 시기에 체 조직의 항산화 방어 작용 또한 급격히 발달한다(Circu and Aw, 2012). 닭은 부화 전후 항산화 효소가 간 등 모든 조직에서 발달하며 어린 병아리도 각 장기에서 높은 수준의 항산화 효소가 발현된다(Tang et al., 2019; Kim et al., 2021). 또한 세균 등 외부 침입에 대응하기 위하여 면역 방어체계가 활성화 될 때도 ROS 생성이 급증하는 것으로 알려졌다(Schwarz, 1996). ROS 생성의 증가는 염증 발생을 촉진해 닭의 면역, 번식, 대사, 생산성 및 가금 생산물의 품질에 직접적인 영향을 미친다(Figs. 1 and 2).
가금 사육 시 필연적으로 발생하는 외적 스트레스는 사육환경 및 영양 요인으로 구분할 수 있다(Fig. 1). 사육환경 요인 중 폭염은 심각한 열 스트레스를 유발하고(Jang et al., 2014b), 소화기관에서 과량의 ROS 발생에 따른 염증으로 흡수 세포의 손상과 영양소 흡수율이 저하되어 가금의 생산성이 감소한다(Mishra and Jha, 2019). 고온 스트레스에서는 미토콘드리아 기능 장애로 생성된 과량의 ROS가 주요 장기에서 지질 과산화 작용을 유발하여 기능을 손상한다(Tan et al., 2010). 또한 고온 스트레스로 과도하게 생성된 ROS는 염증을 유발하여 면역력을 저하시켜 닭에서 질병에 쉽게 감염된다(Naidoo et al., 2008). 사육과정에서 병원성 세균 등의 감염 역시 가금에서 심각한 산화 스트레스를 유발한다(Oke et al., 2024). 원충(Eimeria acervulina)에 감염된 닭의 소화기관에서 산화 스트레스에 따른 지질 과산화 및 염증 작용으로 심각한 면역 저하가 발생하는 것으로 보고되었다(Naidoo et al., 2008; Mishra and Jha, 2019). 그 외 가금의 사육환경에서 부적절한 환기에 따른 NH4, CO2, 먼지 등 역시 체 조직에서 산화 스트레스를 유발하는 주요 요인으로 작용한다(Surai, 2002).
영양 요인으로 오염 사료에 존재하는 곰팡이 독소 및 유해 물질은 가금의 소화기관 및 장기에 치명적 손상을 초래할 수 있다. 많은 연구에서 aflatoxin, fumonisin 등과 같은 mycotoxin는 소장 상피세포의 구조적 손상을 유발하여 영양소 흡수, 미생물군 및 면역 작용에 심각한 손상이 발생한다고 보고하였다(Mishra and Jha, 2019; Surai, 2020). 산패 지방, 중금속 등과 같은 사료도 소장 점막 세포에서 산화 스트레스를 유발하여 흡수 세포의 기능 저하로 생산성을 감소시킨다(Surai, 2002; Mishra and Jha, 2019).
이처럼 가금에서 수많은 내외적 요인으로 발생하는 산화 스트레스는 영양소 이용과 대사 효율 저하, 장기의 기능 장애, 번식 저하 등과 같은 생산능력에 직간접적인 영향을 미친다. 산화 스트레스는 면역 저하에 따른 질병 발생과 깊은 연관이 있으므로 가금은 태아 발생 및 성장발육 단계에서 신체를 보호하는 항산화 방어 기전을 스스로 갖게 된다. 체 조직의 항산화 작용은 비효소적 항산화 물질과 항산화 효소에 의해 이루어짐으로(Suari, 2002), 심각한 스트레스에 노출되는 시기와 환경에서 항산화제 급여는 가금의 면역력에 매우 중요하게 작용한다.
체 조직에 존재하는 항산화 효소들은 superoxide dismutase(SOD), glutathione peroxidase(GPX), catalase(CAT), glutathione reductase(GR) 및 glutathione S-transferase(GST) 등이다(Fig. 3). 생리적 대사 과정에서 O2−가 주요 ROS로 발생되며 SOD는 O2−를 H2O2로 전환하는 효소로서 체 조직에 널리 발현된다(Suari, 2002). GPX는 SOD에 의해 생성된 H2O2를 H2O로 전환하는 효소로서 체내 발생한 과산화물을 제거하는 기능을 한다(Surai et al., 2018). 가금에서 Se-dependent GPX는 Se와 함께 항산화 방어 작용에 중요한 역할을 담당하는 것으로 알려져 있다(Surai and Kochish, 2019). CAT 역시 SOD에 의해 생성된 과산화수소 분자를 H2O와 O2로 전환하는 효소로서 탈수소 반응으로 ROS를 제거한다(Aebi, 1984). GR은 NADPH와 함께 산화형 glutathione을 환원형으로 전환하여 산화 스트레스 방어 기전이 원활하게 진행되도록 도와준다(Couto et al., 2016). GST는 산화 스트레스로 발생한 대사산물을 제거하는 항산화 작용과 비극성 독성물질을 해독하는 역할을 동시에 수행하는 이물질(xenobiotics) 대사 효소이다(Hayes et al., 2005).
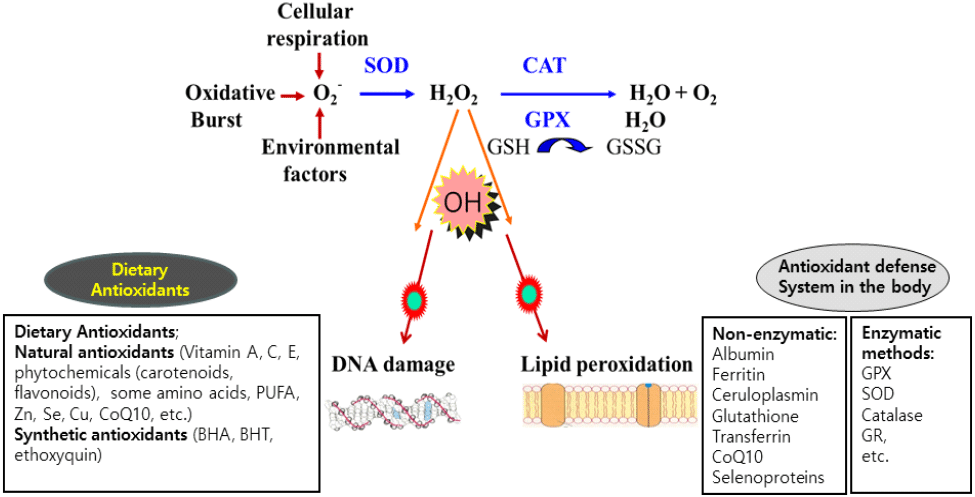
항산화 계열의 효소들은 체 조직 분화가 왕성한 가금의 배아 발생단계부터 급격하게 발현된다(Surai, 1999; Yigit et al., 2014; Yang et al., 2018). 부화 시 고온, 고습도 및 고 CO2 농도로 발육 환경 스트레스가 매우 크고 발생 단계(19일령)에서 불포화지방산 함량이 높아 산화 스트레스가 가장 높은 것으로 알려져 있다(Surai, 2002; Jadhav and Kengar, 2016). Yigit et al.(2014)은 SOD는 산화 스트레스에 대응하기 위해 배아 발생 11일째 최대로 발현되며 항산화 작용이 배아단계에서 급격히 발달한다고 보고하였다. 항산화 효소들은 가금의 부화 단계에서 간, 심장 및 신장 등 대사 작용이 활발한 장기에서 SOD와 GPX 수준이 높게 유지된다(Surai, 1999; Tang et al., 2019; Kim et al., 2021). 또한 부화 후 1주 동안 급격한 성장기에 고수준의 ROS가 생성되므로 소화기관에서 SOD 발현이 급격히 증가하는 것으로 보고되었다(Tang et al., 2019). 육계는 대사 작용에 따른 과도한 ROS 생성으로 대사성 질병의 발생이 급격히 증가함으로(Geng et al., 2004), 2~6주령 동안 주령이 증가할수록 ROS에 따른 산화 스트레스로 심장 조직에서 지질 과산화도가 현저히 증가하는 것으로 나타났다(Milinkovic-Tur et al., 2009). 본 연구팀에서도 White Leghorn과 한국 재래 닭에서 부화 후부터 성장이 빠른 육추기에 간 조직의 SOD, GPX 및 GST 활성도가 높게 유지된다는 사실을 관찰하였다(Kim et al., 2021; Nam et al., 2024).
체내 합성 또는 영양소 급여에 의해 증가하는 비효소적 항산화 물질 역시 산화 물질과 ROS를 소거하여 산화 스트레스로부터 신체를 방어하는 중요한 역할을 한다. 체 조직의 여러 종류의 단백질, 비타민, 광물질, coenzyme Q10(CoQ10) 등이 항산화제로서 작용을 하는데 Table 1 및 Fig. 3에 제시한 바와 같다(Surai, 2002).
비효소계 항산화 물질로서 먼저 혈액에 존재하는 albumin 및 uric acid 등 질소화합물이 체 조직에서 총 항산화력의 약 70%를 담당한다고 보고되었다(Park and Kweon, 2013). 금속 킬레이트 단백질로서 albumin은 Cu++에 의한 지질 과산화와 수산기 형성을 억제하여 산화 작용으로부터 신체를 보호한다(Halliwell and Gutteridge, 1990). Ferritin, ceruoplasmin, metallothionenin 등과 같은 체 단백질도 chelators로서 Fe와 Cu 이온 등과 결합하여 항산화 방어 작용을 한다(Surai, 2002). Cystein, glycine 및 glutamic acid로 구성된 glutathione은 체내 항산화 방어체계의 중요한 역할을 하는 peptide로서 ROS, 지질 과산화물로부터 세포 손상을 방지한다(Surai, 2020). 특히 환원형 glutathione은 H2O2 촉매작용에 관여하는 GPX에 작용하여 peroxides를 제거하는 중요한 항산화 펩타이드로 잘 알려져 있다.
α-Tocopherol은 강력한 항산화제로서 세포막에서 chain-breaking 작용을 하는 지용성 비타민이다(Panda and Cherian, 2014). Vitamin A와 전구체로서 β-carotene(식물의 색소)은 단일 oxygen quencher 역할을 하는 항산화 비타민이다(Livrea et al., 1996). 수용성 vitamin C는 세포 내외액에서 직접 유해산소기를 제거하는 작용에 관여한다(Zheng et al., 2024). 이들 비타민은 대부분 사료를 통해 체 조직에 공급됨으로 항산화 vitamin 부분에서 상세히 기술하였다.
Uniquionine 계열로서 Coenzyme Q10(CoQ10)은 지용성 비타민처럼 세포의 미토콘드리아 전자전달계의 산화적 인산화 작용에 관여하여 ATP를 생성하는 중요한 역할을 한다(Acosta et al., 2016). 가금에서 대사 작용이 활발한 간, 심장 등의 미토콘드리아에 CoQ10이 다량 존재하며 에너지 대사로 ROS가 과다 생성 시 산화-환원(redox) 반응에 의한 항산화 작용에 관여한다(Quiles et al., 2005; Moon and Jang, 2022). CoQ10의 항산화 작용은 체 조직에서 비타민 C나 E보다도 항산화력이 강력한 것으로 보고되었다(James et al., 2004). CoQ10 급여 시 산란계에서 혈액, 간, 근육의 CoQ10이 현저히 증가하고(Krizman et al., 2013), 육계에서는 복수증 발생이 감소하는데 이는 심장과 폐 조직의 미토콘드리아 대사 과정에서 CoQ10이 ROS를 효과적으로 억제하였기 때문이라고 알려져 있다(Geng et al., 2004).
항산화 사료첨가제의 종류 및 효과
최근 축산업에서 동물의 건강과 동물성 식품의 품질 향상을 위해 사용하는 항산화제들은 Fig. 3에 나타낸 것처럼 비타민, 무기물, 식물 추출물(phytochemicals), 불포화지방산, 아미노산 등 다양한 소재들이 주목을 받고 있다(Jeon et al., 2019; Papadopouos et al., 2019; Oke et al., 2024). 항산화제는 체 조직의 항산화, 면역 및 번식 능력 등의 생리적 작용에 긍정적인 영향을 미치며 지방산의 산패 방지로 사료와 동물성 식품의 품질 유지에도 중요한 기능을 한다(Surai, 2002). 현재 사료 첨가용 항산화제는 BHT(butylated hydroxytoluene), BHA(butylated hydroxyanisole), exthoxyquin 등으로 주로 합성 물질이 이용된다(Baszczyk et al., 2013). 닭 사료에서 페놀계 합성 항산화제로서 BHT와 BHA는 150 ppm 수준이 허용되고 있지만(FEEDAP, 2018), 이들 물질의 항산화 효과는 우수하지만, 허용 수준 이상 시 산화 촉진, 발암성 등으로 안전성 문제가 우려된다(Xu et al., 2021).
가금 생산과정에서 동물성 식품의 안전성, 기능성 및 친환경 사육 방법은 시대적 과제로서 소비자와 생산자 모두를 만족시킬 수 있는 천연 항산화제 개발과 이용 분야는 관심이 매우 높다. 항산화 생리활성 천연 사료첨가제로 이용이 가능한 소재는 Tables 1, 2, and 3에 각각 제시하였고 그중 가장 중요한 비타민, 무기물 및 식물 소재 항산화제의 종류, 효과와 잠재적 이용 가능성에 대하여 고찰하였다.
1 Modified from the Shen et al. (2022) and Li et al. (2023).
1 Adopted from Gebregziabher et al. (2023).
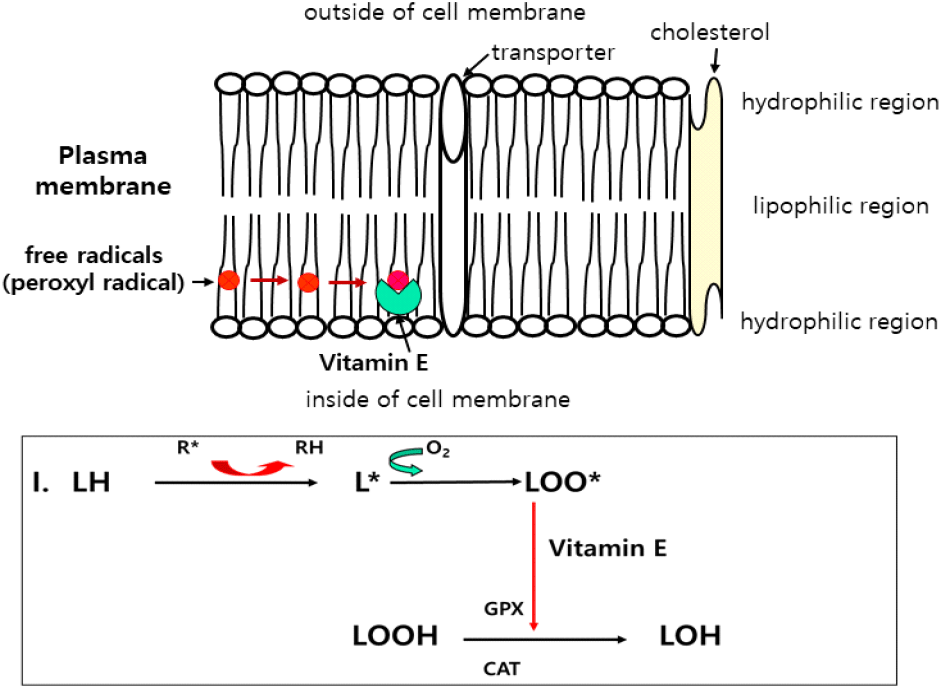
Table 1에 나타낸 바와 같이 항산화 비타민 A는 매우 효과적인 단일 oxygen quencher로서 체 조직에서 산화 물질 소거력을 가지고 있다(Livera et al., 1996). 가금에서 비타민 A 전구체로서 β-carotene은 소장 및 간에서 비타민 A로 전환되어 간, 난황 등에 다량 축적되어 항산화 및 면역 작용으로 오래전부터 주목을 받고 있다(Livrea et al., 1996; Surai and Kuklenko, 2000). β-Carotene은 식물 색소 성분으로 노란색, 주황색, 빨간색 등의 천연 항산화제로서 식물성 항산화제 부분에서 상세하게 설명하였다. Vitamin E(α-tocopherol)는 세포막에서 가장 효과적인 chain-breaking 산화 억제제로서 가금의 체 조직에서 산화-환원 균형 유지로 산화 스트레스를 방지하며(Fig. 4), 각종 염증 관련 유전자 및 전사 인자 조절, 번식 기능 및 동물성 식품의 품질 보존 작용이 널리 보고되었다(Surai, 1999; Gao et al., 2010). Vitamin C는 수용성으로 세포에서 ROS 소거 작용에 관여하는 항산화제로 vitamin E와 상호작용을 통해 불안정한 화합물이 ROS가 되는 연쇄반응을 억제한다(Zheng et al., 2024). 닭의 간 조직에서 비타민 C는 ROS와 반응하여 안정화하며 환원형 glutathione의 재생에도 관여한다(Laudicina and Marnett, 1990). Jang et al.(2014b)는 vitamin C는 고온기에 닭의 체 조직에서 항산화 작용과 함께 heat shock protein (HSP)과 친염증 cytokine 발현을 억제하여 열 스트레스를 완화하는 것으로 보고하였다. 항산화 비타민들은 체 조직에서 유해 전자와 반응하는 비타민 C와 유해산소에 수소이온을 공여하는 비타민 E의 공동 작용에 의한 부가적 상승효과가 알려져 있다(Trabera and Stevens, 2011). 많은 연구에서 vitamin C and E 급여는 장기 및 근육 조직에서 지질 과산화 억제 작용(Panda and Cherian, 2014)과 ROS를 소거하여 NF-kB 전자 인자를 발현시켜 염증 발생도 억제하는 것으로 보고하였다(Zhang et al., 2023). 따라서 이들 항산화 계열의 비타민은 가금 사육 시 발생할 수 있는 산화 스트레스를 방지하여 면역 증강과 함께 근육의 품질을 유지하여 고품질 동물성 식품 생산에도 활용할 수 있다. 또한 항산화 비타민 함유량이 높은 달걀 등과 같은 고부가 가금 생산물에도 적용될 수 있다.
항산화 기능 무기물들은 3종류가 알려져 있는데(Table 1), 그중 셀레늄(Se)은 항산화 효소로서 Se 함유 selenocysteine 계열의 GPX 구성 성분이다(Surai, 2000). 가금에서 Se 요구량은 소량이지만 부족할 경우 항산화 작용의 실패로 동물의 건강에 치명적 문제를 유발할 수 있다. 부화 직후 병아리의 간 조직에서 Se-GPX는 항산화 작용의 61%를 담당하는 중요한 효소로서 종계에게 Se 급여가 특별히 중요하다고 알려져 있다(Surai, 2002). 부화 시에는 난황에 축적된 vitamin E가 항산화 작용에 중요한 역할을 하지만, 부화 후에는 Se-GPX가 가장 중요한 역할을 함으로써 Se 보충 급여는 필수적이다(Surai, 2002). Surai(2000)는 종계 사료에 유기태 0.2~0.4 ppm Se 급여 시 부화율 증가와 부화 후 병아리에서 ROS를 소거하는 충분한 방어력이 형성된다고 보고하였다. 또한 Se는 부화기, 병아리 및 성계 등 닭의 모든 생활사에서 항산화 작용에 중요함으로 지속적인 Se 급여가 필요하다(Surai and Kochish, 2019). Zhang et al.(2012) 역시 닭에서 Se 결핍 시 산화 스트레스로 면역 기관의 발육 억제로 면역력이 감소하는 것으로 보고하였다.
아연(Zn)은 체 조직에서 300여종 이상의 효소들과 metalloenzyme에 필수 무기물로서, 생체 단백질 구조 및 촉매작용으로 가금의 대사 작용에 중요한 기능을 담당한다(Prasad, 2014). 닭에서 아연 요구량은 40 ppm(NRC, 1994)으로 무기태(ZnO, ZnSO4 등) 및 유기태 형태로 급여하고 있다(Huang et al., 2007; He et al., 2019). Zn은 산화 방어 기능에 가장 중요한 CuZn-SOD 구성 성분으로, 세포막이 O2—에 의해 산화되는 것을 방지하여 ROS에 의한 DNA 손상 방지, DNA 회복 기전, 세포분화 및 세포사로부터 세포를 보호하는 항산화 기능이 보고되었다(Song et al., 2009; Prasad, 2014). Bun et al.(2011)은 육계에 유기태 아연을 농도별(20, 40 및 60 ppm)로 급여한 결과, 생산성에는 영향이 없었지만 간 조직에서 SOD 활성도 증가로 지질 과산화도가 감소하여 닭에서 산화 스트레스가 현저히 감소하였다고 하였다. 본 연구팀에서도 한국 재래 닭에 Zn-methionine(50 ppm)을 보충 급여한 결과 소장과 간에서 GST 항산화 효소의 활성도가 증가하였다(Jeon et al., 2019). 특히 높은 환경 스트레스(밀사, 감염, 폭염 등)에서 고수준(120~150 ppm 수준)의 아연 급여는 면역력을 증강하였다는 연구가 보고되었다(Abd El-Wahab et al., 2013; Navidshad et al., 2016).
구리(Cu) 또한 metalloenzymes의 구성 성분으로 항산화 효소 Cu/Zn-SOD의 구성 성분이다. Ognik et al.(2018)은 육계에서 나노 입자의 Cu 12 mg 6주간 급여한 결과, NRC 요구량 54% 이하의 Cu를 섭취한 닭에 비해 항산화력은 향상하고 지질과산화도가 현저히 감소하였다고 보고하였다. 최근 연구에서는 나노 Cu의 급여 시 육계의 성장, 항산화력(glutathione, total antioxidant capacity, SOD) 및 면역력이 현저히 증가하는 긍정적인 효과가 발표되었다(Al-Ruwad et al., 2024).
따라서 Se, Zn 및 Cu 등은 각각 항산화 효소의 구성 성분으로 체 조직에서 직간접인 항산화 작용에 중요한 역할을 하며 내외적 스트레스가 많이 발생하는 시기와 환경에서 적절히 공급하면 가금의 항상성 유지에 매우 유익할 것으로 생각한다.
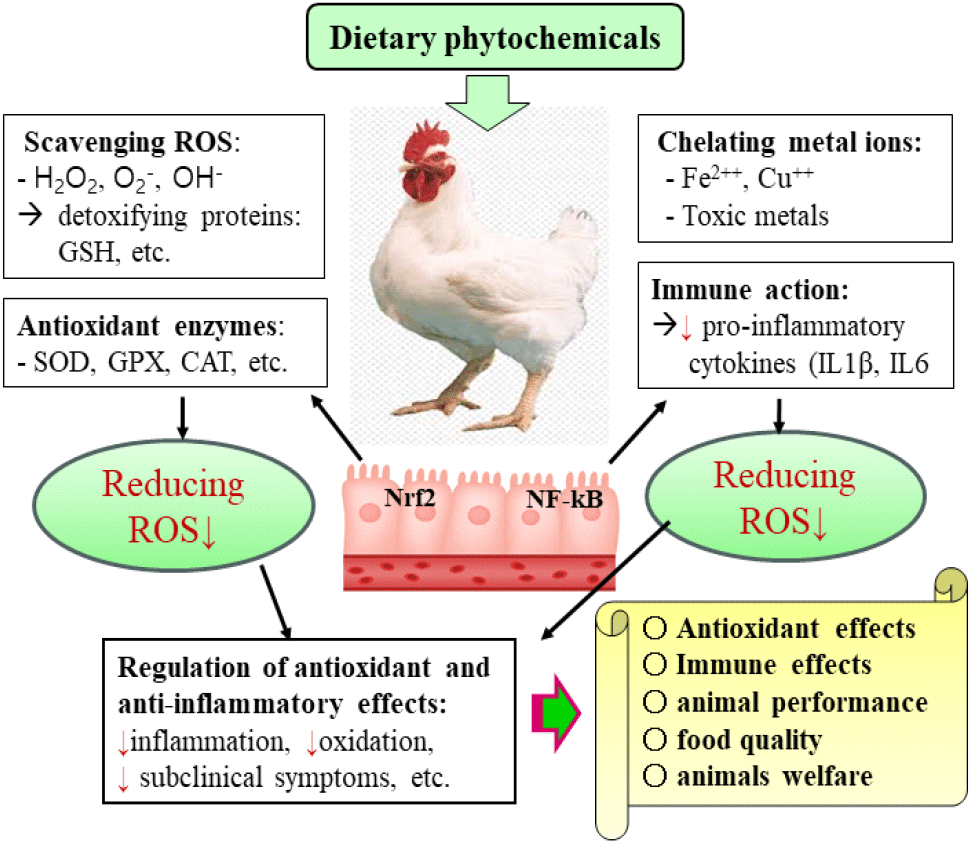
식물 화합물(phytochemicals) 항산화 물질로서 flavonoids를 포함한 다양한 polyphenol 계열과 β-carotene 등과 같은 carotenoids 계열에 관한 많은 연구가 진행되어 Tables 2와 3 및 Fig. 5에 나타낸 바와 같이 항산화, 항염증, 생산성 등 다양한 긍정적 효과가 있음이 보고되었다(Goliomytis et al., 2014; Farahat et al., 2017; Ghosh et al., 2020). 특히 천연 생리활성 물질(phytobiotics) 중 polyphenol 화합물은 ROS 소거력이 우수한 화합물로서 합성 페놀 항산화제와 유사한 항산화 활성을 나타내는 것으로 알려져 있다(Farahat et al., 2017). Polyphenol 함량이 높은 베리, 허브, 녹차 등에 함유된 성분이 가금에서 항산화 사료첨가제로서 응용 가능성이 높은 것으로 많이 보고되었다(Surai, 2002; Seomoon and Jang, 2022; Li et al., 2023). Polyphenol 구조 화합물을 가진 식물은 콩과식물, 허브, 곡류 등 다양하며, Table 2에 제시한 것처럼 페놀계 화합물은 여러 종류가 있지만 phenolic acids와 flavonoids 계열 등 2종류가 항산화제로서 가장 주목을 받고 있다(Li et al., 2023). Phenolic acid는 gallic acid, caffeic acids 등과 같은 종류들이 있으며, flavonoids는 catechin, genistein, anthocyanin, quercetin 등이 이에 속한다(Li et al., 2023). 여러 polyphenol 성분 중에서 flavonoids 계열이 항산화 작용 측면에서 가장 많은 연구가 수행되고 있으며 화학 구조에 따라 flavonols, flavones, isoflavones, anthocyanidins, flavanones, flavanols, and chalcones 등 7종류(Table 2)로 분류된다(Shen et al., 2022). Anthocyanin은 항산화 능력이 비타민 C와 E와 비교해 각각 50배 및 20배가 강한 것으로(Shi et al., 2003), 포도 성분(proanthocyanin)을 닭에게 급여 시 소화 장기와 근육에서 발생하는 ROS를 소거하여 지질 과산화도가 감소한다는 연구 결과가 발표되었다(Jang et al., 2007b; Farahat et al., 2017). Flavonol의 일종인 anthocyanin, quercetin 등의 식물 추출물 역시 닭에게 급여 시 위장관과 근육의 지질과산화도를 감소시키고 닭고기의 저장 기간을 증가시킬 수 있는 천연 항산화제로서 작용도 보고되었다(Goliomytis et al., 2014; Ghosh et al., 2020). Flavanol 성분 중 녹차에 존재하는 catechin, 콩에 함유된 isoflavone 계열의 genistein 등과 같은 flavonoid 역시 국내외에 많은 연구가 진행되어 항산화 소재로써 사용 기능성이 매우 높은 것으로 알려져 있다(Kim et al., 2010; Kamboh et al., 2013; Farahat et al., 2016). 포도에 함유된 resveratrol을 항산화제로써 급여 시(400 mg/kg) 체 조직과 난황에서 항산화력이 증가하고 가금산물의 품질이 개선되는 것으로 보고되었다(Sahin et al., 2010; Meng et al., 2023).
허브 식물 등에 주로 함유된 thymol과 carvacrol 등의 phenol 화합물도 동물 세포막의 불포화지방산의 산화를 효과적으로 억제하는 것으로 보고되었다(Cowan, 1999). 특히 thymol과 carvacrol 등을 함유한 생리활성 오일(essential oils, EO)은 상업적으로 개발된 사료첨가제로서 육계에서 근육의 지질 과산화를 억제하는 항산화 및 항균 작용으로 가금 산업에서 성공적으로 사용되고 있다(Jang et al., 2007a; Kirkpinar et al., 2014; Zhang et al., 2021).
이처럼 많은 polyphenol 계열의 성분은 가금에서 ROS 소거력, 금속 이온과 결합은 킬레이트화, 항산화 효소 활성도 증가 또는 산화 효소 및 nitric acid 생성을 억제하는 등 여러 가지 방법으로 항산화 작용을 나타낸다(Shen et al., 2022). 따라서 체 조직에서 ROS와 결합하여 안정화할 수 있는 화학 구조를 가진 polyphenol 성분은 항산화제 소재로서 가금 산업에 적용 가능성이 매우 크다.
지금까지 식물에서 600 여종의 carotenoids가 발견되었는데, 40 여종이 식품에 사용되어 인체 조직에서 20여 종이 검출되었다(Jones and Porter, 1999). Table 3에 제시한 것처럼 영양학적으로 중요하게 많이 연구하고 있는 carotenoids 성분은 α-carotene, β-carotene, lutein, zeaxanthin, lycopene, β-crytoxanthin 등 6종류로서 체 조직에서 항산화 작용을 나타낸다(Gebregziabher et al., 2023). α-Carotene, β-carotene 및 β-crytoxanthin 등 3종류는 비타민 A 전구체로 높은 항산화력을 나타낸다(Burri et al., 2016). Carotenoids 계열의 성분은 체 조직에서 발색되는 공역 이중결합(conjugated double bonds)의 구조로서 유해 ROS를 소거하는 항산화력을 나타낸다(Maurya et al., 2020). 특히 β-carotene 및 astaxantin 등은 인체에서 암 발생을 억제하는 강력한 항산화력을 나타낼 뿐만 아니라 번식과 면역 증강 등 여러 가지 생리활성 기능을 보인다(Gebregziabher et al., 2023). 특히 가금 생산물의 색도는 제품의 신선도와 영양가의 외관 평가 척도로서 선명한 색상을 나타낼수록 소비자의 상품 구매도가 높다. 따라서 사료첨가제로서 xanthophylls 계열은 난황, 계육 및 정강이 피부 착색제 용도와 함께 항산화 작용을 통해 가금 생산물의 품질을 높이는 목적으로 이용되고 있다(Maoka, 2019). 특히 xanthophyll 계열 중 lutein과 zeaxanthin은 달걀의 난황에 다량 함유된 항산화 물질로서 인간의 노화에 따른 황반변성을 예방하여 눈 건강을 유지하는 데 중요하다고 잘 알려져 있다(Berendschot et al., 2000). Lutein은 세포막에서 단일항 상태의 산소(singlet oxygen)와 peroxyl radicals를 소거하는 항산화 물질로서 체내 건강 유지를 위한 우수한 항산화력을 나타낸다(Li et al., 2010). 동물의 체 조직에서 중요한 역할을 하는 lutein은 체 합성이 되지 않아 반드시 사료를 통해 급여하여야 한다. 여러 연구 결과 닭에게 β-carotene, lutein 또는 zeaxanthin 급여 시 난황에 유의하게 축적되고 체 조직에서 항산화 작용이 현저히 개선되는 것으로 보고되었다(Jang et al., 2014a; Papadopoulos et al., 2019; Yao et al., 2023).
또한 flavonoids와 carotenoids 종류 이외 강황에 함유된 curcumin도 항산화 작용을 나타내며 가금의 사료첨가제로 연구되었다. 강황은 생리 활성이 강한 노란색 색소 성분인 커큐민(curcumin)을 함유하고 있는데, 가금의 체내에서 항산화 효소의 생성을 자극해 ROS 제거와 항염증 기능이 있는 것으로 보고되었다(Yadav et al., 2020). 산란계에서 curcumin 급여 시 여름철 사육 환경에서 강한 항산화력으로 열 스트레스로부터 발생하는 염증을 감소하여 면역 작용을 증가하는 것으로 보고되었다(Nawab et al., 2019).
지금까지 수십여 년 동안 식물성 천연 항산화 사료첨가제 개발에 관한 많은 연구가 진행되어, 일부는 기능성 사료첨가제로서 성공적으로 개발되었다. 그러나 식물성 계열의 화합물이 항산화 및 항염증 작용을 나타내는 천연물 소재로서 보고되고 있지만, 실질적으로 가금 산업에서 널리 사용하기위해서는 극복해야 할 여러 문제가 있다. 식물성 생리활성 성분은 in vitro 에서는 높은 항산화력이 증명되었지만, in vivo에서는 glycoside 결합에 따른 물질 용해도가 낮아 생체 이용률이 낮고, 첨가 용량과 화학적 안정성 등에 따라 항산화력의 결과가 일정하게 나타나지 않는 경우가 많이 보고되고 있다(Teng and Chen, 2019; Hu et al., 2023). 이러한 이유로서 식물성 phytochemicals의 생체 이용률은 식물 구조(matrix) 복잡성, 낮은 용해도, 다른 구성 성분과의 상호작용 등 여러 요인에 의해 영향을 받기 때문이다(Mamatha and Baskaran, 2011). Surai(2020)은 phytochemical 성분은 동물의 위장관에서 용해도가 낮고 소장 흡수 세포에서 수동 확산으로 흡수되어 생체 이용성이 매우 적어 체 조직에서는 소량의 성분이 생리적 활성 형태로 존재한다고 보고하였다. 이러한 문제를 해결하기 위하여 phytochemical의 흡수율을 높일 수 있는 기술의 개발이 필요한데, 화학적 물리적 구조 변화, 캡슐화, 유화, 리포솜, 나노 입자로 제조하면 효과적으로 흡수될 수 있는 것으로 알려져 있다(Ulit’ko et al., 2017; Hu et al., 2023). 특히 리포솜 형태로 급여하면 가금의 소화기관에서 2차 대사산물로 전환되는 것을 방지할 수 있어 효과적인 항산화 작용할 수 있는 방법으로 주목받고 있다(Ulit’ko et al., 2017). 또한 소장에서 흡수율 증가를 위해 유화 처리를 하면 효과가 매우 높다는 연구 결과가 보고되었다(Boonlao et al., 2022). 계면활성제로서 phospholipid 처리, 나노 입자화 등과 같은 기술적 방법은 carotenoid의 세포막 흡수율을 증가시킬 수 있다(Marsiddaiah and Baskararan, 2009; Molteni et al., 2022).
또 다른 문제로서 가금에서 항산화 생리 활성을 나타내는 최적의 용량 및 농도의 결정에 어려움이 있다. In vitro 시스템을 통한 phytochemical의 효과 연구에서는 높은 활성도를 나타내지만, in vivo에서는 이들 각 성분의 체내 흡수율과 2차 대사 과정과 밀접한 관련이 있어 명확한 결과를 얻기가 어렵다. 따라서 사료첨가제로서 개발하기 위해서는 생체에서 항산화 효과를 나타낼 수 있는 화학적 구조 형태 유지와 더불어 최적의 첨가 용량 수준에 관한 연구가 중요하다(Hu et al., 2023). 많은 종류의 식물성 항산화 성분들이 최적의 수준에서 항산화 효소(nuclear factor erythroid-2-related factor 2; Nrf2)와 항염증(nuclear factor kappa-light-chain-enhancer of activated B cells; NF-κB) 등에 관여하는 전사 인자와 vitagenes과의 상관관계 연구를 통해 명확한 항산화 및 면역 작용에 관한 연구가 지속해서 필요하다(Surai, 2020) (Fig. 5).
가금 생산과정에서 사육 환경, 기후 변화, 대사 작용, 육종 개량 등에 따른 내외적 산화 스트레스의 증가는 면역 및 생산성 저하로 심각한 경제적 손실과 더불어 동물복지에도 많은 문제를 유발한다. 향후 식물 유래 천연 생리활성 물질의 개발과 산업적 적용은 친환경 가금 산업의 발전에 매우 중요한 역할을 할 것으로 전망되며 이에 관한 지속적 연구와 투자가 필요하다.
적 요
가금은 육량과 산란율 등 생산성에서 현저한 개선이 이루어졌지만, 그 이면에는 육종 및 사육 환경변화 등에 따른 내외적 요인들에 의한 체 조직의 산화 스트레스가 건강에 심각한 문제를 유발한다. 따라서 면역, 질병, 번식 및 생산물의 품질에 영향을 미치는 체 조직의 과도한 활성산소(reactive oxygen species, ROS)를 완화하는 항산화제 개발은 가금 영양에서 중요하다. 가금에서 산화 스트레스 대응 방법으로 효소적 및 비효소적 항산화 방어체계가 배아 발생 및 성장 단계에서 급격하게 발달한다. 최근 가금 사양에서 산화 스트레스가 다발하는 시기에 항산화제의 사용이 점증하고 있다. 항산화제로서 vitamin(A, C 및 E), mineral(Se, Zn 및 Cu), phytochemicals(polyphenols, carotenoids 등) 등 다양한 종류가 있으며, 이들 화합물의 ROS 소거 작용은 킬레이트화, oxygen quencher, 산화 효소 억제, 또는 항산화 효소 발현을 촉진하여 산화 스트레스를 방어한다. 비타민 A와 E는 효과적 oxygen quencher로서 체 조직에서 chain-breaking 산화 억제제로 작용한다. Vitamin C는 vitamin E와 상호작용으로 불안정한 화합물이 ROS가 되는 반응을 억제한다. 무기물 중 Se는 Se-glutathione peroxidase, Zn과 Cu는 Cu/Zn-superoxide dismutase 구성 성분으로서 핵심적인 항산화 작용을 한다. 식물성 polyphenolics 성분 중 phenolic acids와 flavonoids는 ROS 소거력이 우수한 화합물로서 베리, 허브, 녹차 등에 존재하며 항산화제로서 이용 가능성이 크다. 특히 thymol과 carvacrol을 함유한 생리활성 오일은 우수한 항산화 작용으로 가금 산업에 성공적으로 사용되고 있다. Carotenoids는 체 조직에 축적되어 발색되는 식물성 색소로서 xanthophyll(lutein, xanthin 등) 계열은 난황과 피부 착색 효과와 항산화 작용으로 가금 생산물의 품질을 증가하는 목적으로 사용되고 있다. 식물성 천연 항산화 소재에 관한 많은 연구가 진행되어, 일부는 성공적으로 사용하고 있지만 생체 이용률이 낮고 첨가 용량과 화학적 안정성에 따라 아직 널리 이용되지는 않는다. 최근 phytochemicals의 생체 이용률을 높이기 위해 캡슐화, 리포솜, 나노 입자로 제조 기술이 발달하고 있다. 또한 식물성 소재가 항산화 및 면역 작용에 미치는 유전자 발현 연구를 통해 가장 효과적인 생리활성 물질에 관한 탐색 연구도 지속해서 진행되고 있다. 가금에서 많은 내외적 요인들이 산화 스트레스를 유발하여 동물 건강과 복지에 심각한 문제를 유발함으로 항산화제 개발과 적용은 친환경 가금 산업에 매우 중요하다.








