서 론
가축은 온열 쾌적 범위에서 최소한의 생리적 조절만으로 체온을 유지하고 생산활동을 지속한다. 그러나 주변으로의 열 방출이 충분치 않으면 열 스트레스가 발생하고 체온조절 부담이 급증한다(Akbarian et al., 2016). 닭은 정상 체온이 약 42°C로 포유류(약 37°C)보다 높고, 땀샘이 없어 증발을 통한 방열이 제한되며, 빠른 성장과 높은 대사율 탓에 열 스트레스에 특히 민감하다(Settar et al., 1999; Huang et al., 2015; Nawab et al., 2018). 육계의 적정 사육 온도는 부화 직후 약 32~33°C에서 시작해 연령에 따라 점차 낮아지며, 초기 3주 동안의 온열 쾌적 범위 이탈은 사료섭취와 성장, 면역에 즉각적 악영향을 준다(Cassuce et al., 2013). 열 스트레스는 같은 환경이라도 육계의 유전형에 따라 성장률과 내열성이 다르게 반응하는 계절과 유전형 상호작용이 존재한다(Settar et al., 1999). 열 스트레스가 체내 대사에 남기는 가장 일관된 결과 중 하나는 지방 대사의 재편이다. 세포 수준에서는 미토콘드리아 전자전달 효율 저하와 활성산소(reactive oxygen species, ROS) 과생성이 동반되어 막 전위 저하, 지질 과산화가 유발되고(Huang et al., 2015), 항산화 방어가 부적절하면 AMPK–SREBP–PPAR 등 핵심 신호 축이 교란되어 지질 합성 쪽으로 기울기가 생긴다(Akbarian et al., 2016). 그 결과 체지방 분포와 지방산 조성이 변하고, 근육의 수분보유력 및 산화안정성 저하로 육질이 악화되는 현상이 보고되었다(Lu et al., 2007; Nawab et al., 2018). 장기 열 스트레스에서는 간의 지질 항상성이 특히 취약해진다. 신생 지방합성(de novo lipogenesis, DNL)이 항진되는 한편, VLDL(very-low-density lipoprotein) 형성의 병목(예: apolipoprotein B 제한)으로 분비가 원활치 않으면 중성지방이 간 내에 축적되어 지방간 양상을 보이고, 혈장 지질 운반에도 변화를 초래한다(Lu et al., 2019). 이는 복부지방 증가, 간 내 중성지방 축적, 혈장 VLDL 변화 등으로 표면화되며(Lu et al., 2007; 2019), 궁극적으로 성장 지표와 사료효율, 도체 및 가공 성적까지 영향을 미치게 된다(Nawab et al., 2018). 따라서 열 스트레스하에서의 지방 대사 교란을 이해하고 교정하는 일은 온난화 시대의 양계 생산성과 동물복지를 동시에 지키기 위한 핵심 과제다. 본 총설은 닭의 열 스트레스에 대한 생리적 취약성, 열 스트레스가 지방 대사에 미치는 조직 수준의 영향, 그리고 미토콘드리아 기능장애와 산화스트레스를 중심으로 한 분자 및 세포 기작에 관한 최근 연구를 통합적으로 고찰함으로써, 닭의 열 스트레스 완화 및 현장 적용 전략 수립에 기여하고자 한다.
본 론
대부분의 가금류에서 성체의 열중립대는 18~20°C로 보고된다(Ensminger et al., 1990). 이 범위를 초과하면 생산성과 다양한 생리 지표가 일관되게 저하된다(Alagawany et al., 2017). 닭은 땀샘이 없고 체표가 깃털로 덮여 있어 체열 발산이 제한되므로, 고온 환경에서는 주로 호흡성 증발에 의존한다. 이때 과호흡(헐떡거림)은 CO2 감소에 따른 호흡성 알칼리증을 유발하고, 혈중 H+–HCO3− 완충계 및 Na+/K+/Cl− 전해질 항상성을 교란하여 산–염기 불균형과 심혈관 부담을 증가시킨다(Farag and Alagawany, 2018; Saeed et al., 2019). 동시에 말초 혈류가 체표 중심으로 재분배되면서 장 및 내장 혈류가 감소하고, 이로 인해 장 상피의 긴밀결합이 느슨해져 장 누수, 독소 유입, 염증 반응 증가, 그리고 영양소 흡수 효율 저하가 발생한다(Saeed et al., 2019; Goel, 2021).
세포 수준에서는 고온이 미토콘드리아 전자전달계의 전자 누출을 증가시켜 ROS 생성을 촉진하고, 지질 과산화, 단백질 변성, DNA 손상을 초래한다. 열충격단백질(HSPs)은 손상 단백질을 보정하는 샤페론(chaperone) 역할을 하지만, 스트레스가 강하거나 지속되면 보상 능력이 한계에 도달하여 조직 손상으로 이어진다(Mangan and Siwek, 2024). 내분비적으로는 시상하부–뇌하수체–부신(HPA) 축 활성화로 코르티코스테론이 증가하고, 갑상선 호르몬 저하로 기초대사가 억제된다. 이러한 반응은 단기적으로는 열 발생 억제를 통한 적응이지만, 장기적으로는 성장, 사료효율, 면역 기능을 저하시킨다(Mangan and Siwek, 2024).
열 스트레스는 선천 및 후천 면역기능 모두를 저하시켜 점막 면역 방어력을 약화시키며, 장내 미생물 균형을 교란하고 병원체 감수성을 증가시킨다(Saeed et al., 2019). 산란계에서는 알칼리증 및 칼슘 대사 교란이 난각 품질과 산란율 감소로 이어지고, 육계에서는 근육 단백질 분해 증가와 식욕 감소로 성장 억제가 나타난다(Farag and Alagawany, 2018; Mangan and Siwek, 2024).
열 스트레스에 의한 생리적 취약성은 행동, 기관, 세포, 분자 수준의 다층적 경로로 나타난다. 행동 수준에서는 헐떡임, 날개 벌림, 사료섭취 감소가 열 발생을 최소화하고, 기관 수준에서는 혈류 재분배, 장 투과도 증가, 심폐 부담이 발생한다. 세포 수준에서는 미토콘드리아 기능장애와 막 유동성 변화가 나타나며, 분자 수준에서는 ROS 및 염증성 사이토카인 증가, HSP 유도, 내분비 축 재조정 등이 관찰된다. 따라서 열 스트레스 관리 전략은 이러한 반응 축에서 어느 수준을 중재 대상으로 설정하느냐에 따라 달라질 수 있다.
조류의 간은 지방 대사에서 독특한 중추적 역할을 담당한다. 포유류와 달리 조류에서는 간이 신생 지방합성의 주요 부위로, 체내에서 합성되는 지방산의 약 90%가 간에서 유래하며 지방조직의 기여는 제한적이다(Goodridge and Ball, 1967; Leveille, 1969). 간에서 합성된 지방산은 중성지방(triacylglycerol)으로 전환되어 VLDL에 포장된 후 전신 조직으로 운반된다(Hermier, 1997). 따라서 간은 조류에서 체지방 축적 조절의 핵심 기관이다.
포유류는 식이 지방을 림프계를 통해 킬로미크론(chylomicron) 형태로 순환계에 전달하는 반면, 닭은 발달된 림프계를 가지지 않으므로 흡수된 지방이 포르토미크론(portomicron) 형태로 간문맥을 통해 직접 간으로 이동한다(Hermier, 1997). 이러한 특성은 특히 급이량이 높은 가금류에서 간 지방 축적을 용이하게 만드는 요인으로 작용한다. 조류는 체중 대비 간의 비율이 포유류보다 크며, 연령 증가에 따라 그 비율이 감소한다. 간에서 합성된 중성지방, 인지질, 콜레스테롤 등은 아포단백과 결합하여 다양한 밀도의 지단백(VLDL, LDL, IDL, HDL, vitellogenin 등)을 형성한다(Emami et al., 2020).
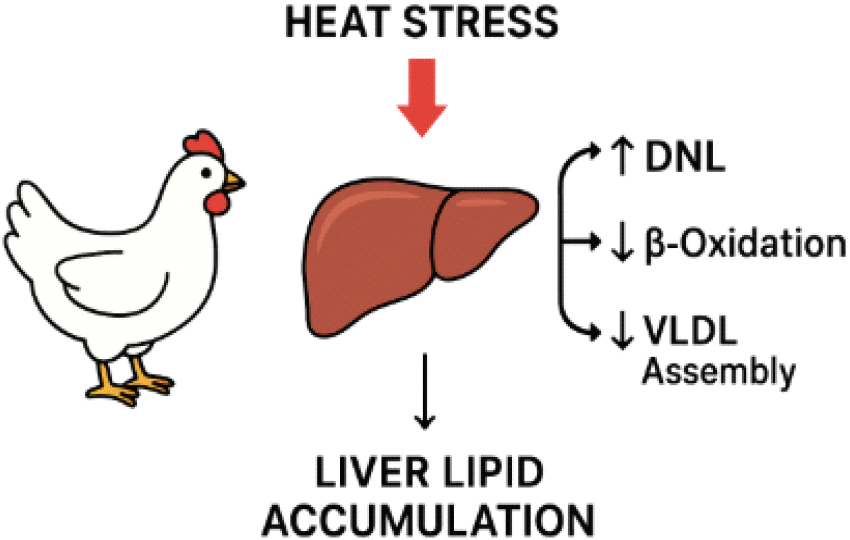
열 스트레스가 가해지면 체온 항상성 유지에 필요한 대사 재조정과 함께ROS 생성이 증가하여 간의 지질 대사 경로를 변화시킨다. 산화 스트레스는 막 지질의 과산화를 촉진하고, Nrf2 신호를 통한 항산화 반응이 증가하나, 과부하 상황에서는 지질 과산화와 염증 신호가 우세해져 간 내 지질 축적을 촉진한다(Shim et al., 2006; Emami et al., 2020). 이러한 변화는 SREBP-1c 등 지방합성 전사인자의 활성 증가로 DNL이 항진되고, AMPK/PPARα 축 억제에 따른 β-산화 감소, 그리고 ER(endoplasmic reticulum) 스트레스에 의한 ApoB 접힘과 분비 저해로 VLDL 형성과 방출이 감소하는 데 기인한다(Emami et al., 2020). 결과적으로 지방의 합성 증가는 유지되는 반면, 산화 및 방출 경로는 억제되어 간 내 중성지방이 축적된다. 실제로 만성 열 스트레스를 받은 육계에서 지방합성 관련 유전자의 증가와 ApoB 제한에 따른 VLDL 분비 저하가 보고되었으며(Lu et al., 2019), 고온은 간과 혈장의 지질 조성을 변화시키고 과산화를 증가시켜 막 안정성과 효소 활성을 저하시켰다(Shim et al., 2006). 또한 열 스트레스는 체성분 분배를 지방 쪽으로 전환시켜 복부 지방, 피하 지방, 근내 지방 축적을 증가시키고 육질 특성(보수력, 연도 등)을 저하시킬 수 있다(He et al., 2015; Lu et al., 2018; Lan et al., 2022; Tokutake et al., 2025). 단기(7일) 열 스트레스만으로도 복부 지방이 약 20% 증가하였으며(Lu et al., 2019), 장기(3주) 노출 시 복부 지방이 최대 80%까지 증가한 사례도 보고되었다(Lu et al., 2007).
조류에서 지방조직에 저장되는 대부분의 지방이 간에서 유래한 VLDL 기원임을 고려할 때, 열 스트레스 하에서의 비정상적 지방 축적은 간 중심의 지질 대사 불균형에 의해 발생하는 것으로 판단된다(Fig. 1). 즉, 열 스트레스는 지방합성 항진, β-산화 억제, VLDL 방출 장애라는 세 가지 경로를 통해 간 지방 축적을 유도하며, 이는 ROS 증가, 지질과산화, 염증, ER 스트레스가 상호 강화되는 악순환에 의해 더욱 심화된다(Shim et al., 2006; Emami et al., 2020).
열 스트레스의 생리 및 대사적 영향은 노출 강도와 지속 시간(acute, chronic, cyclic)에 따라 뚜렷한 차이를 보인다. 급성 고온 노출(수시간-1일)은 즉시적인 ROS 생성 증가와 Nrf2 매개 항산화 반응을 유도하며, HSP70 및 UPR(ATF4–eIF2α, XBP1)의 초기 활성화가 두드러진다. Mei et al.(2025)의 급성 모델에서는 ACC, FASN 등 지방합성 유전자의 초기 발현 증가가 관찰되었으나, β-산화 억제나 VLDL 수송 장애는 아직 완전히 고정된 단계가 아닌 초기 변화 수준에 머무르는 경향이 있다. 즉, 급성 노출은 대사 재편이 시작되는 단계로 해석된다. 만성 고온 노출(수일-수주)에서는 열 스트레스에 의한 지방대사 재편이 완전히 확립된 단계로 진행된다. 지방합성 관련 유전자(SREBP-1c, FASN, SCD1)의 지속적 발현 증가, CPT1A, ACOX1 등 β-산화 경로 억제, ER 스트레스 기반의 ApoB/MTTP 병목으로 인한 VLDL 조립 및 분비 저하가 일관되게 보고된다(Lu et al., 2019). 그 결과 간 중성지방 축적이 뚜렷해지고(Lu et al., 2007), 복부 지방 증가 및 혈장 지질 조성 변화까지 나타난다. 이는 대사 프로그램이 완성된 단계로 규정될 수 있다. 순환 또는 간헐적 열 스트레스는 고온 노출과 회복기가 반복되므로 회복 기간의 대사 역학이 중요한 변수로 작용한다. Lim et al.(2022)은 순환 스트레스에서 AMPK 활성이 누적적으로 저하되며, 미토콘드리아 기능과 β-산화 경로의 회복 속도가 계통 및 성장률에 따라 크게 달라짐을 보고하였다. 내열성이 높은 계통은 항산화와 지방산 산화 경로의 회복이 빠른 반면, 열 민감성 계통은 지질 대사 장애가 누적된다(Lan et al., 2016). 즉, 순환 스트레스는 회복–적응–누적 장애가 동시에 작동하는 별도의 패턴으로 이해할 필요가 있다.
세포 수준에서 열 스트레스는 산화 스트레스, 단백질 변성, 대사 조절 이상을 포함한 일련의 병리적 사건을 유발한다(Akbarian et al., 2016). 간은 지질대사와 에너지 항상성의 중심 기관으로서 열 스트레스 상황에서 핵심적이지만 동시에 매우 취약한 장기이다(Emami et al., 2020). 닭에서 고온 노출은 간 지질대사의 전반적인 재프로그램을 일으키며, 전사체 및 대사체 통합 분석 결과 고온 환경에서는 지방산 합성이 증가하고, β-산화가 감소하며, 지방의 외부 수송이 저하되는 방향으로 대사 경로가 재배열되는 것으로 나타난다. 구체적으로 acetyl-CoA carboxylase(ACC), fatty acid synthase(FASN), stearoyl-CoA desaturase-1(SCD1)과 같은 신생 지방합성 관련 유전자가 상향 조절되는 반면, CPT1A, ACOX1, ETFDH 등 미토콘드리아 및 퍼옥시좀의 지방산 산화를 조절하는 핵심 인자는 억제된다. 동시에 VLDL 조립과 분비에 관여하는 ApoB와 MTTP(microsomal triglyceride transfer protein) 네트워크는 병목 현상을 보여 결과적으로 간 내 중성지방 축적을 가속화한다(Jastrebski et al., 2017). 열 내성 수준이 다른 닭 계통 간 비교 연구에서도 지질대사 관련 유전자군이 공통적으로 고온에 민감하게 반응하였으나, 반응의 크기와 우선순위는 계통에 따라 달랐으며, 이는 유전적 배경에 따라 대사 적응 양상이 조절됨을 시사한다(Lan et al., 2016). 이러한 대사 재편을 유도하는 상위 신호 가운데 ROS 축은 핵심적 조절자로 작동한다. 열 스트레스는 미토콘드리아 전자 누출과 NADPH oxidase(NOX) 활성 증가를 통해 ROS를 축적시키며(Bedard and Krause, 2007), 축적된 ROS는 Keap1–Nrf2 항산화 경로를 활성화하는 동시에 SREBP-1c와 ChREBP 매개 지방합성 전사를 촉진하고 AMPK/PPARα 기반 지방산 산화를 억제하는 방향으로 전사 프로그램을 전환시킨다(Jastrebski et al., 2017; Mei et al., 2025). 특히 HSP70은 간세포 모델에서 SREBP-1 신호를 강화하여 지방합성을 증가시키는 것으로 보고된 바 있으며, 닭 간에서도 HSP70/90의 일관된 유도 증가가 관찰된다는 점을 고려하면, ROS–HSP–SREBP로 연결되는 지방합성 촉진 회로가 존재할 가능성이 높다(Zhang et al., 2018). 열 및 산화 스트레스는 동시에 소포체(ER)의 단백질 접힘 부담을 증가시켜 PERK–eIF2α, IRE1–XBP1, ATF6로 대표되는 비-접힘 단백질 반응(unfolded protein response, UPR)를 활성화한다. 전사체 분석에서는 XBP1 표적 유전자, ER-연관 분해, 샤페론 유전자의 발현이 일관되게 증가하였으며(Jastrebski et al., 2017; Mei et al., 2025), 이러한 UPR 신호는 SREBP 성숙 촉진, PLIN2 기반 지질구 형성 증가, ApoB 접힘 및 분비 장애로 수렴하여 MTTP 의존적 VLDL 조립을 제한한다. 그 결과 지방합성 증가, β-산화 억제, 지질 배출 병목 현상이 복합적으로 작용하여 간 내 중성지방 축적을 심화시킨다. 즉, ROS–HSP–UPR 축이 간 지질 항상성을 다방향으로 교란시키는 것이다(Fig. 2). 열 스트레스 노출 형태에 따른 시간적 역학도 뚜렷하다. 급성 열 스트레스에서는 ROS–Nrf2 기반의 즉시 반응과 HSP 및 UPR의 빠른 유도가 우세하며, 지방합성 유전자의 초기 발현 증가가 동반된다(Mei et al., 2025). 반면 만성 또는 반복적 열 스트레스에서는 AMPK 활성이 지속적으로 낮아지고, 지방산 산화 경로의 억제가 장기화되며, 미토콘드리아 대사조절 유전자의 재적응이 나타난다(Lim et al., 2022). 동일한 강도의 열 스트레스 조건에서도 빠른 성장을 보이는 개체군은 지방산 산화 회복이 느린 반면, 내열성이 높은 계통은 항산화 및 지질산화 경로의 재가동이 상대적으로 빠르게 이루어져 유전형과 환경과의 상호작용의 중요성이 강조된다(Lan et al., 2016; Lim et al., 2022). 닭에서 열 스트레스가 SREBP–AMPK–PPAR 축을 실제로 어떻게 변화시키는지는 최근의 in vivo 연구들에서 보다 명확히 제시되고 있다. 급성 열 스트레스 모델(Mei et al., 2025)에서는 간 조직에서 SREBP-1c, ACC, FASN의 발현이 빠르게 증가하였고, 동시에 CPT1A, ACOX1 등 β-산화 관련 PPARα 표적 유전자가 유의하게 하향되었다. 이는 개념적으로 제시되는 ‘지방합성 증가–지방산 산화 감소’가 단순한 기전적 예측이 아니라, 닭 간에서 이미 수 시간 내에 발생하는 실제 반응임을 보여준다. 만성 고온 노출(Lu et al., 2019)에서도 유사한 전사 조절 패턴이 확인된다. 만성 열 스트레스를 받은 육계의 간에서는 SREBP-1c 및 FASN 단백질 수준이 일관되게 상승하고 AMPK 인산화(활성형 AMPK)가 유의적으로 감소하며 PPARα 및 그 표적 유전자의 발현이 강하게 억제되어 SREBP 활성 증가–AMPK 억제–PPARα 억제가 동시에 in vivo에서 실측된 결과로 나타났다. 특히 AMPK 활성이 감소할 경우 SREBP-1c의 핵내 이동과 FASN 전사의 활성이 증가한다는 기존 기전이, 실제 닭 간에서도 동일한 방향으로 확인된 것이다. 또한 Jastrebski et al.(2017)의 전사체–대사체 통합 분석은 열 스트레스에 반응한 닭 간에서 SREBP-1 계열의 상향 조절, 지방산 산화 및 PPAR 신호의 억제, AMPK 경로 관련 유전자의 발현 감소가 동시에 관찰되며, 이는 SREBP–AMPK–PPAR의 상호작용이 닭 간의 전체 대사 프로그램을 재배열하는 중심축임을 지지한다. 이러한 결과들은 SREBP, AMPK, PPAR의 상호작용이 단순 개념 모델이 아니라, 닭 간의 대사 변화(지방합성 항진, β-산화 억제, 지질수송 감소)를 직접 매개하는 실제 in vivo 경로임을 명확히 보여준다.
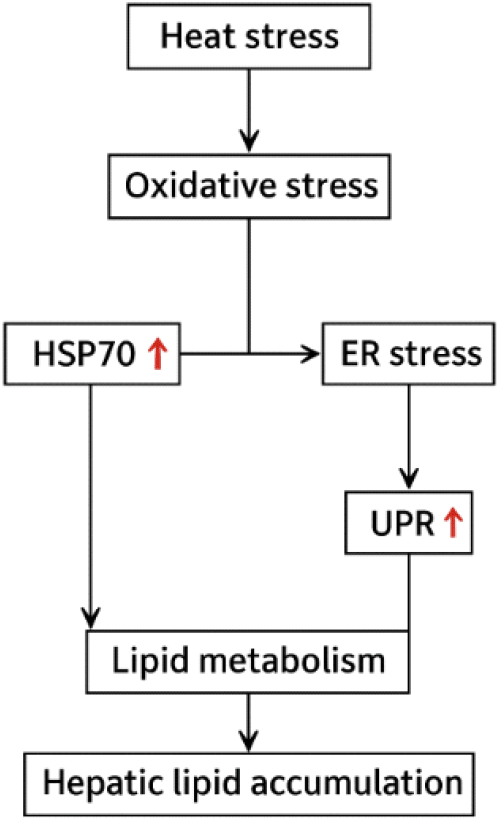
열 스트레스는 ROS 증가와 지질과산화의 항진을 매개로 SREBP-1c 의존적 지방합성을 촉진하고, β-산화와 지질 방출을 저해하는 방향으로 간 지질대사를 재편한다. 이러한 기전을 고려할 때, 효과적인 완화 전략은 산화 손상 억제, 산화적 지질분해 회복, VLDL 분비 병목 완화의 세 측면에서 접근하는 것이 바람직하다. 항산화 영양 전략은 ROS–지질과산화 악순환을 차단하는 데 중점을 둔다. 고온 사양에서 비타민 C 및 E 보급은 말론디알데하이드(MDA) 등 지질과산화 지표를 유의적으로 감소시키며, 혈청 대사 및 무기질 균형을 개선하여 세포막 안정성과 효소 활성을 유지하는 것으로 보고되었다(Kumbhar et al., 2018; Sahin et al., 2002). 메추리에서도 유사한 효과가 관찰되었으며(Sahin et al., 2003), 특히 비타민 C는 스트레스 호르몬과 산화환원 상태를 조절하여 사료섭취량과 성장 성적을 개선하고, 글루타티온 순환을 포함한 항산화 체계를 강화함으로써 간 지방 축적을 완화하는 데 기여한다(Chung et al., 2005; Khan et al., 2012; Jang et al., 2014). 이러한 항산화 강화는 SREBP-1c 활성 억제 및 AMPK/PPARα 신호 회복으로 이어져 β-산화 개선에도 간접적으로 기여한다(Prates, 2025).
메틸공여체 및 비타민 보강 전략은 간 VLDL 조립 및 분비 기능을 향상시키는 데 중요하다. 엽산 보충은 고온 환경에서 대사 및 생리지표를 개선하는 것으로 보고되었으며(Sahin et al., 2003), 메티오닌 및 콜린 기반의 메틸 대사는 ApoB 및 MTTP이 관여하는 VLDL 조립에 필수적이다(Lima et al., 2024; Peng et al., 2018). 콜린은 간에서 중성지방을 운반하여 배출하는 VLDL의 구성 성분으로서, 이 과정을 통해 간 내 지방 축적을 감소시키는 역할을 한다(Selvam et al., 2018; Khose et al., 2019). 콜린은 지방산 합성효소(FANS) 유전자 발현을 하향조절하고 그 활성을 약화시킴으로써 지방산 합성을 억제한한다(Zhu et al., 2014). 더 나아가 콜린은 체내 지방 이용률을 증가시켜 지방 축적을 감소시키는 역할을 하기 때문에 지방이동 인자로도 알려져 있다(Selvam et al., 2018). 따라서 메틸공여 능력 보강은 간 내 중성지방 축적을 감소시키는 핵심 요소로 평가된다.
사료 조성 및 내분비 조절 전략은 지방합성 항진을 억제하는 데 효과적이다. 고탄수화물 사료는 대사열 증가를 통해 간 합성 대사를 자극할 수 있는 반면, 필수지방산 및 오메가-3 지방산은 염증 신호를 완화하고 지질대사 균형 유지에 유리하게 작용한다(Cherian 2015; Alagawany et al., 2019; Surugihalli et al., 2019; Li et al., 2024). 내분비적 측면에서는 외인성 17β-에스트라디올이 고온 조건에서 간 지방 축적을 촉진한다는 보고가 있으며(Takahashi et al., 1984), 산란계에서도 에스트로겐 축이 VLDLy 생성 및 지질 운반을 조절하므로 불필요한 에스트로겐성 자극을 최소화하고, 사료 원료의 잠재적 내분비 교란 요인을 관리하는 것이 중요하다.
환경 관리와 영양 개입의 병행은 상호 보완적 효과를 나타낸다. 환기, 증발냉각, 차광, 사육밀도 조절 등은 체열 축적을 감소시키고, 영양 개입의 효율을 높인다(Goel, 2021). 또한 전해질 및 수분 관리(K+·Na+·Cl− 보충 포함)는 산-염기 균형을 유지하고 순환역학을 안정화하여 간 혈류와 대사 회복을 지원한다(Koelkebeck et al., 1993; Balnave and Muheereza, 1997).
최근의 연구들에서는 항산화제, 메틸공여체, 지방산 조성 조절 전략을 단독으로 투여한 경우와 복합적으로 적용한 경우의 효과 차이가 보다 명확히 제시되고 있다. 단독 처리의 경우, 비타민 C 또는 E는 열 스트레스 상태에서 MDA 감소, 항산화 효소 활성 증가(SOD, GSH-Px), 사료섭취량 회복 등 산화 스트레스 직접 완화 효과를 보여 왔다(Khan et al., 2012; Kumbhar et al., 2018). 메틸공여체 단독 처리(콜린 또는 메티오닌 보강)는 VLDL 조립–분비(ApoB, MTTP 기반)의 효율을 개선하고 간 중성지방 축적을 감소시키는 지질 수송 개선 효과가 확인되었다(Peng et al., 2018; Lima et al., 2024). 또한 오메가-3/6 비율 조정 또는 n-3 지방산 보충은 염증성 사이토카인 감소 및 막 안정성 향상 등 지방산 조성 기반의 항염과 지질 균형 개선 효과를 제공한다(Cherian, 2015; Li et al., 2024). 그러나 최근 닭 in vivo 연구에서는 이러한 전략을 복합적으로 적용할 때 시너지 효과가 나타난다는 보고가 증가하고 있다. 예를 들어, 비타민 E + 메티오닌을 동시 보충한 경우 항산화 지표 개선뿐 아니라 VLDL 분비 회복과 간 중성지방 감소가 단독 처리보다 크게 나타났으며, 이는 산화 스트레스 완화(비타민 E) + 메틸 대사 개선(메티오닌)이 동시에 작동했기 때문이다(Sahin et al., 2003). 또한 비타민 C/E와 콜린을 복합 처리한 실험에서도 간 지방 축적 감소, 혈중 지질 균형 개선, 성장률 회복 상승폭이 각각 단독 처리보다 더 뚜렷했으며, 이는 항산화–지질수송–막 안정성 기전이 상호보완적으로 작용한 결과로 해석된다(Chung et al., 2005; Selvam et al., 2018). 특히 고온 환경에서 항산화제 + 오메가-3 지방산 복합 처리 시 Nrf2–PPARα 경로 활성화 및 β-산화 회복이 단독 처리 대비 크게 향상된다는 보고가 있으며(Lu et al., 2018), 이는 항산화 기반 회복과 미토콘드리아 지질 산화 활성 회복이 동시에 기여할 때 시너지 효과가 강화될 수 있음을 시사한다.
종합하면, 열 스트레스 환경에서 간 지질대사 개선은 (1) 항산화 체계 강화, (2) 메틸 대사 보완을 통한 VLDL 수송 기능 회복, (3) 대사열이 낮은 사료 에너지 구성의 재설계, (4) 환경 및 전해질 관리의 병행이라는 다축적 접근을 통해 달성될 수 있다. 이러한 복합 전략은 간 지방 축적을 감소시키고, 생산성과 육질을 동시에 개선하는 효과적 수단으로 평가된다.
결 론
열 스트레스는 닭의 간 지질대사를 지방 합성 증가–지방산 산화 저하–지질 수출 억제의 방향으로 재편하여 지방간 형성과 체지방 분포 변화를 유도한다. 이러한 대사 재편의 핵심에는 미토콘드리아 기능장애로 인한 과도한 ROS 생성과 ER 스트레스가 있으며, 이들은 SREBP-1/FASN 축을 활성화하여 지방 합성을 촉진하는 동시에 VLDL 조립(apoB/MTTP)을 저해함으로써 간 중성지방 축적을 가속한다. 그 결과 혈중 지질 이상, 지방산 조성 변화, 육질 저하 및 생산성 감소가 일관되게 관찰된다(Fig. 3). 열 스트레스 반응의 강도와 양상은 품종, 성장 단계, 급성 및 순환 노출 특성에 따라 상이하므로 개체군 특성에 기반한 맞춤형 관리가 요구된다. 효과적인 대응 전략은 단일 요법이 아니라 다층적, 통합적 접근이어야 한다. 항산화제와 전해질 보강은 산화 스트레스를 완화하고 대사 항상성 회복에 기여하며, 콜린, 메티오닌, 엽산 등 메틸공여체 보충은 지질 수송과 간 지방대사 균형 유지에 핵심적 역할을 한다. 나아가 유전체 및 대사체 기반의 내열성 선발 전략을 병행할 경우, 간 지질대사 안정화와 열 스트레스 저항성 향상 간의 시너지 효과가 기대된다.









